化学人教版(2019)选择性必修2 3.3.1.金属键与金属晶体(共20张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.3.1.金属键与金属晶体(共20张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-02 08:17:30 | ||
图片预览






文档简介
(共20张PPT)
金属键与金属晶体
学习目标
1.知道金属晶体的结构特点,能借助金属晶体模型说明金属晶体中粒子及粒子间的相互作用。
2.能从金属原子结构的视角认识金属键的本质。
3.能从“电子气理论”解析金属具有导电性、导热性和延展性的原因。
生活中的金属
金属的物理通性:具有金属光泽、导电性、导热性、延展性等
金 Au
铝 Al
铜 Cu
钨 W
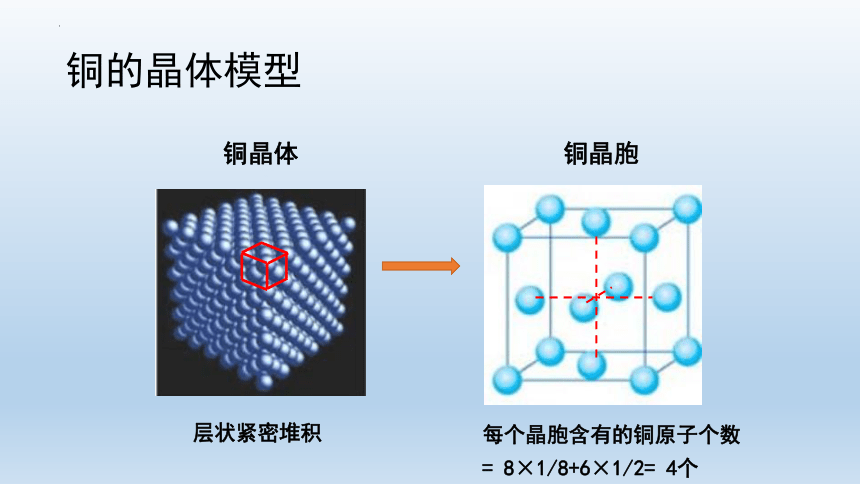
铜晶体
铜晶胞
铜的晶体模型
层状紧密堆积
每个晶胞含有的铜原子个数= 8×1/8+6×1/2= 4个
一、金属键与金属晶体
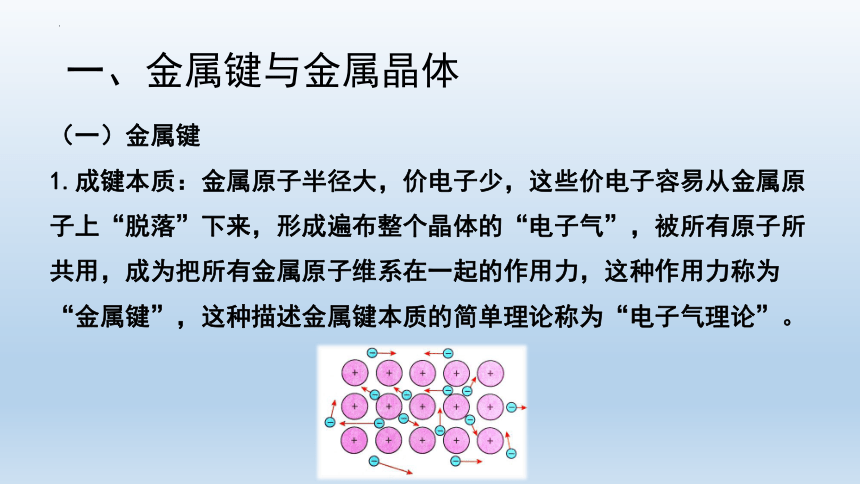
(一)金属键
1.成键本质:金属原子半径大,价电子少,这些价电子容易从金属原子上“脱落”下来,形成遍布整个晶体的“电子气”,被所有原子所共用,成为把所有金属原子维系在一起的作用力,这种作用力称为“金属键”,这种描述金属键本质的简单理论称为“电子气理论”。
一、金属键与金属晶体
(一)金属键
2.定义:在金属晶体中金属阳离子(由金属原子脱落价电子后形成)与电子气之间强烈的相互作用。
一、金属键与金属晶体
(一)金属键
3.特征:
①电子气不是专属于某个特定的金属阳离子,而是在整块固态金属中自由移动。
②金属键既没有方向性,也没有饱和性。
③金属键的成键粒子是金属阳离子和电子气。
一、金属键与金属晶体
(二)金属晶体
1.定义:金属(除汞外)在常温下都是晶体,称其为金属晶体。
2.组成微粒:金属原子、金属阳离子(由金属原子脱落价电子后形成)、电子气
3.微粒间的作用力:金属键
4.晶胞特征:层状紧密堆积
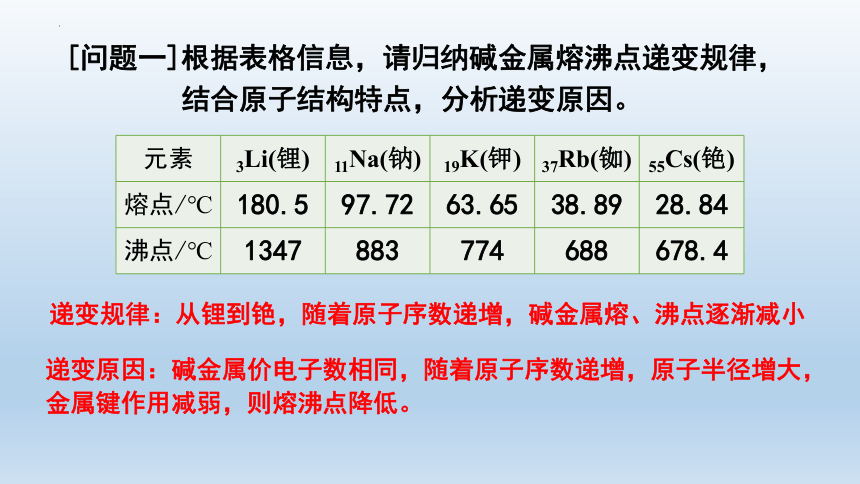
[问题一]根据表格信息,请归纳碱金属熔沸点递变规律,
结合原子结构特点,分析递变原因。
元素 3Li(锂) 11Na(钠) 19K(钾) 37Rb(铷) 55Cs(铯)
熔点/℃ 180.5 97.72 63.65 38.89 28.84
沸点/℃ 1347 883 774 688 678.4
递变规律:从锂到铯,随着原子序数递增,碱金属熔、沸点逐渐减小
递变原因:碱金属价电子数相同,随着原子序数递增,原子半径增大,金属键作用减弱,则熔沸点降低。
金属键
金属的物理性质
原子半径
价电子数
原子半径越大,价电子数越少,
金属键越弱,反之则金属键越强
延展性
导电性
导热性
金属光泽
......
金属键越强,金属的熔沸点越高,硬度越大
熔沸点
5.金属键的影响因素:
[问题二]根据“电子气理论”解析金属的以下通性
1.导电性
2.导热性
3.延展性
[问题二]根据“电子气理论”解析金属的通性
1.导电性
1.导电性
在金属晶体中,充满着带负电的“电子气”,这些电子气的运动是无序的,但在外加电场的条件下,自由电子定向运动形成电流,所以金属容易导电。
外加电场
[问题二]根据“电子气理论”解析金属的通性
种类 电解质 金属
导电的要求
是否需要电源
导电粒子
导电时发生的变化
水溶液或熔融状态下电离
固体、液体、气体
自由移动的离子
电子气
化学变化
物理变化
1.导电性
[问题二]根据“电子气理论”解析金属的通性
是
是
1.导电性
[问题二]根据“电子气理论”解析金属的通性
金属 电导率(20℃)
%IACS MS/m
软铜 ≥100 ≥58
硬铜 ≥97 ≥56.26
软铝 ≥61 ≥35.4
硬铝 ≥59.5 ≥34.51
银 ≥108 ≥62.5
钛 ≥3.6 ≥2.08
铅 ≥7.8 ≥4.5
金 ≥70.7 ≥41
镁 ≥38 ≥22
不同的金属导电能力不同,导电性最强的四种金属是:Ag、Cu、Au、Al。
电子气在金属晶体中无序运动时,与金属原子、金属阳离子相互碰撞,在碰撞过程中会发生能量交换。当金属的某一部分受热时,从区域获得能量通过这种相互碰撞,将能量从温度高的区域传递到温度低的区域,最后使整块金属的温度趋于一致。
2.导热性
[问题二]根据“电子气理论”解析金属的通性
金属晶胞具有层状紧密堆积特征,当金属受到外力作用时,晶体中的各原子层就会发生相对滑动,但不会改变原来的排列方式,电子气没有被破坏,使得弥散在整个晶体的电子气能把所有金属原子维系在一起,所以金属能“拉伸”但不易断裂,具有良好的延展性。
3.延展性
外力
[问题二]根据“电子气理论”解析金属的通性
在现实生活中,很多金属制品利用了金属的延展性。
金属有延性,是指金属可以抽成细丝。例如:金属钨制成钨丝利用了金属的延性;最细的白金丝直径不过2×10-7m。
金属又有展性,是指可以压成薄片,例如:金属铝制成铝箔利用了金属的展性。
延展性最好的金属是金,一两黄金,压成金箔可覆盖两个篮球场。
3.延展性
[问题二]根据“电子气理论”解析金属的通性
钨丝
铝箔
金箔
yi
三种晶体模型
晶体类型 金属晶体 分子晶体 共价晶体
构成微粒
物质类别
物理性质
决定熔沸点高低的因素
导电性
金属阳离子、自由电子
分子
原子
金属单质、合金
非金属氢化物、部分非金属单质、部分非金属氧化物、酸、大多数有机物
某些单质如硅、锗等,某些非金属化合物如二氧化硅、碳化硅等
硬度和密度较大,熔沸点较高
硬度和密度较小,熔沸点较低
硬度和密度大,熔沸点高
金属键强弱
范德华力(或氢键)的强弱
共价键的强弱
固态、熔融均可导电
某些溶于水能导电
不导电(硅、锗是半导体)
金属键与金属晶体
学习目标
1.知道金属晶体的结构特点,能借助金属晶体模型说明金属晶体中粒子及粒子间的相互作用。
2.能从金属原子结构的视角认识金属键的本质。
3.能从“电子气理论”解析金属具有导电性、导热性和延展性的原因。
生活中的金属
金属的物理通性:具有金属光泽、导电性、导热性、延展性等
金 Au
铝 Al
铜 Cu
钨 W
铜晶体
铜晶胞
铜的晶体模型
层状紧密堆积
每个晶胞含有的铜原子个数= 8×1/8+6×1/2= 4个
一、金属键与金属晶体
(一)金属键
1.成键本质:金属原子半径大,价电子少,这些价电子容易从金属原子上“脱落”下来,形成遍布整个晶体的“电子气”,被所有原子所共用,成为把所有金属原子维系在一起的作用力,这种作用力称为“金属键”,这种描述金属键本质的简单理论称为“电子气理论”。
一、金属键与金属晶体
(一)金属键
2.定义:在金属晶体中金属阳离子(由金属原子脱落价电子后形成)与电子气之间强烈的相互作用。
一、金属键与金属晶体
(一)金属键
3.特征:
①电子气不是专属于某个特定的金属阳离子,而是在整块固态金属中自由移动。
②金属键既没有方向性,也没有饱和性。
③金属键的成键粒子是金属阳离子和电子气。
一、金属键与金属晶体
(二)金属晶体
1.定义:金属(除汞外)在常温下都是晶体,称其为金属晶体。
2.组成微粒:金属原子、金属阳离子(由金属原子脱落价电子后形成)、电子气
3.微粒间的作用力:金属键
4.晶胞特征:层状紧密堆积
[问题一]根据表格信息,请归纳碱金属熔沸点递变规律,
结合原子结构特点,分析递变原因。
元素 3Li(锂) 11Na(钠) 19K(钾) 37Rb(铷) 55Cs(铯)
熔点/℃ 180.5 97.72 63.65 38.89 28.84
沸点/℃ 1347 883 774 688 678.4
递变规律:从锂到铯,随着原子序数递增,碱金属熔、沸点逐渐减小
递变原因:碱金属价电子数相同,随着原子序数递增,原子半径增大,金属键作用减弱,则熔沸点降低。
金属键
金属的物理性质
原子半径
价电子数
原子半径越大,价电子数越少,
金属键越弱,反之则金属键越强
延展性
导电性
导热性
金属光泽
......
金属键越强,金属的熔沸点越高,硬度越大
熔沸点
5.金属键的影响因素:
[问题二]根据“电子气理论”解析金属的以下通性
1.导电性
2.导热性
3.延展性
[问题二]根据“电子气理论”解析金属的通性
1.导电性
1.导电性
在金属晶体中,充满着带负电的“电子气”,这些电子气的运动是无序的,但在外加电场的条件下,自由电子定向运动形成电流,所以金属容易导电。
外加电场
[问题二]根据“电子气理论”解析金属的通性
种类 电解质 金属
导电的要求
是否需要电源
导电粒子
导电时发生的变化
水溶液或熔融状态下电离
固体、液体、气体
自由移动的离子
电子气
化学变化
物理变化
1.导电性
[问题二]根据“电子气理论”解析金属的通性
是
是
1.导电性
[问题二]根据“电子气理论”解析金属的通性
金属 电导率(20℃)
%IACS MS/m
软铜 ≥100 ≥58
硬铜 ≥97 ≥56.26
软铝 ≥61 ≥35.4
硬铝 ≥59.5 ≥34.51
银 ≥108 ≥62.5
钛 ≥3.6 ≥2.08
铅 ≥7.8 ≥4.5
金 ≥70.7 ≥41
镁 ≥38 ≥22
不同的金属导电能力不同,导电性最强的四种金属是:Ag、Cu、Au、Al。
电子气在金属晶体中无序运动时,与金属原子、金属阳离子相互碰撞,在碰撞过程中会发生能量交换。当金属的某一部分受热时,从区域获得能量通过这种相互碰撞,将能量从温度高的区域传递到温度低的区域,最后使整块金属的温度趋于一致。
2.导热性
[问题二]根据“电子气理论”解析金属的通性
金属晶胞具有层状紧密堆积特征,当金属受到外力作用时,晶体中的各原子层就会发生相对滑动,但不会改变原来的排列方式,电子气没有被破坏,使得弥散在整个晶体的电子气能把所有金属原子维系在一起,所以金属能“拉伸”但不易断裂,具有良好的延展性。
3.延展性
外力
[问题二]根据“电子气理论”解析金属的通性
在现实生活中,很多金属制品利用了金属的延展性。
金属有延性,是指金属可以抽成细丝。例如:金属钨制成钨丝利用了金属的延性;最细的白金丝直径不过2×10-7m。
金属又有展性,是指可以压成薄片,例如:金属铝制成铝箔利用了金属的展性。
延展性最好的金属是金,一两黄金,压成金箔可覆盖两个篮球场。
3.延展性
[问题二]根据“电子气理论”解析金属的通性
钨丝
铝箔
金箔
yi
三种晶体模型
晶体类型 金属晶体 分子晶体 共价晶体
构成微粒
物质类别
物理性质
决定熔沸点高低的因素
导电性
金属阳离子、自由电子
分子
原子
金属单质、合金
非金属氢化物、部分非金属单质、部分非金属氧化物、酸、大多数有机物
某些单质如硅、锗等,某些非金属化合物如二氧化硅、碳化硅等
硬度和密度较大,熔沸点较高
硬度和密度较小,熔沸点较低
硬度和密度大,熔沸点高
金属键强弱
范德华力(或氢键)的强弱
共价键的强弱
固态、熔融均可导电
某些溶于水能导电
不导电(硅、锗是半导体)
