化学人教版(2019)必修第一册1.2.1电解质的电离(共17张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.2.1电解质的电离(共17张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 12.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-02 08:19:05 | ||
图片预览




文档简介
(共17张PPT)
电解质的电离
湿手不要摸电器
干燥绝缘要牢记
汗液(NaCl溶液)能导电?
任务1:设计实验探究NaCl溶液能否导电
实验现象:
实验结论:
灯泡发光
NaCl溶液能导电
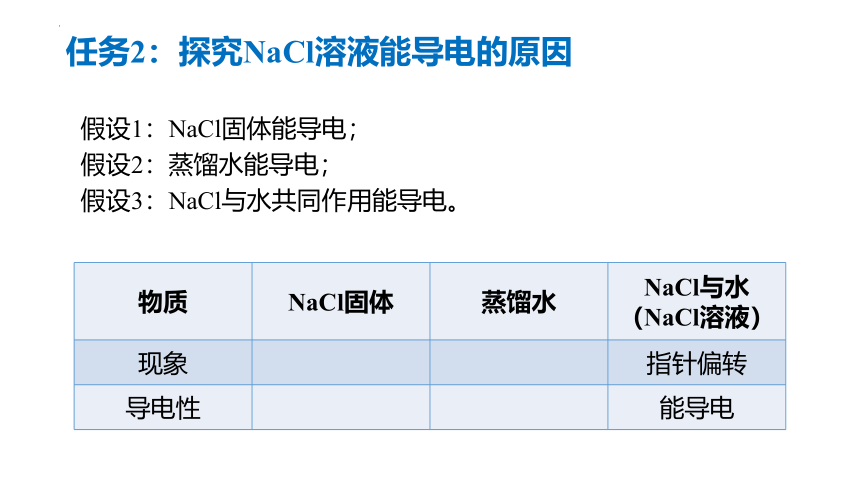
任务2:探究NaCl溶液能导电的原因
假设1:NaCl固体能导电;
假设2:蒸馏水能导电;
假设3:NaCl与水共同作用能导电。
物质 NaCl固体 蒸馏水 NaCl与水
(NaCl溶液)
现象 指针偏转
导电性 能导电
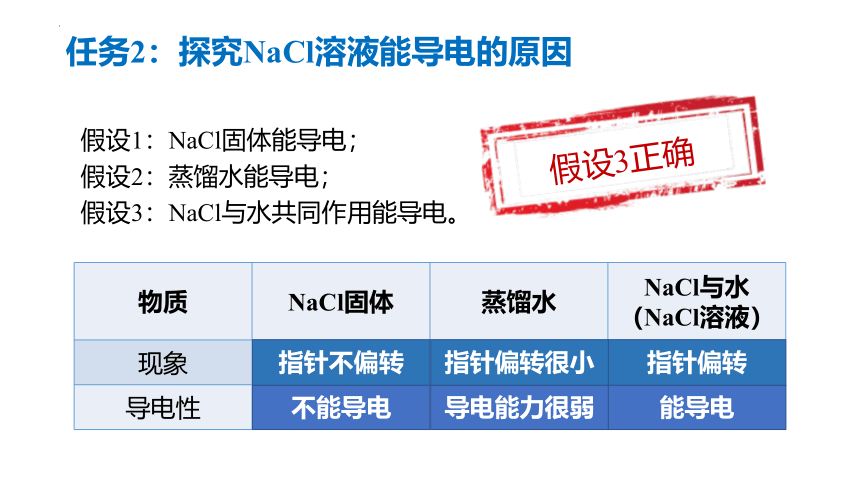
任务2:探究NaCl溶液能导电的原因
假设1:NaCl固体能导电;
假设2:蒸馏水能导电;
假设3:NaCl与水共同作用能导电。
物质 NaCl固体 蒸馏水 NaCl与水
(NaCl溶液)
现象
导电性
指针偏转
能导电
指针不偏转
不能导电
指针偏转很小
导电能力很弱
假设3正确
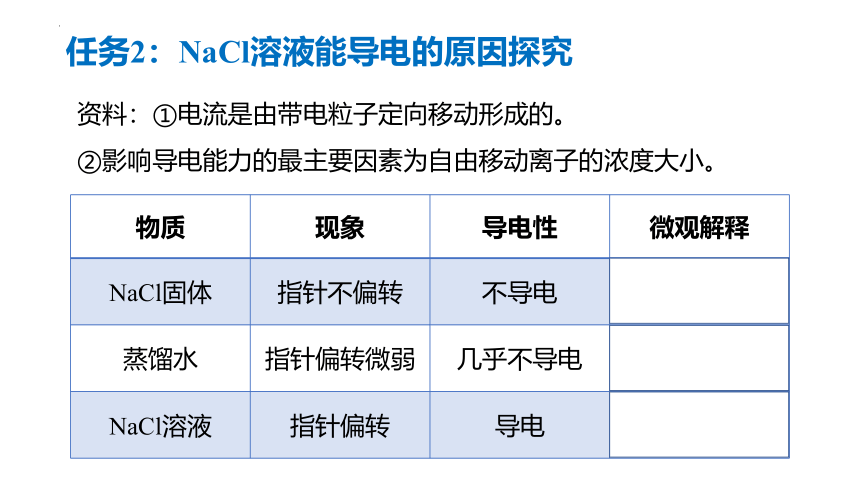
任务2:NaCl溶液能导电的原因探究
物质 现象 导电性 微观解释
NaCl固体 指针不偏转 不导电 无自由移动的电荷
蒸馏水 指针偏转微弱 几乎不导电 自由移动的电荷很少
NaCl溶液 指针偏转 导电 有较多自由移动的电荷
资料:①电流是由带电粒子定向移动形成的。
②影响导电能力的最主要因素为自由移动离子的浓度大小。
熔融NaCl导电性实验
实验现象:
实验结论:
灯泡发光
熔融NaCl能导电
物质 现象 导电性 微观解释
NaCl固体 指针不偏转 不导电 无自由移动的电荷
蒸馏水 指针偏转微弱 几乎不导电 自由移动的电荷很少
NaCl溶液 指针偏转 导电 有较多自由移动的电荷
熔融NaCl
指针偏转
导电
有较多自由移动的电荷
任务2:NaCl溶液能导电的原因探究
物质 NaCl固体 NaCl溶液 熔融NaCl
宏观现象 不导电 能导电 能导电
微观本质
带电离子 不能自由移动 离子能自由移动 离子能自由移动
电解质 非电解质
定义 在水溶液里或熔融状态下能够导电的化合物 在水溶液里和熔融状态下均不能能导电的化合物
本质区别 在水溶液里或熔融状态下能形成自由移动离子 在水溶液里和熔融状态下都不能形成自由移动离子
物质类型 ①酸:HNO3、HCl、H2SO4、H3PO4、H2CO3;②碱:NaOH、NH3·H2O、Ca(OH)2;③盐:NaCl、KNO3、CaCO3;④部分金属氧化物:NaO;⑤H2O ①大部分非金属氧化物:②:NH3;③大部分有机物:蔗糖、酒精、CH4等
Cl
Na+
NaCl固体
熔融NaCl
NaCl溶液
电解质
带电离子不能自由移动
能自由移动的Na+和Cl-
能自由移动的Na+和Cl-
电离
电解质电离的符号表示
电离:电解质溶于水或受热熔化时,形成自由移动的离子的过程。
电离方程式:用来表示电解质的电离
NaCl Na+ + Cl-
任务2:NaCl溶液能导电的原因探究
物质 NaCl固体 NaCl溶液 熔融NaCl
宏观现象 不导电 能导电 能导电
微观本质
符号表征 \
NaCl Na+ + Cl-
电解质和非电解质
电解质溶液能导电是由于电解质本身能电离出自由移动的离子
CO2
SO2
SO3
NH3
H2CO3
H2SO3
H2SO4
NH3·H2O
+H2O
自身不能电离出阴、阳离子
非电解质
自身能电离出自由移动的阴、阳离子
电解质
任务3:模型应用,探究本质
从电离的角度认识溶液,书写电离方程式
第一组:HCl、H2SO4、HNO3
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
HNO3 = H+ + NO3-
酸的本质:电离时生成的
阳离子全部是H+的化合物。
NaOH = Na+ + OH-
KOH = K+ + OH-
Ba(OH)2 = Ba2++ 2OH-
第二组:NaOH、KOH、Ba(OH)2
碱的本质:电离时生成的阴离子全部是OH-的化合物。
任务3:用化学用语表示电解质电离
从电离的角度认识溶液,书写电离方程式
第三组:KCl、Na2CO3、CuSO4
KCl = K+ + Cl-
Na2CO3 = 2Na+ + CO32-
CuSO4 = Cu2+ + SO4 2-
电离时能生成金属阳离子(或NH4+)和酸根离子的化合物
讨论 如何判断某物质是否是电解质?
1
宏观实验事实
—水溶液里或熔融状态下能够导电的化合物
2
微观粒子构成
—由离子构成的化合物
3
物质类别的角度
—酸、碱和大多数盐
电解质的电离
湿手不要摸电器
干燥绝缘要牢记
汗液(NaCl溶液)能导电?
任务1:设计实验探究NaCl溶液能否导电
实验现象:
实验结论:
灯泡发光
NaCl溶液能导电
任务2:探究NaCl溶液能导电的原因
假设1:NaCl固体能导电;
假设2:蒸馏水能导电;
假设3:NaCl与水共同作用能导电。
物质 NaCl固体 蒸馏水 NaCl与水
(NaCl溶液)
现象 指针偏转
导电性 能导电
任务2:探究NaCl溶液能导电的原因
假设1:NaCl固体能导电;
假设2:蒸馏水能导电;
假设3:NaCl与水共同作用能导电。
物质 NaCl固体 蒸馏水 NaCl与水
(NaCl溶液)
现象
导电性
指针偏转
能导电
指针不偏转
不能导电
指针偏转很小
导电能力很弱
假设3正确
任务2:NaCl溶液能导电的原因探究
物质 现象 导电性 微观解释
NaCl固体 指针不偏转 不导电 无自由移动的电荷
蒸馏水 指针偏转微弱 几乎不导电 自由移动的电荷很少
NaCl溶液 指针偏转 导电 有较多自由移动的电荷
资料:①电流是由带电粒子定向移动形成的。
②影响导电能力的最主要因素为自由移动离子的浓度大小。
熔融NaCl导电性实验
实验现象:
实验结论:
灯泡发光
熔融NaCl能导电
物质 现象 导电性 微观解释
NaCl固体 指针不偏转 不导电 无自由移动的电荷
蒸馏水 指针偏转微弱 几乎不导电 自由移动的电荷很少
NaCl溶液 指针偏转 导电 有较多自由移动的电荷
熔融NaCl
指针偏转
导电
有较多自由移动的电荷
任务2:NaCl溶液能导电的原因探究
物质 NaCl固体 NaCl溶液 熔融NaCl
宏观现象 不导电 能导电 能导电
微观本质
带电离子 不能自由移动 离子能自由移动 离子能自由移动
电解质 非电解质
定义 在水溶液里或熔融状态下能够导电的化合物 在水溶液里和熔融状态下均不能能导电的化合物
本质区别 在水溶液里或熔融状态下能形成自由移动离子 在水溶液里和熔融状态下都不能形成自由移动离子
物质类型 ①酸:HNO3、HCl、H2SO4、H3PO4、H2CO3;②碱:NaOH、NH3·H2O、Ca(OH)2;③盐:NaCl、KNO3、CaCO3;④部分金属氧化物:NaO;⑤H2O ①大部分非金属氧化物:②:NH3;③大部分有机物:蔗糖、酒精、CH4等
Cl
Na+
NaCl固体
熔融NaCl
NaCl溶液
电解质
带电离子不能自由移动
能自由移动的Na+和Cl-
能自由移动的Na+和Cl-
电离
电解质电离的符号表示
电离:电解质溶于水或受热熔化时,形成自由移动的离子的过程。
电离方程式:用来表示电解质的电离
NaCl Na+ + Cl-
任务2:NaCl溶液能导电的原因探究
物质 NaCl固体 NaCl溶液 熔融NaCl
宏观现象 不导电 能导电 能导电
微观本质
符号表征 \
NaCl Na+ + Cl-
电解质和非电解质
电解质溶液能导电是由于电解质本身能电离出自由移动的离子
CO2
SO2
SO3
NH3
H2CO3
H2SO3
H2SO4
NH3·H2O
+H2O
自身不能电离出阴、阳离子
非电解质
自身能电离出自由移动的阴、阳离子
电解质
任务3:模型应用,探究本质
从电离的角度认识溶液,书写电离方程式
第一组:HCl、H2SO4、HNO3
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
HNO3 = H+ + NO3-
酸的本质:电离时生成的
阳离子全部是H+的化合物。
NaOH = Na+ + OH-
KOH = K+ + OH-
Ba(OH)2 = Ba2++ 2OH-
第二组:NaOH、KOH、Ba(OH)2
碱的本质:电离时生成的阴离子全部是OH-的化合物。
任务3:用化学用语表示电解质电离
从电离的角度认识溶液,书写电离方程式
第三组:KCl、Na2CO3、CuSO4
KCl = K+ + Cl-
Na2CO3 = 2Na+ + CO32-
CuSO4 = Cu2+ + SO4 2-
电离时能生成金属阳离子(或NH4+)和酸根离子的化合物
讨论 如何判断某物质是否是电解质?
1
宏观实验事实
—水溶液里或熔融状态下能够导电的化合物
2
微观粒子构成
—由离子构成的化合物
3
物质类别的角度
—酸、碱和大多数盐
