鲁教版化学九年级下册第八单元 海水中的化学 综合素质评价(word版 有答案)
文档属性
| 名称 | 鲁教版化学九年级下册第八单元 海水中的化学 综合素质评价(word版 有答案) |  | |
| 格式 | doc | ||
| 文件大小 | 368.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-02 16:39:12 | ||
图片预览


文档简介
第八单元综合素质评价
可能用到的相对原子质量:H—1 C—12 O—16 Na—23
一、选择题(本题包括10小题,每小题3分,共30分)
1.春秋末期齐国的工艺官书《考工记》中载有“涑帛”的方法,即利用“灰”(草木灰主要成分碳酸钾)和“蜃”(贝壳灰:主要成分氢氧化钙)混合加水所得液体来洗涤丝帛。这种液体能洗涤丝帛主要是因为其中含有( )
A.CaCO3 B.Ca(OH)2 C.KOH D.K2CO3
2.海洋是重要的资源,利用海水可以得到许多产品。①海水“晒盐”;②海水“制碱”;③海水“淡化”;④从海水中提取镁。其中主要利用化学变化的是( )
A.全部 B.①②④ C.只有② D.只有②④
3.下列在对海洋资源利用时的做法不可取的是( )
A.在休渔期禁止捕捞 B.船舶垃圾直接倒入海中
C.开发利用海底“可燃冰” D.将海水引入盐田进行晒盐
4.下列有关纯碱的说法正确的是( )
A.纯碱难溶于水
B.纯碱是碱而不是盐
C.纯碱既可从内陆盐湖提取,又可用“侯氏联合制碱法”生产
D.纯碱中含有少量的小苏打,可以用稀盐酸除去
5.已知室温下NaCl的溶解度约为36 g。现称取3.6 g粗盐,经过溶解、过滤、蒸发、转移等步骤,除去泥沙得到精盐。下列操作正确且合理的是( )
6.除去下列物质中的少量杂质(括号内为杂质)的方法错误的是( )
A.O2(H2O)——用生石灰
B.NaCl溶液(KNO3)——降温结晶
C.CaCO3粉末(Na2CO3)——加水溶解后过滤、洗涤、干燥
D.KCl溶液(K2CO3)——加适量盐酸
7.下列离子在pH=2的溶液中能大量共存,并形成无色溶液的是( )
A.Fe3+ Na+ NO3- Cl- B.K+ Na+ Cl- SO42-
C.H+ K+ SO42- OH- D.Ba2+ NO3- CO32- Cl-
8.已知KNO3在20 ℃、30 ℃时的溶解度分别为31.6 g、45.8 g,某同学按如图所示步骤进行实验。下列说法正确的是( )
A.Ⅰ中KNO3的质量分数为10.0%
B.Ⅱ中溶液是30 ℃时KNO3的不饱和溶液
C.Ⅱ中KNO3的质量分数是Ⅰ中的2倍
D.Ⅲ中有KNO3晶体析出
9.现有一含有多种溶质的无色溶液,关于该溶液中所含溶质有以下几种猜测,其中合理的是( )
A.H2SO4、NaOH、NaCl B.KNO3、NaCl、CuSO4
C.AgNO3、NaCl、HCl D.H2SO4、Na2SO4、KNO3
10.向盛有硫酸和硫酸铜混合溶液的烧杯中滴入Ba(OH)2溶液,烧杯中溶质的质量与加入的Ba(OH)2溶液的质量关系如图所示。下列有关说法正确的是( )
A.a→b段溶液的质量一定减小
B.b→c段有水生成
C.b点溶液溶质为硫酸铜
D.d点沉淀质量与b点沉淀质量相等
二、填空题(本题包括5小题,共34分)
11.(4分)写出符合下列要求的化学式。
(1)海水中含量最多的盐:______________。
(2)侯氏制碱法制得的“碱”:______________。
(3)工业盐中有毒的成分:______________。
(4)天然气的主要成分:________________。
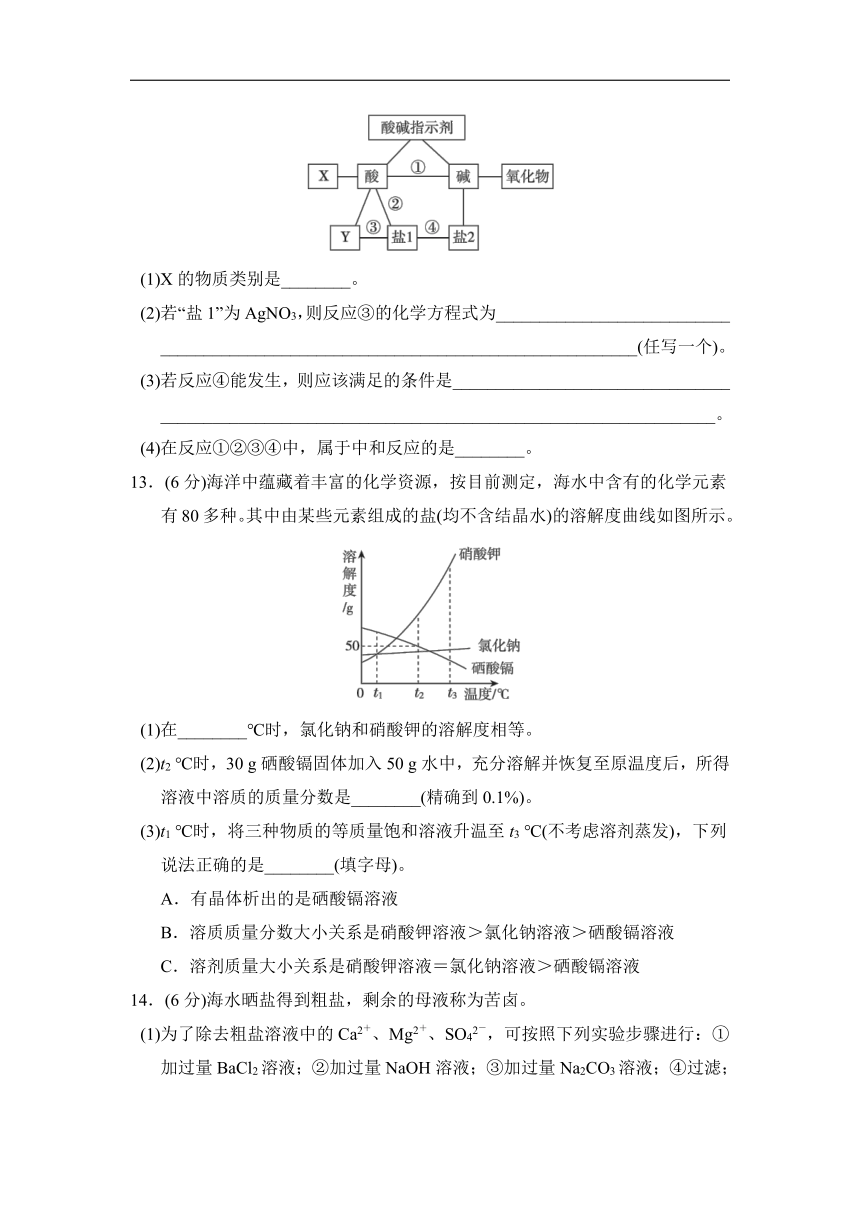
12.(8分)如图为初中化学中关于酸、碱、盐化学性质的知识框架图,X、Y是除酸、碱、盐之外的不同类别的物质,据图回答问题:
(1)X的物质类别是________。
(2)若“盐1”为AgNO3,则反应③的化学方程式为___________________________
_______________________________________________________(任写一个)。
(3)若反应④能发生,则应该满足的条件是________________________________
________________________________________________________________。
(4)在反应①②③④中,属于中和反应的是________。
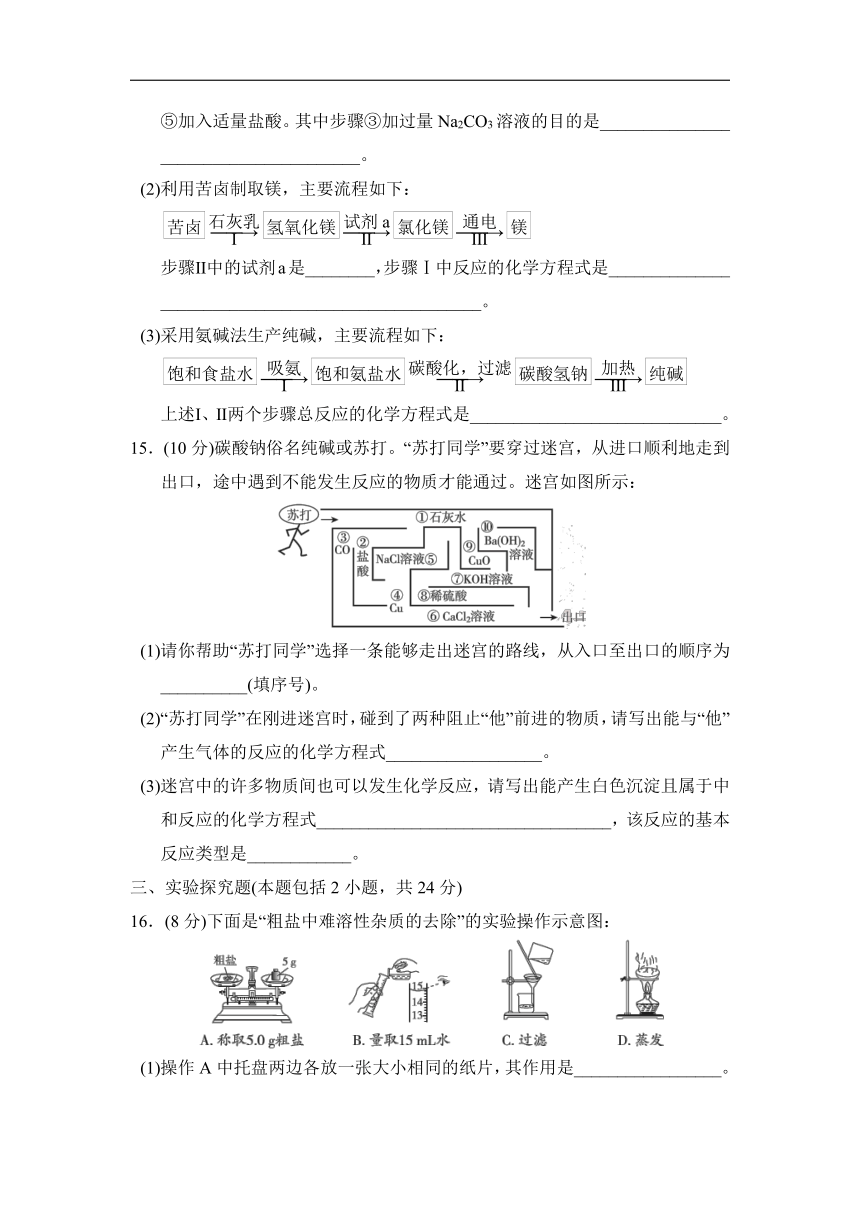
13.(6分)海洋中蕴藏着丰富的化学资源,按目前测定,海水中含有的化学元素有80多种。其中由某些元素组成的盐(均不含结晶水)的溶解度曲线如图所示。
(1)在________℃时,氯化钠和硝酸钾的溶解度相等。
(2)t2 ℃时,30 g硒酸镉固体加入50 g水中,充分溶解并恢复至原温度后,所得溶液中溶质的质量分数是________(精确到0.1%)。
(3)t1 ℃时,将三种物质的等质量饱和溶液升温至t3 ℃(不考虑溶剂蒸发),下列说法正确的是________(填字母)。
A.有晶体析出的是硒酸镉溶液
B.溶质质量分数大小关系是硝酸钾溶液>氯化钠溶液>硒酸镉溶液
C.溶剂质量大小关系是硝酸钾溶液=氯化钠溶液>硒酸镉溶液
14.(6分)海水晒盐得到粗盐,剩余的母液称为苦卤。
(1)为了除去粗盐溶液中的Ca2+、Mg2+、SO42-,可按照下列实验步骤进行:①加过量BaCl2溶液;②加过量NaOH溶液;③加过量Na2CO3溶液;④过滤;⑤加入适量盐酸。其中步骤③加过量Na2CO3溶液的目的是_______________
_______________________。
(2)利用苦卤制取镁,主要流程如下:
步骤Ⅱ中的试剂a是________,步骤Ⅰ中反应的化学方程式是______________
_____________________________________。
(3)采用氨碱法生产纯碱,主要流程如下:
上述Ⅰ、Ⅱ两个步骤总反应的化学方程式是_____________________________。
15.(10分)碳酸钠俗名纯碱或苏打。“苏打同学”要穿过迷宫,从进口顺利地走到出口,途中遇到不能发生反应的物质才能通过。迷宫如图所示:
(1)请你帮助“苏打同学”选择一条能够走出迷宫的路线,从入口至出口的顺序为__________(填序号)。
(2)“苏打同学”在刚进迷宫时,碰到了两种阻止“他”前进的物质,请写出能与“他”产生气体的反应的化学方程式__________________。
(3)迷宫中的许多物质间也可以发生化学反应,请写出能产生白色沉淀且属于中和反应的化学方程式__________________________________,该反应的基本反应类型是____________。
三、实验探究题(本题包括2小题,共24分)
16.(8分)下面是“粗盐中难溶性杂质的去除”的实验操作示意图:
(1)操作A中托盘两边各放一张大小相同的纸片,其作用是_________________。
(2)操作B中还需要用到的仪器是______________。
(3)操作 C过滤时漏斗内液面要低于滤纸边缘,主要是为了防止_____(填序号)。
A.过滤速度慢 B. 滤纸破损 C. 杂质未经过滤就进入滤液
(4)图中部分操作有错误,其中有的错误会导致精盐产率明显偏低,其原因是________________________________________________________________。
17.(16分)学习复分解反应发生条件时,小红同学做了如下表中的四个实验。
试管编号 ① ② ③ ④
试管内试剂 NaOH溶液 MgCl2溶液 Na2CO3溶液 Ba(NO3)2溶液
加入稀硫酸后的现象 无明显现象 无明显现象 产生气泡 生成白色沉淀
(1)根据以上实验,可以判断试管③④中发生了复分解反应。试管③中反应的化学方程式为________________________________。
(2)小明同学向盛有NaOH溶液的试管中先加了一种试剂,再加稀硫酸,从而能说明试管①中也发生了反应,这种试剂是____________。
(3)为了验证试管②中是否发生复分解反应,小明同学进行了如下探究。
【提出猜想】猜想1:试管②中没有发生复分解反应,溶液中有MgCl2,即Mg2+和Cl-同时存在于溶液中。
猜想2:试管②中发生了复分解反应,溶液中无MgCl2。
老师提示SO42-会对Cl-的检验有干扰,需要先除去,小明根据老师的提示和自己的猜想提出了如图所示实验方案。
【设计方案】
沉淀A的化学式是__________。老师评价该方案时指出:设计思路正确,但试剂选择有误,你认为应该将所选的试剂____________改成_____________。小明按照修改后的方案进行了实验,最后得出的结论是猜想1正确,则步骤Ⅱ、步骤Ⅲ中必然会观察到的现象是______________。
【实验反思】小明反思进行步骤Ⅲ时,加NaOH溶液采用了滴加的方式,但开始时没有观察到明显现象,你认为其中的原因是_________________________。
四、计算题(本题包括1小题,共12分)
18.医用碳酸氢钠片可用于治疗胃酸过多,某同学为测定其中碳酸氢钠的质量分数,取10.0 g样品放入烧杯中,分两次加入稀盐酸(该实验条件下杂质不参与反应),充分反应。测得实验数据如表所示。
加盐酸的次数 第一次 第二次
加盐酸的质量/g 40.0 40.0
生成气体的质量/g 3.3 1.1
(1)两次加稀盐酸后,生成二氧化碳的总质量是________g;
(2)该样品中碳酸氢钠的质量分数(写出计算过程)。
(反应的化学方程式为NaHCO3+HCl===NaCl+H2O+CO2↑)
答案
一、1.C 2.D 3.B 4.C 5.B
6.B 点拨:虽然KNO3的溶解度受温度变化影响较大,但NaCl溶液中混有少量的KNO3,降温不能形成KNO3的饱和溶液,因此降温结晶时KNO3不能析出。
7.B 点拨:pH为2的水溶液显酸性,水溶液中含有大量的H+。含Fe3+的水溶液呈黄色,A错误;四种离子在溶液中不能结合生成沉淀、气体、水,能在酸性溶液中大量共存,且不存在有色离子,B正确;OH-与H+在溶液中结合生成水,不能大量共存,C错误;CO32-与H+在溶液中结合生成水和二氧化碳,不能大量共存,且Ba2+与CO32-也不能大量共存,D错误。
8.B 点拨:KNO3在30 ℃时的溶解度为45.8 g,该温度下,Ⅰ中硝酸钾的质量为5 g,溶解在50 g水中,硝酸钾的质量分数为×100%≈9.1%,A错误;KNO3在30 ℃时的溶解度为45.8 g,该温度下,Ⅱ中溶液是10 g硝酸钾溶解在50 g水中形成的,是不饱和溶液,B正确;Ⅰ中含有的KNO3的质量是5 g,Ⅱ中含有的KNO3的质量是10 g,溶剂的质量均为50 g,Ⅰ中KNO3的质量分数是9.1%,Ⅱ中KNO3的质量分数是×100%≈16.7%,C错误;KNO3在20 ℃时的溶解度为31.6 g,降温前,50 g水中只溶解了硝酸钾10 g,所以Ⅲ中没有KNO3晶体析出,D错误。
9.D 点拨:H2SO4、NaOH反应生成硫酸钠和水,不能在同一溶液中大量共存,A错误;三者之间不反应,能在同一溶液中大量共存,但含CuSO4的溶液呈蓝色,B错误;AgNO3与NaCl、HCl均能反应生成氯化银白色沉淀,不能在同一溶液中大量共存,C错误;三者之间不反应,能在同一溶液中大量共存,且不存在有色离子,D正确。
10.C 点拨:a→b段溶质质量减少,但是溶剂质量增加,溶液的质量不一定减小,A错误;向盛有硫酸和硫酸铜混合溶液的烧杯中滴入Ba(OH)2溶液,氢氧化钡先和硫酸反应生成硫酸钡和水,再和硫酸铜反应生成氢氧化铜沉淀和硫酸钡沉淀,b→c段表示硫酸铜和氢氧化钡反应,没有水生成,B错误;b点硫酸和氢氧化钡恰好完全反应生成硫酸钡沉淀和水,此时溶液溶质为硫酸铜,C正确;b点硫酸和氢氧化钡恰好完全反应,此时沉淀为硫酸钡沉淀,d点硫酸、硫酸铜都完全反应,且氢氧化钡过量,此时沉淀为硫酸钡和氢氧化铜,故d点沉淀质量与b点沉淀质量不相等,D错误。
二、11.(1)NaCl (2)Na2CO3 (3)NaNO2 (4)CH4
12.(1)氧化物 (2)Fe+2AgNO3===Fe(NO3)2+2Ag(合理即可) (3)盐1和盐2都能溶于水,且盐1和盐2相互交换成分后有沉淀或气体或水生成 (4)①
13.(1)t1 (2)33.3% (3)A、C
点拨:(2)t2 ℃时,硒酸镉的溶解度是50 g,将30 g硒酸镉加入50 g水中,最多只能溶解25 g,所得溶液的溶质质量分数为×100%≈33.3%。(3)只有硒酸镉的溶解度随温度的升高而减小,t1 ℃时,将三种物质的等质量饱和溶液升温至t3 ℃,有晶体析出的是硒酸镉溶液,A正确;t1 ℃时,硒酸镉的溶解度最大,硝酸钾、氯化钠的溶解度相等,三种物质的饱和溶液升温至t3 ℃(不考虑水的蒸发),硝酸钾、氯化钠的溶解度增大,不会析出固体,溶液的组成不变,硒酸镉的溶解度减小,小于t1 ℃时KNO3和NaCl的溶解度,故所得溶液中溶质的质量分数由大到小的顺序是硝酸钾溶液=氯化钠溶液>硒酸镉溶液,B错误;t1 ℃时,硒酸镉的溶解度最大,硝酸钾、氯化钠的溶解度相等,等质量的三种物质的饱和溶液中溶剂质量大小关系为硝酸钾溶液=氯化钠溶液>硒酸镉溶液,升温至t3 ℃(不考虑水的蒸发),溶剂质量不变,大小关系与t1 ℃时相同,所以溶剂质量大小关系是硝酸钾溶液=氯化钠溶液>硒酸镉溶液,C正确。
14.(1)除尽Ca2+和Ba2+(或除尽氯化钙和氯化钡)
(2)盐酸;MgCl2+Ca(OH)2===Mg(OH)2↓+CaCl2
(3)NaCl+H2O+NH3+CO2===NaHCO3+NH4Cl
15.(1)③④⑤⑦
(2)Na2CO3+2HCl===2NaCl+H2O+CO2↑
(3)H2SO4+Ba(OH)2===BaSO4↓+2H2O;复分解反应
三、16.(1)防止药品腐蚀天平的托盘,使称量更准确
(2)胶头滴管 (3)C
(4)操作D中未用玻璃棒搅拌,造成液滴飞溅
17.(1)Na2CO3+H2SO4===Na2SO4+H2O+CO2↑
(2)酚酞试液 (3)【设计方案】BaSO4;BaCl2溶液;Ba(NO3)2溶液;产生白色沉淀
【实验反思】经过步骤1后溶液中有硝酸,硝酸会先和氢氧化钠发生反应
四、18.解:(1)4.4
(2)设参加反应的碳酸氢钠的质量为x。
NaHCO3+HCl===NaCl+H2O+CO2↑
84 44
x 4.4 g
= x=8.4 g
该样品中碳酸氢钠的质量分数为×100%=84%。
答:该样品中碳酸氢钠的质量分数为84%。
点拨:根据题意,产生二氧化碳的总质量为3.3 g+1.1 g=4.4 g,由反应的化学方程式列式计算,求出参加反应的碳酸氢钠的质量,进而计算出该样品中碳酸氢钠的质量分数。
可能用到的相对原子质量:H—1 C—12 O—16 Na—23
一、选择题(本题包括10小题,每小题3分,共30分)
1.春秋末期齐国的工艺官书《考工记》中载有“涑帛”的方法,即利用“灰”(草木灰主要成分碳酸钾)和“蜃”(贝壳灰:主要成分氢氧化钙)混合加水所得液体来洗涤丝帛。这种液体能洗涤丝帛主要是因为其中含有( )
A.CaCO3 B.Ca(OH)2 C.KOH D.K2CO3
2.海洋是重要的资源,利用海水可以得到许多产品。①海水“晒盐”;②海水“制碱”;③海水“淡化”;④从海水中提取镁。其中主要利用化学变化的是( )
A.全部 B.①②④ C.只有② D.只有②④
3.下列在对海洋资源利用时的做法不可取的是( )
A.在休渔期禁止捕捞 B.船舶垃圾直接倒入海中
C.开发利用海底“可燃冰” D.将海水引入盐田进行晒盐
4.下列有关纯碱的说法正确的是( )
A.纯碱难溶于水
B.纯碱是碱而不是盐
C.纯碱既可从内陆盐湖提取,又可用“侯氏联合制碱法”生产
D.纯碱中含有少量的小苏打,可以用稀盐酸除去
5.已知室温下NaCl的溶解度约为36 g。现称取3.6 g粗盐,经过溶解、过滤、蒸发、转移等步骤,除去泥沙得到精盐。下列操作正确且合理的是( )
6.除去下列物质中的少量杂质(括号内为杂质)的方法错误的是( )
A.O2(H2O)——用生石灰
B.NaCl溶液(KNO3)——降温结晶
C.CaCO3粉末(Na2CO3)——加水溶解后过滤、洗涤、干燥
D.KCl溶液(K2CO3)——加适量盐酸
7.下列离子在pH=2的溶液中能大量共存,并形成无色溶液的是( )
A.Fe3+ Na+ NO3- Cl- B.K+ Na+ Cl- SO42-
C.H+ K+ SO42- OH- D.Ba2+ NO3- CO32- Cl-
8.已知KNO3在20 ℃、30 ℃时的溶解度分别为31.6 g、45.8 g,某同学按如图所示步骤进行实验。下列说法正确的是( )
A.Ⅰ中KNO3的质量分数为10.0%
B.Ⅱ中溶液是30 ℃时KNO3的不饱和溶液
C.Ⅱ中KNO3的质量分数是Ⅰ中的2倍
D.Ⅲ中有KNO3晶体析出
9.现有一含有多种溶质的无色溶液,关于该溶液中所含溶质有以下几种猜测,其中合理的是( )
A.H2SO4、NaOH、NaCl B.KNO3、NaCl、CuSO4
C.AgNO3、NaCl、HCl D.H2SO4、Na2SO4、KNO3
10.向盛有硫酸和硫酸铜混合溶液的烧杯中滴入Ba(OH)2溶液,烧杯中溶质的质量与加入的Ba(OH)2溶液的质量关系如图所示。下列有关说法正确的是( )
A.a→b段溶液的质量一定减小
B.b→c段有水生成
C.b点溶液溶质为硫酸铜
D.d点沉淀质量与b点沉淀质量相等
二、填空题(本题包括5小题,共34分)
11.(4分)写出符合下列要求的化学式。
(1)海水中含量最多的盐:______________。
(2)侯氏制碱法制得的“碱”:______________。
(3)工业盐中有毒的成分:______________。
(4)天然气的主要成分:________________。
12.(8分)如图为初中化学中关于酸、碱、盐化学性质的知识框架图,X、Y是除酸、碱、盐之外的不同类别的物质,据图回答问题:
(1)X的物质类别是________。
(2)若“盐1”为AgNO3,则反应③的化学方程式为___________________________
_______________________________________________________(任写一个)。
(3)若反应④能发生,则应该满足的条件是________________________________
________________________________________________________________。
(4)在反应①②③④中,属于中和反应的是________。
13.(6分)海洋中蕴藏着丰富的化学资源,按目前测定,海水中含有的化学元素有80多种。其中由某些元素组成的盐(均不含结晶水)的溶解度曲线如图所示。
(1)在________℃时,氯化钠和硝酸钾的溶解度相等。
(2)t2 ℃时,30 g硒酸镉固体加入50 g水中,充分溶解并恢复至原温度后,所得溶液中溶质的质量分数是________(精确到0.1%)。
(3)t1 ℃时,将三种物质的等质量饱和溶液升温至t3 ℃(不考虑溶剂蒸发),下列说法正确的是________(填字母)。
A.有晶体析出的是硒酸镉溶液
B.溶质质量分数大小关系是硝酸钾溶液>氯化钠溶液>硒酸镉溶液
C.溶剂质量大小关系是硝酸钾溶液=氯化钠溶液>硒酸镉溶液
14.(6分)海水晒盐得到粗盐,剩余的母液称为苦卤。
(1)为了除去粗盐溶液中的Ca2+、Mg2+、SO42-,可按照下列实验步骤进行:①加过量BaCl2溶液;②加过量NaOH溶液;③加过量Na2CO3溶液;④过滤;⑤加入适量盐酸。其中步骤③加过量Na2CO3溶液的目的是_______________
_______________________。
(2)利用苦卤制取镁,主要流程如下:
步骤Ⅱ中的试剂a是________,步骤Ⅰ中反应的化学方程式是______________
_____________________________________。
(3)采用氨碱法生产纯碱,主要流程如下:
上述Ⅰ、Ⅱ两个步骤总反应的化学方程式是_____________________________。
15.(10分)碳酸钠俗名纯碱或苏打。“苏打同学”要穿过迷宫,从进口顺利地走到出口,途中遇到不能发生反应的物质才能通过。迷宫如图所示:
(1)请你帮助“苏打同学”选择一条能够走出迷宫的路线,从入口至出口的顺序为__________(填序号)。
(2)“苏打同学”在刚进迷宫时,碰到了两种阻止“他”前进的物质,请写出能与“他”产生气体的反应的化学方程式__________________。
(3)迷宫中的许多物质间也可以发生化学反应,请写出能产生白色沉淀且属于中和反应的化学方程式__________________________________,该反应的基本反应类型是____________。
三、实验探究题(本题包括2小题,共24分)
16.(8分)下面是“粗盐中难溶性杂质的去除”的实验操作示意图:
(1)操作A中托盘两边各放一张大小相同的纸片,其作用是_________________。
(2)操作B中还需要用到的仪器是______________。
(3)操作 C过滤时漏斗内液面要低于滤纸边缘,主要是为了防止_____(填序号)。
A.过滤速度慢 B. 滤纸破损 C. 杂质未经过滤就进入滤液
(4)图中部分操作有错误,其中有的错误会导致精盐产率明显偏低,其原因是________________________________________________________________。
17.(16分)学习复分解反应发生条件时,小红同学做了如下表中的四个实验。
试管编号 ① ② ③ ④
试管内试剂 NaOH溶液 MgCl2溶液 Na2CO3溶液 Ba(NO3)2溶液
加入稀硫酸后的现象 无明显现象 无明显现象 产生气泡 生成白色沉淀
(1)根据以上实验,可以判断试管③④中发生了复分解反应。试管③中反应的化学方程式为________________________________。
(2)小明同学向盛有NaOH溶液的试管中先加了一种试剂,再加稀硫酸,从而能说明试管①中也发生了反应,这种试剂是____________。
(3)为了验证试管②中是否发生复分解反应,小明同学进行了如下探究。
【提出猜想】猜想1:试管②中没有发生复分解反应,溶液中有MgCl2,即Mg2+和Cl-同时存在于溶液中。
猜想2:试管②中发生了复分解反应,溶液中无MgCl2。
老师提示SO42-会对Cl-的检验有干扰,需要先除去,小明根据老师的提示和自己的猜想提出了如图所示实验方案。
【设计方案】
沉淀A的化学式是__________。老师评价该方案时指出:设计思路正确,但试剂选择有误,你认为应该将所选的试剂____________改成_____________。小明按照修改后的方案进行了实验,最后得出的结论是猜想1正确,则步骤Ⅱ、步骤Ⅲ中必然会观察到的现象是______________。
【实验反思】小明反思进行步骤Ⅲ时,加NaOH溶液采用了滴加的方式,但开始时没有观察到明显现象,你认为其中的原因是_________________________。
四、计算题(本题包括1小题,共12分)
18.医用碳酸氢钠片可用于治疗胃酸过多,某同学为测定其中碳酸氢钠的质量分数,取10.0 g样品放入烧杯中,分两次加入稀盐酸(该实验条件下杂质不参与反应),充分反应。测得实验数据如表所示。
加盐酸的次数 第一次 第二次
加盐酸的质量/g 40.0 40.0
生成气体的质量/g 3.3 1.1
(1)两次加稀盐酸后,生成二氧化碳的总质量是________g;
(2)该样品中碳酸氢钠的质量分数(写出计算过程)。
(反应的化学方程式为NaHCO3+HCl===NaCl+H2O+CO2↑)
答案
一、1.C 2.D 3.B 4.C 5.B
6.B 点拨:虽然KNO3的溶解度受温度变化影响较大,但NaCl溶液中混有少量的KNO3,降温不能形成KNO3的饱和溶液,因此降温结晶时KNO3不能析出。
7.B 点拨:pH为2的水溶液显酸性,水溶液中含有大量的H+。含Fe3+的水溶液呈黄色,A错误;四种离子在溶液中不能结合生成沉淀、气体、水,能在酸性溶液中大量共存,且不存在有色离子,B正确;OH-与H+在溶液中结合生成水,不能大量共存,C错误;CO32-与H+在溶液中结合生成水和二氧化碳,不能大量共存,且Ba2+与CO32-也不能大量共存,D错误。
8.B 点拨:KNO3在30 ℃时的溶解度为45.8 g,该温度下,Ⅰ中硝酸钾的质量为5 g,溶解在50 g水中,硝酸钾的质量分数为×100%≈9.1%,A错误;KNO3在30 ℃时的溶解度为45.8 g,该温度下,Ⅱ中溶液是10 g硝酸钾溶解在50 g水中形成的,是不饱和溶液,B正确;Ⅰ中含有的KNO3的质量是5 g,Ⅱ中含有的KNO3的质量是10 g,溶剂的质量均为50 g,Ⅰ中KNO3的质量分数是9.1%,Ⅱ中KNO3的质量分数是×100%≈16.7%,C错误;KNO3在20 ℃时的溶解度为31.6 g,降温前,50 g水中只溶解了硝酸钾10 g,所以Ⅲ中没有KNO3晶体析出,D错误。
9.D 点拨:H2SO4、NaOH反应生成硫酸钠和水,不能在同一溶液中大量共存,A错误;三者之间不反应,能在同一溶液中大量共存,但含CuSO4的溶液呈蓝色,B错误;AgNO3与NaCl、HCl均能反应生成氯化银白色沉淀,不能在同一溶液中大量共存,C错误;三者之间不反应,能在同一溶液中大量共存,且不存在有色离子,D正确。
10.C 点拨:a→b段溶质质量减少,但是溶剂质量增加,溶液的质量不一定减小,A错误;向盛有硫酸和硫酸铜混合溶液的烧杯中滴入Ba(OH)2溶液,氢氧化钡先和硫酸反应生成硫酸钡和水,再和硫酸铜反应生成氢氧化铜沉淀和硫酸钡沉淀,b→c段表示硫酸铜和氢氧化钡反应,没有水生成,B错误;b点硫酸和氢氧化钡恰好完全反应生成硫酸钡沉淀和水,此时溶液溶质为硫酸铜,C正确;b点硫酸和氢氧化钡恰好完全反应,此时沉淀为硫酸钡沉淀,d点硫酸、硫酸铜都完全反应,且氢氧化钡过量,此时沉淀为硫酸钡和氢氧化铜,故d点沉淀质量与b点沉淀质量不相等,D错误。
二、11.(1)NaCl (2)Na2CO3 (3)NaNO2 (4)CH4
12.(1)氧化物 (2)Fe+2AgNO3===Fe(NO3)2+2Ag(合理即可) (3)盐1和盐2都能溶于水,且盐1和盐2相互交换成分后有沉淀或气体或水生成 (4)①
13.(1)t1 (2)33.3% (3)A、C
点拨:(2)t2 ℃时,硒酸镉的溶解度是50 g,将30 g硒酸镉加入50 g水中,最多只能溶解25 g,所得溶液的溶质质量分数为×100%≈33.3%。(3)只有硒酸镉的溶解度随温度的升高而减小,t1 ℃时,将三种物质的等质量饱和溶液升温至t3 ℃,有晶体析出的是硒酸镉溶液,A正确;t1 ℃时,硒酸镉的溶解度最大,硝酸钾、氯化钠的溶解度相等,三种物质的饱和溶液升温至t3 ℃(不考虑水的蒸发),硝酸钾、氯化钠的溶解度增大,不会析出固体,溶液的组成不变,硒酸镉的溶解度减小,小于t1 ℃时KNO3和NaCl的溶解度,故所得溶液中溶质的质量分数由大到小的顺序是硝酸钾溶液=氯化钠溶液>硒酸镉溶液,B错误;t1 ℃时,硒酸镉的溶解度最大,硝酸钾、氯化钠的溶解度相等,等质量的三种物质的饱和溶液中溶剂质量大小关系为硝酸钾溶液=氯化钠溶液>硒酸镉溶液,升温至t3 ℃(不考虑水的蒸发),溶剂质量不变,大小关系与t1 ℃时相同,所以溶剂质量大小关系是硝酸钾溶液=氯化钠溶液>硒酸镉溶液,C正确。
14.(1)除尽Ca2+和Ba2+(或除尽氯化钙和氯化钡)
(2)盐酸;MgCl2+Ca(OH)2===Mg(OH)2↓+CaCl2
(3)NaCl+H2O+NH3+CO2===NaHCO3+NH4Cl
15.(1)③④⑤⑦
(2)Na2CO3+2HCl===2NaCl+H2O+CO2↑
(3)H2SO4+Ba(OH)2===BaSO4↓+2H2O;复分解反应
三、16.(1)防止药品腐蚀天平的托盘,使称量更准确
(2)胶头滴管 (3)C
(4)操作D中未用玻璃棒搅拌,造成液滴飞溅
17.(1)Na2CO3+H2SO4===Na2SO4+H2O+CO2↑
(2)酚酞试液 (3)【设计方案】BaSO4;BaCl2溶液;Ba(NO3)2溶液;产生白色沉淀
【实验反思】经过步骤1后溶液中有硝酸,硝酸会先和氢氧化钠发生反应
四、18.解:(1)4.4
(2)设参加反应的碳酸氢钠的质量为x。
NaHCO3+HCl===NaCl+H2O+CO2↑
84 44
x 4.4 g
= x=8.4 g
该样品中碳酸氢钠的质量分数为×100%=84%。
答:该样品中碳酸氢钠的质量分数为84%。
点拨:根据题意,产生二氧化碳的总质量为3.3 g+1.1 g=4.4 g,由反应的化学方程式列式计算,求出参加反应的碳酸氢钠的质量,进而计算出该样品中碳酸氢钠的质量分数。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
