化学人教版(2019)必修第一册2.3.4物质的量浓度及溶液的配制(共34张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.3.4物质的量浓度及溶液的配制(共34张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-05 10:16:27 | ||
图片预览








文档简介
(共34张PPT)
第三节 物质的量
第二章 海水中的重要元素
溶液的
物质的量浓度
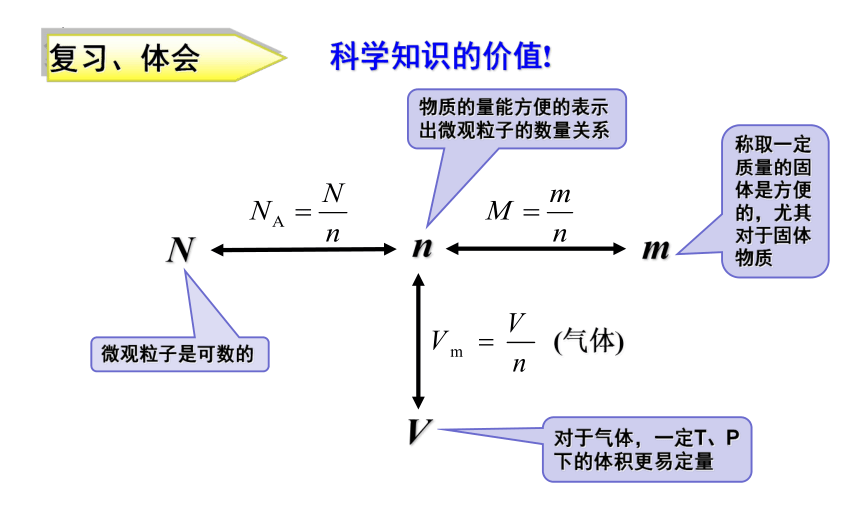
N
V
n
m
(气体)
复习、体会
微观粒子是可数的
物质的量能方便的表示出微观粒子的数量关系
称取一定质量的固体是方便的,尤其对于固体物质
对于气体,一定T、P下的体积更易定量
科学知识的价值!
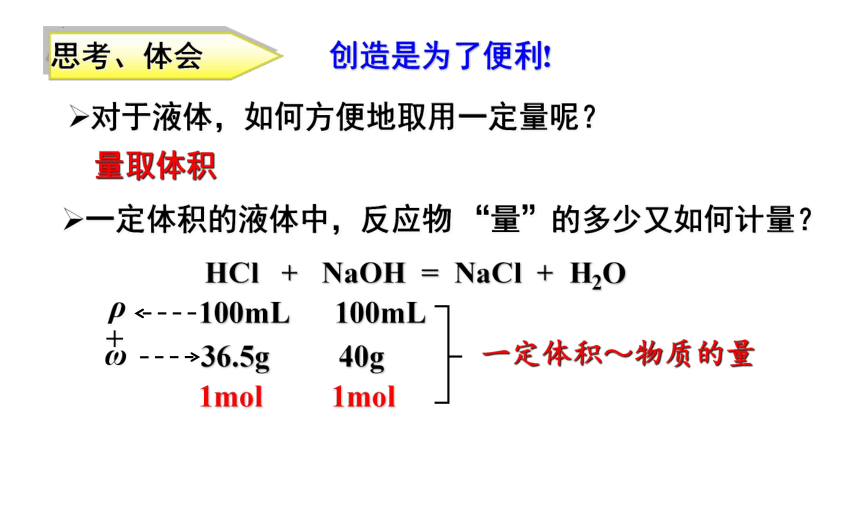
对于液体,如何方便地取用一定量呢?
量取体积
一定体积的液体中,反应物 “量”的多少又如何计量?
思考、体会
HCl + NaOH = NaCl + H2O
36.5g 40g
1mol 1mol
100mL
100mL
1mol 1mol
创造是为了便利!
一定体积~物质的量
ρ
+
ω
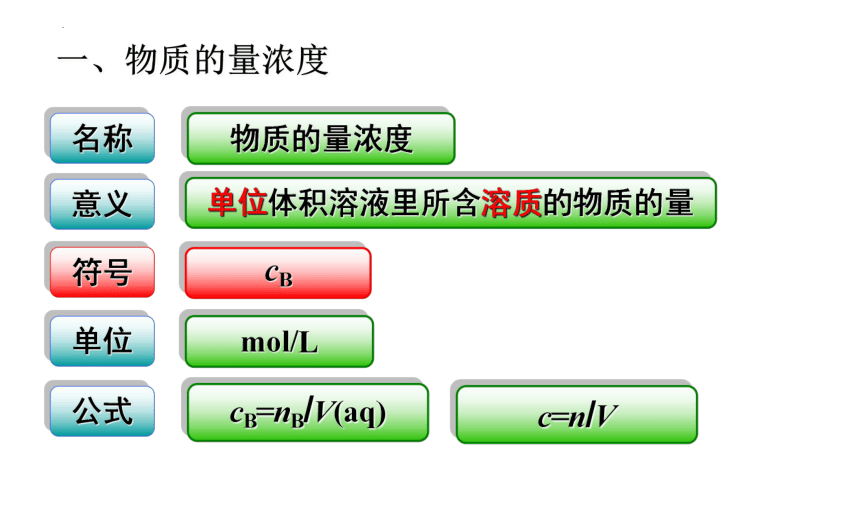
名称
物质的量浓度
符号
cB
单位
公式
cB=nB/V(aq)
mol/L
意义
一、物质的量浓度
单位体积溶液里所含溶质的物质的量
c=n/V
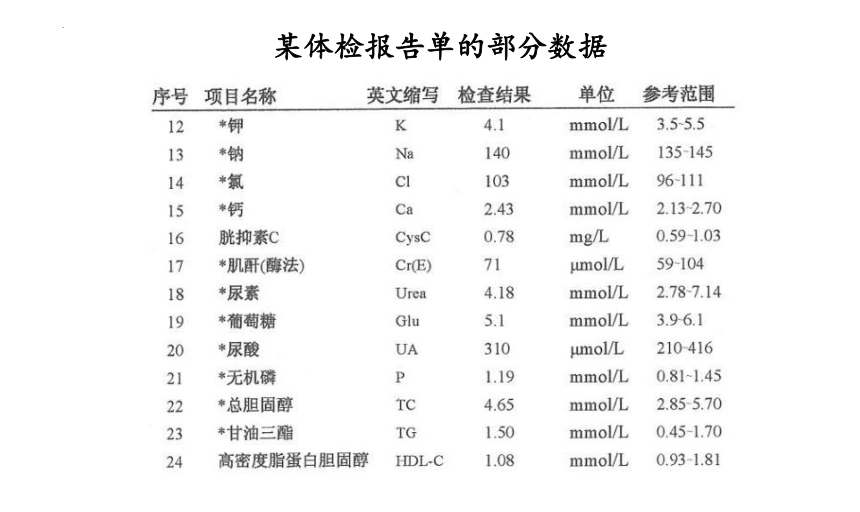
某体检报告单的部分数据
【练习1】 用5molNaOH配成500mL溶液,其浓度为 mol/L,取5mL该溶液,其浓度为 mol/L,所含溶质NaOH的物质的量为 。
10
10
【练习2】配制500mL0.1mol/LNa2CO3溶液需要Na2CO3的质量是多少?
分析:要求Na2CO3的质量,可依据m=nM,要计算Na2CO3的物质的量,可依据n=VcB
0.05mol
解:n(Na2CO3)=0.5L×0.1mol/L=0.05mol
m(Na2CO3)=0.05mol×106g/mol=5.3g
【练习】
下列溶液中NO3- 的物质的量浓度最大的是 ()
A.5mL0.8mol·L-1Al(NO3)3溶液 B.20mL1mol·L-1Mg(NO3)2溶液
C.20mL1.8mol·L-1AgNO3溶液 D.30mL0.5mol·L-1Cu(NO3)2溶液
欲配制100 mL 1.0 mol/L Na2SO4溶液,下列方法正确的方法是 ()
A.将14.2 g Na2SO4溶于100 mL水中
B.将32.2 g Na2SO4 10H2O溶于少量水中,再用水稀释至100 mL
C.将20 mL5.0 mol/L Na2SO4溶液加80 mL蒸馏水稀释
D.将14.2 g Na2SO4溶于85.8 g蒸馏水中
二、一定物质的量浓度溶液的配制
配制100mL 1.00 mol/L的NaCl溶液。
实验目的:
实验原理:
操作过程
实验仪器
5.85g
5.9 g
配制100mL 1.00 mol/L的NaCl溶液
称量NaCl固体的质量
托盘天平
电子天平
0.0000 g
0.0 g
称量5.9 g固体NaCl
将5.9 gNaCl置于烧杯中,加入100 mL蒸馏水溶解
精确
量筒!
托盘天平
配制100mL 1.00 mol/L的NaCl溶液
粗略
请设计实验方案。
将NaCl固体置于烧杯中,
烧杯与玻璃棒
加入约20 mL蒸馏水溶解
用适量蒸馏水溶解
称量5.9 g固体NaCl
托盘天平
配制100mL 1.00 mol/L的NaCl溶液
已知室温下NaCl的溶解度为36 g,由此计算将5.9 gNaCl完全溶解至少需要多少mL蒸馏水?
16.4 mL
将NaCl固体置于烧杯中,
烧杯与玻璃棒
将NaCl溶液转移至量筒中?
加入适量蒸馏水溶解
用量筒量取一定量的蒸馏水加入烧杯中?
将NaCl溶液转移至量筒中
用量筒量取一定量的蒸馏水加入烧杯中
称量5.9 g固体NaCl
托盘天平
配制100mL 1.00 mol/L的NaCl溶液
烧杯容积更大,使用方便,量筒比较精确
组合
认识新仪器— 容量瓶
如何检漏?
规格:50 mL 100 mL 250 mL 500 mL 1000 mL
容量瓶是一种细颈梨形平底的容量器,带有磨口玻璃塞,容积精确,用于配制一定物质的量浓度的溶液。
使用前要检查是否漏水;要用蒸馏水洗净。
容量瓶有固定规格,选用原则“大而近”。
将NaCl溶液转移至
将NaCl固体置于烧杯中,
烧杯与玻璃棒
加入适量蒸馏水溶解
称量5.9 g固体NaCl
托盘天平
配制100mL 1.00 mol/L的NaCl溶液
向容量瓶加蒸馏水至刻度线?
容量瓶中
100 mL容量瓶中
容量瓶
NaCl
NaOH?
溶解放热对溶液体积影响如何消除?
如何将溶解后的溶质全部转移至容量瓶?
如何精确的向容量瓶中加入液体?
溶解、冷却
洗涤
玻璃棒引流、胶头滴管滴加
容量瓶是一种细颈梨形平底的容量器,带有磨口玻璃塞,容积精确,用于配制一定物质的量浓度的溶液。
1.使用前要检查是否漏水;要用蒸馏水洗净;不需要润洗。
3.使用容量瓶“五不”:不能溶解固体;不能稀释浓溶液;不能加热;不能做反应容器;不能长期贮存溶液。
2.容量瓶有固定规格,选用原则“大而近”。
再次认识容量瓶
洗涤烧杯与玻璃棒,并将洗涤液一并转移至容量瓶中
将NaCl溶液转移至
将NaCl固体置于烧杯中,
烧杯与玻璃棒
加入约20 mL蒸馏水溶解
称取5.9 g固体NaCl
托盘天平
配制100mL 1.00 mol/L的NaCl溶液
100 mL容量瓶中
不同浓度的溶液与水混合时,总体积将发生变化,为了尽可能减少溶液混合时的体积变化,应当如何操作?
摇匀
振荡摇匀容量瓶中的溶液,继续加水距刻度线~2cm
定容:用胶头滴管加水至溶液的凹液面与刻度线相切
翻转摇匀
洗涤烧杯与玻璃棒2 ~ 3次,并将洗涤液一并转移至容量瓶中
将NaCl溶液转移至
将NaCl固体置于烧杯中,
烧杯与玻璃棒
加入约20 mL蒸馏水溶解
称量5.9 g固体NaCl
托盘天平
配制100mL 1.00 mol/L的NaCl溶液
100 mL容量瓶中
装瓶:将配好的溶液注入细口试剂瓶,并贴上标签
称量
溶解
移液
洗涤
摇匀
定容
翻转摇匀
用胶头滴管加水至刻度线
2~3cm
总结:
装瓶
思考:
实验室欲用质量分数为98%,密度为1.84g/cm3的浓硫酸,配制100mL 1mol/L的硫酸溶液。请依次写出实验操作的具体步骤。
100mL 1mol/L 的溶液
NaCl
计算 5.85g
称重 5.9 g
溶解
移液
洗涤
加水摇匀
定容
翻转摇匀
装瓶
H2SO4
计算 5.43mL
量取 5.4mL
稀释
冷却降温
移液
洗涤
加水摇匀
定容
翻转摇匀
装瓶
烧杯、玻璃棒
玻璃棒、100mL容量瓶
胶头滴管
托盘天平
量筒
托盘天平、药匙
在溶液配制中哪些操作可能引起浓度的误差?
cB=
nB
V
c与n ?
c与V ?
c∝ n
c∝ 1/V
配制步骤 错误操作 n V c
称量 称量时称量物、砝码位置放反了(使用了游码) —
称量时左盘高,右盘低 —
量取液态溶质时,仰视量筒刻度。 —
量取液态溶质时,俯视量筒刻度。 —
cB=
nB
V
配制步骤 错误操作 n V c
溶解 溶解过程中有少量液体溅出烧杯 —
转移 溶液未冷却,就转移进容量瓶 —
移液前容量瓶内有少量水
玻璃棒在刻度线上引流溶剂 —
洗涤 未洗涤或洗涤液未注入容量瓶 —
cB=
nB
V
配制步骤 错误操作 n V c
定容 定容时仰视刻度线
定容时俯视刻度线
定容后发现液面低于刻度线 —
未等溶液冷却就定容
定容后发现液面高于刻度线后,用滴管吸出少量溶液
cB=
nB
V
转化核心
见量化摩
N
V(气体)
n
m
(气体)
V(aq)
【本节回顾】
二、一定物质的量浓度溶液的配制
【本节回顾】
实验操作
实验仪器
容量瓶的使用
误差分析
计算、称量、溶解、冷却、移液、洗涤、加水摇匀、定容、翻转摇匀、装瓶
c∝ n
c∝ 1/V
俯高仰低
从哪看向哪偏!
一、物质的量浓度
【本节回顾】
单位体积溶液里所含溶质的物质的量
阿伏伽德罗是意大利人,1776年8月9日出生于都灵市的一个律师家庭。他在1811年提出了一种假说:“同体积的气体,在温度相同、压力相同时,含有相同数目的分子”他开辟了一条研究气体的新途径。
但是,这个假说在当时并没有得到公认。化学界的权威道尔顿和贝采里乌斯反对阿伏伽德罗假说,他们认为有相同原子组成分子是绝对不可能的。
直到19世纪60年代,由于后人的工作,阿伏伽德罗定律才得到了公认,现在阿伏伽德罗假说已经被许多事实证实,被公认为一条定律。
谢谢!
第三节 物质的量
第二章 海水中的重要元素
溶液的
物质的量浓度
N
V
n
m
(气体)
复习、体会
微观粒子是可数的
物质的量能方便的表示出微观粒子的数量关系
称取一定质量的固体是方便的,尤其对于固体物质
对于气体,一定T、P下的体积更易定量
科学知识的价值!
对于液体,如何方便地取用一定量呢?
量取体积
一定体积的液体中,反应物 “量”的多少又如何计量?
思考、体会
HCl + NaOH = NaCl + H2O
36.5g 40g
1mol 1mol
100mL
100mL
1mol 1mol
创造是为了便利!
一定体积~物质的量
ρ
+
ω
名称
物质的量浓度
符号
cB
单位
公式
cB=nB/V(aq)
mol/L
意义
一、物质的量浓度
单位体积溶液里所含溶质的物质的量
c=n/V
某体检报告单的部分数据
【练习1】 用5molNaOH配成500mL溶液,其浓度为 mol/L,取5mL该溶液,其浓度为 mol/L,所含溶质NaOH的物质的量为 。
10
10
【练习2】配制500mL0.1mol/LNa2CO3溶液需要Na2CO3的质量是多少?
分析:要求Na2CO3的质量,可依据m=nM,要计算Na2CO3的物质的量,可依据n=VcB
0.05mol
解:n(Na2CO3)=0.5L×0.1mol/L=0.05mol
m(Na2CO3)=0.05mol×106g/mol=5.3g
【练习】
下列溶液中NO3- 的物质的量浓度最大的是 ()
A.5mL0.8mol·L-1Al(NO3)3溶液 B.20mL1mol·L-1Mg(NO3)2溶液
C.20mL1.8mol·L-1AgNO3溶液 D.30mL0.5mol·L-1Cu(NO3)2溶液
欲配制100 mL 1.0 mol/L Na2SO4溶液,下列方法正确的方法是 ()
A.将14.2 g Na2SO4溶于100 mL水中
B.将32.2 g Na2SO4 10H2O溶于少量水中,再用水稀释至100 mL
C.将20 mL5.0 mol/L Na2SO4溶液加80 mL蒸馏水稀释
D.将14.2 g Na2SO4溶于85.8 g蒸馏水中
二、一定物质的量浓度溶液的配制
配制100mL 1.00 mol/L的NaCl溶液。
实验目的:
实验原理:
操作过程
实验仪器
5.85g
5.9 g
配制100mL 1.00 mol/L的NaCl溶液
称量NaCl固体的质量
托盘天平
电子天平
0.0000 g
0.0 g
称量5.9 g固体NaCl
将5.9 gNaCl置于烧杯中,加入100 mL蒸馏水溶解
精确
量筒!
托盘天平
配制100mL 1.00 mol/L的NaCl溶液
粗略
请设计实验方案。
将NaCl固体置于烧杯中,
烧杯与玻璃棒
加入约20 mL蒸馏水溶解
用适量蒸馏水溶解
称量5.9 g固体NaCl
托盘天平
配制100mL 1.00 mol/L的NaCl溶液
已知室温下NaCl的溶解度为36 g,由此计算将5.9 gNaCl完全溶解至少需要多少mL蒸馏水?
16.4 mL
将NaCl固体置于烧杯中,
烧杯与玻璃棒
将NaCl溶液转移至量筒中?
加入适量蒸馏水溶解
用量筒量取一定量的蒸馏水加入烧杯中?
将NaCl溶液转移至量筒中
用量筒量取一定量的蒸馏水加入烧杯中
称量5.9 g固体NaCl
托盘天平
配制100mL 1.00 mol/L的NaCl溶液
烧杯容积更大,使用方便,量筒比较精确
组合
认识新仪器— 容量瓶
如何检漏?
规格:50 mL 100 mL 250 mL 500 mL 1000 mL
容量瓶是一种细颈梨形平底的容量器,带有磨口玻璃塞,容积精确,用于配制一定物质的量浓度的溶液。
使用前要检查是否漏水;要用蒸馏水洗净。
容量瓶有固定规格,选用原则“大而近”。
将NaCl溶液转移至
将NaCl固体置于烧杯中,
烧杯与玻璃棒
加入适量蒸馏水溶解
称量5.9 g固体NaCl
托盘天平
配制100mL 1.00 mol/L的NaCl溶液
向容量瓶加蒸馏水至刻度线?
容量瓶中
100 mL容量瓶中
容量瓶
NaCl
NaOH?
溶解放热对溶液体积影响如何消除?
如何将溶解后的溶质全部转移至容量瓶?
如何精确的向容量瓶中加入液体?
溶解、冷却
洗涤
玻璃棒引流、胶头滴管滴加
容量瓶是一种细颈梨形平底的容量器,带有磨口玻璃塞,容积精确,用于配制一定物质的量浓度的溶液。
1.使用前要检查是否漏水;要用蒸馏水洗净;不需要润洗。
3.使用容量瓶“五不”:不能溶解固体;不能稀释浓溶液;不能加热;不能做反应容器;不能长期贮存溶液。
2.容量瓶有固定规格,选用原则“大而近”。
再次认识容量瓶
洗涤烧杯与玻璃棒,并将洗涤液一并转移至容量瓶中
将NaCl溶液转移至
将NaCl固体置于烧杯中,
烧杯与玻璃棒
加入约20 mL蒸馏水溶解
称取5.9 g固体NaCl
托盘天平
配制100mL 1.00 mol/L的NaCl溶液
100 mL容量瓶中
不同浓度的溶液与水混合时,总体积将发生变化,为了尽可能减少溶液混合时的体积变化,应当如何操作?
摇匀
振荡摇匀容量瓶中的溶液,继续加水距刻度线~2cm
定容:用胶头滴管加水至溶液的凹液面与刻度线相切
翻转摇匀
洗涤烧杯与玻璃棒2 ~ 3次,并将洗涤液一并转移至容量瓶中
将NaCl溶液转移至
将NaCl固体置于烧杯中,
烧杯与玻璃棒
加入约20 mL蒸馏水溶解
称量5.9 g固体NaCl
托盘天平
配制100mL 1.00 mol/L的NaCl溶液
100 mL容量瓶中
装瓶:将配好的溶液注入细口试剂瓶,并贴上标签
称量
溶解
移液
洗涤
摇匀
定容
翻转摇匀
用胶头滴管加水至刻度线
2~3cm
总结:
装瓶
思考:
实验室欲用质量分数为98%,密度为1.84g/cm3的浓硫酸,配制100mL 1mol/L的硫酸溶液。请依次写出实验操作的具体步骤。
100mL 1mol/L 的溶液
NaCl
计算 5.85g
称重 5.9 g
溶解
移液
洗涤
加水摇匀
定容
翻转摇匀
装瓶
H2SO4
计算 5.43mL
量取 5.4mL
稀释
冷却降温
移液
洗涤
加水摇匀
定容
翻转摇匀
装瓶
烧杯、玻璃棒
玻璃棒、100mL容量瓶
胶头滴管
托盘天平
量筒
托盘天平、药匙
在溶液配制中哪些操作可能引起浓度的误差?
cB=
nB
V
c与n ?
c与V ?
c∝ n
c∝ 1/V
配制步骤 错误操作 n V c
称量 称量时称量物、砝码位置放反了(使用了游码) —
称量时左盘高,右盘低 —
量取液态溶质时,仰视量筒刻度。 —
量取液态溶质时,俯视量筒刻度。 —
cB=
nB
V
配制步骤 错误操作 n V c
溶解 溶解过程中有少量液体溅出烧杯 —
转移 溶液未冷却,就转移进容量瓶 —
移液前容量瓶内有少量水
玻璃棒在刻度线上引流溶剂 —
洗涤 未洗涤或洗涤液未注入容量瓶 —
cB=
nB
V
配制步骤 错误操作 n V c
定容 定容时仰视刻度线
定容时俯视刻度线
定容后发现液面低于刻度线 —
未等溶液冷却就定容
定容后发现液面高于刻度线后,用滴管吸出少量溶液
cB=
nB
V
转化核心
见量化摩
N
V(气体)
n
m
(气体)
V(aq)
【本节回顾】
二、一定物质的量浓度溶液的配制
【本节回顾】
实验操作
实验仪器
容量瓶的使用
误差分析
计算、称量、溶解、冷却、移液、洗涤、加水摇匀、定容、翻转摇匀、装瓶
c∝ n
c∝ 1/V
俯高仰低
从哪看向哪偏!
一、物质的量浓度
【本节回顾】
单位体积溶液里所含溶质的物质的量
阿伏伽德罗是意大利人,1776年8月9日出生于都灵市的一个律师家庭。他在1811年提出了一种假说:“同体积的气体,在温度相同、压力相同时,含有相同数目的分子”他开辟了一条研究气体的新途径。
但是,这个假说在当时并没有得到公认。化学界的权威道尔顿和贝采里乌斯反对阿伏伽德罗假说,他们认为有相同原子组成分子是绝对不可能的。
直到19世纪60年代,由于后人的工作,阿伏伽德罗定律才得到了公认,现在阿伏伽德罗假说已经被许多事实证实,被公认为一条定律。
谢谢!
