原子结构
图片预览








文档简介
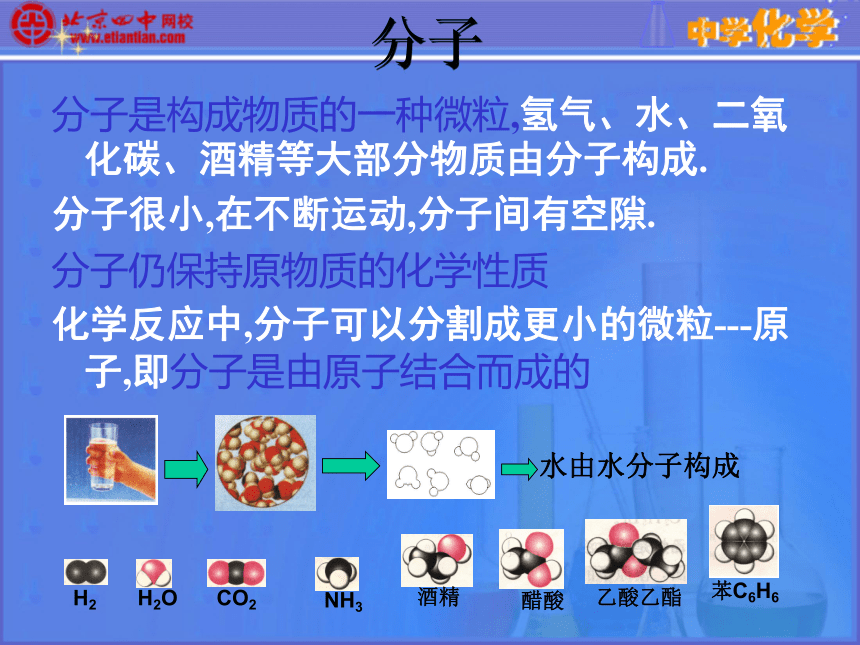
课件31张PPT。人类对原子结构的认识第 一 课 时第三单元 万物——无论是生物还是非生物,都是由微粒构成的。分子分子是构成物质的一种微粒,氢气、水、二氧化碳、酒精等大部分物质由分子构成.
分子很小,在不断运动,分子间有空隙.
分子仍保持原物质的化学性质
化学反应中,分子可以分割成更小的微粒---原子,即分子是由原子结合而成的原子
原子很小,在不断运动.
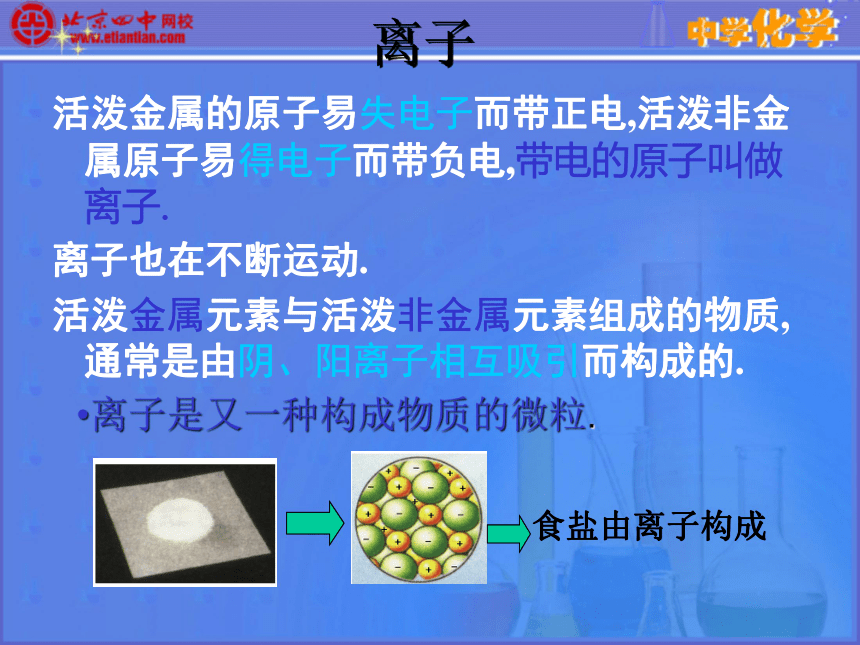
化学反应中,原子不能再分,只能重新组合成新的分子.可见,原子是化学变化中的最小微粒.有的物质由原子直接构成,如稀有气体、金属单质、碳的单质(金刚石)等.所以原子也是构成物质的一种微粒.离子活泼金属的原子易失电子而带正电,活泼非金属原子易得电子而带负电,带电的原子叫做离子.
离子也在不断运动.
活泼金属元素与活泼非金属元素组成的物质,通常是由阴、阳离子相互吸引而构成的.
离子是又一种构成物质的微粒. 原子的结构原子是构成物质的一种微粒 用真空遂道显微镜观察原子 而原子呢?是否还可以再分? 为了探索原子内部结构,科学家们进行了无数的实验。他们用原子模型来表示原子,并通过实验来不断的修正模型。 我们知道分子是由原子构成的,通过扫描遂道显微镜(STM)可以看到单个的原子。用真空遂道显微镜观察原子近代科学原子论(1803年)一切物质都是由最小的不能再分的粒子——原子构成。
原子模型:原子是坚实的、不可再分的实心球。英国化学家道尔顿
(J.Dalton , 1766~1844)“化学的新时代是从原子论开始的”
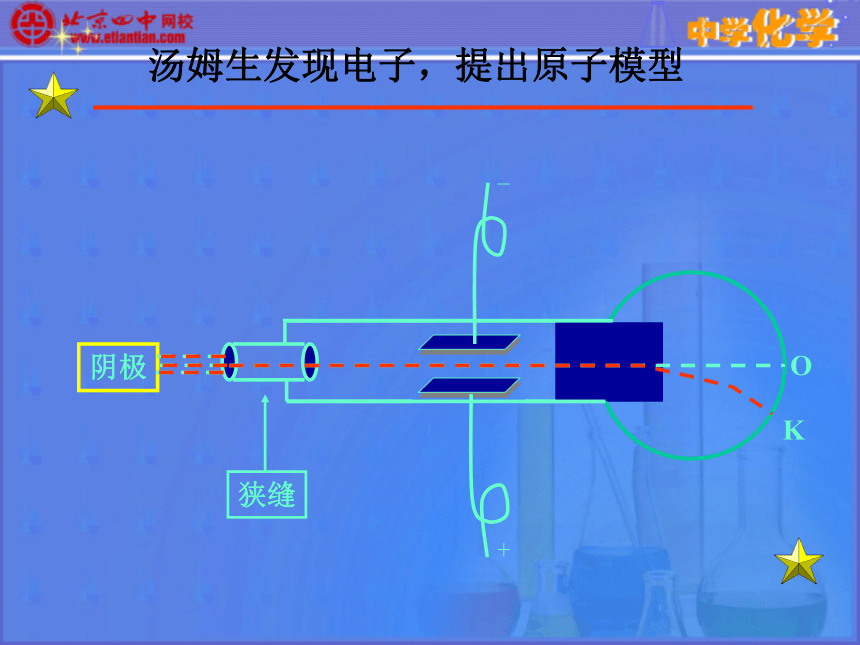
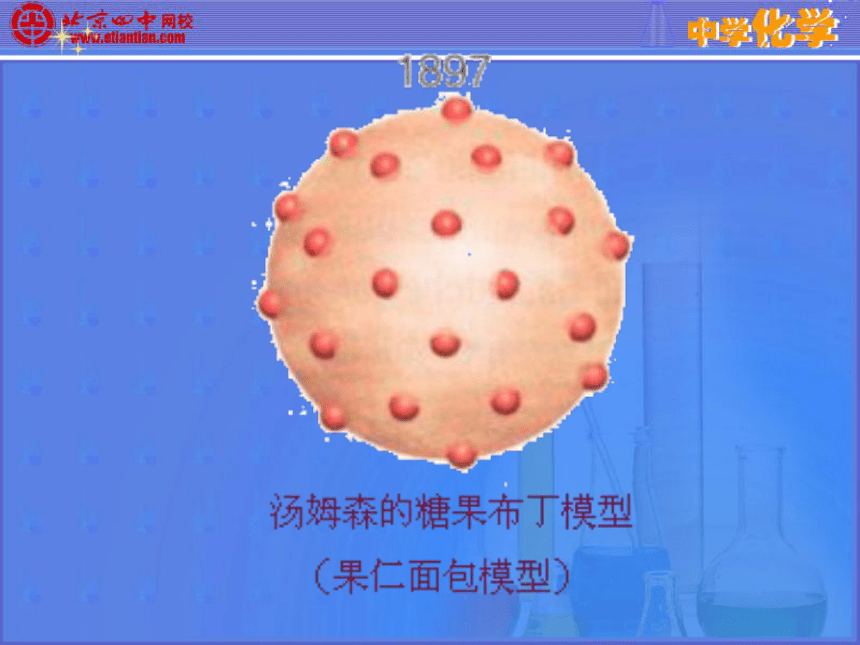
——恩格斯OK阴极汤姆生发现电子,提出原子模型原子并不是构成物质的最小微粒 ——汤姆生发现了电子(1897年)电子是种带负电、有一定质量的微粒,普遍存在于各种原子之中。
汤姆生原子模型:原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了电荷,从而形成了中性原子。英国物理学家汤姆生
(J.J.Thomson ,1856~1940) 2.卢瑟福(E.Rutherford)的“行星模型”。卢瑟福用α粒子束(He2+)轰击一块金箔,并用荧光屏探测α粒子(He2+)方向改变的程度。ZnS屏卢瑟福根据α粒子散射现象,提出带核的原子结构模型α粒子散射实验(1909年) ——原子有核卢瑟福和他的助手做了著名α粒子散射实验。根据实验,卢瑟福在1911年提出原子有核模型。
卢瑟福原子模型(又称行星原子模型):原子是由居于原子中心的带正电的原子核和核外带负电的电子构成。原子核的质量几乎等于原子的全部质量,电子在原子核外空间绕核做高速运动。英国科学家卢瑟福
(E.Rutherford,1871~1937)玻尔原子模型(1913年)玻尔借助诞生不久的量子理论改进了卢瑟福的模型。
玻尔原子模型(又称分层模型):当原子只有一个电子时,电子沿特定球形轨道运转;当原子有多个电子时,它们将分布在多个球壳中绕核运动。
不同的电子运转轨道是具有一定级差的稳定轨道。
丹麦物理学家玻尔
(N.Bohr,1885~1962)电子云模型 (现代物质结构学说)现代科学家们在实验中发现,电子在原子核周围有的区域出现的次数多,有的区域出现的次数少,就像“云雾”笼罩在原子核周围。因而提出了“电子云模型”。
电子云密度大的地方,表明电子在核外单位体积内出现的机会多,反之,出现的机会少。
如:氢原子的电子云电子云现代物质结构学说原子结构模型的演变1803年汤姆生原子模型1911年玻尔原子模型1913年 1897年卢瑟福原子模型道尔顿原子模型电子云模型1927-1935年 原子是由居于原子中心的带正电的原子核和核外带负电的电子构成,电子在原子核外绕核做高速运动。 原子核的质量几乎是整个原子的质量,那么原子核又是怎样构成的呢?揭开原子核的秘密实验证明:原子核是由带正电的质子和不带电的中子构成。其中质子数决定了原子的种类。如:碳原子质子、中子和电子原子原子核质子中子带负电荷带正电荷不带电荷1.6748×10-27千克 1.6726×10-27千克 9.1176×10-31千克 质子数(核电荷数)=核外电子数
原子不显电性核外电子知识的延伸实验证明,质子和中子是由更小的微粒“夸克”构成。
有关夸克的结构和性质仍有探索和研究中……二 核外电子的排布 电子层: K L M N O P Q
离核远近:近 远
能量高低:低 高分层排布钠 Na钾 K 锂 Li铷 Rb 铯 Cs原子与离子的关系:
分子很小,在不断运动,分子间有空隙.
分子仍保持原物质的化学性质
化学反应中,分子可以分割成更小的微粒---原子,即分子是由原子结合而成的原子
原子很小,在不断运动.
化学反应中,原子不能再分,只能重新组合成新的分子.可见,原子是化学变化中的最小微粒.有的物质由原子直接构成,如稀有气体、金属单质、碳的单质(金刚石)等.所以原子也是构成物质的一种微粒.离子活泼金属的原子易失电子而带正电,活泼非金属原子易得电子而带负电,带电的原子叫做离子.
离子也在不断运动.
活泼金属元素与活泼非金属元素组成的物质,通常是由阴、阳离子相互吸引而构成的.
离子是又一种构成物质的微粒. 原子的结构原子是构成物质的一种微粒 用真空遂道显微镜观察原子 而原子呢?是否还可以再分? 为了探索原子内部结构,科学家们进行了无数的实验。他们用原子模型来表示原子,并通过实验来不断的修正模型。 我们知道分子是由原子构成的,通过扫描遂道显微镜(STM)可以看到单个的原子。用真空遂道显微镜观察原子近代科学原子论(1803年)一切物质都是由最小的不能再分的粒子——原子构成。
原子模型:原子是坚实的、不可再分的实心球。英国化学家道尔顿
(J.Dalton , 1766~1844)“化学的新时代是从原子论开始的”
——恩格斯OK阴极汤姆生发现电子,提出原子模型原子并不是构成物质的最小微粒 ——汤姆生发现了电子(1897年)电子是种带负电、有一定质量的微粒,普遍存在于各种原子之中。
汤姆生原子模型:原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了电荷,从而形成了中性原子。英国物理学家汤姆生
(J.J.Thomson ,1856~1940) 2.卢瑟福(E.Rutherford)的“行星模型”。卢瑟福用α粒子束(He2+)轰击一块金箔,并用荧光屏探测α粒子(He2+)方向改变的程度。ZnS屏卢瑟福根据α粒子散射现象,提出带核的原子结构模型α粒子散射实验(1909年) ——原子有核卢瑟福和他的助手做了著名α粒子散射实验。根据实验,卢瑟福在1911年提出原子有核模型。
卢瑟福原子模型(又称行星原子模型):原子是由居于原子中心的带正电的原子核和核外带负电的电子构成。原子核的质量几乎等于原子的全部质量,电子在原子核外空间绕核做高速运动。英国科学家卢瑟福
(E.Rutherford,1871~1937)玻尔原子模型(1913年)玻尔借助诞生不久的量子理论改进了卢瑟福的模型。
玻尔原子模型(又称分层模型):当原子只有一个电子时,电子沿特定球形轨道运转;当原子有多个电子时,它们将分布在多个球壳中绕核运动。
不同的电子运转轨道是具有一定级差的稳定轨道。
丹麦物理学家玻尔
(N.Bohr,1885~1962)电子云模型 (现代物质结构学说)现代科学家们在实验中发现,电子在原子核周围有的区域出现的次数多,有的区域出现的次数少,就像“云雾”笼罩在原子核周围。因而提出了“电子云模型”。
电子云密度大的地方,表明电子在核外单位体积内出现的机会多,反之,出现的机会少。
如:氢原子的电子云电子云现代物质结构学说原子结构模型的演变1803年汤姆生原子模型1911年玻尔原子模型1913年 1897年卢瑟福原子模型道尔顿原子模型电子云模型1927-1935年 原子是由居于原子中心的带正电的原子核和核外带负电的电子构成,电子在原子核外绕核做高速运动。 原子核的质量几乎是整个原子的质量,那么原子核又是怎样构成的呢?揭开原子核的秘密实验证明:原子核是由带正电的质子和不带电的中子构成。其中质子数决定了原子的种类。如:碳原子质子、中子和电子原子原子核质子中子带负电荷带正电荷不带电荷1.6748×10-27千克 1.6726×10-27千克 9.1176×10-31千克 质子数(核电荷数)=核外电子数
原子不显电性核外电子知识的延伸实验证明,质子和中子是由更小的微粒“夸克”构成。
有关夸克的结构和性质仍有探索和研究中……二 核外电子的排布 电子层: K L M N O P Q
离核远近:近 远
能量高低:低 高分层排布钠 Na钾 K 锂 Li铷 Rb 铯 Cs原子与离子的关系:
