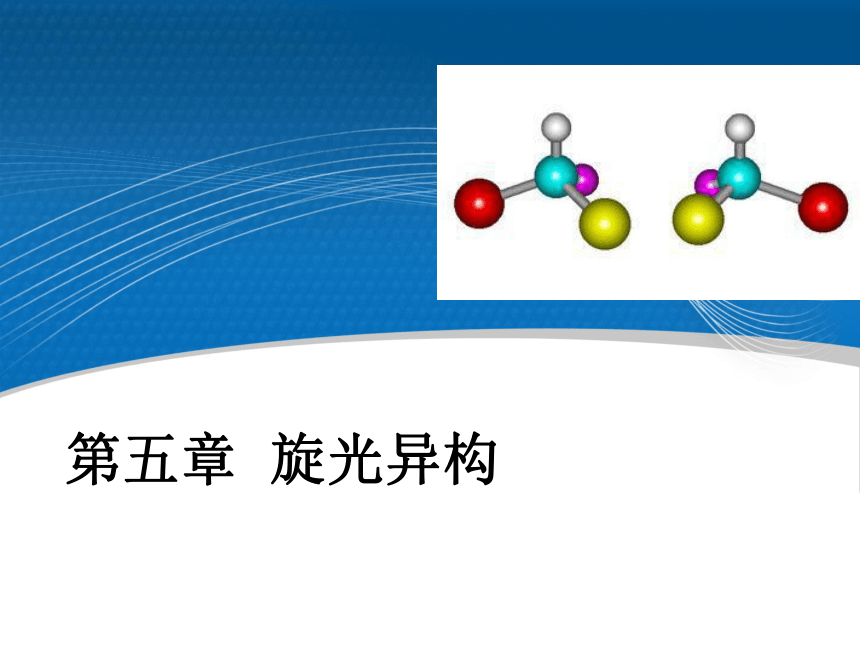
第五章 旋光异构
图片预览






文档简介
课件57张PPT。第五章 旋光异构一、偏振光和旋光活性
二、比旋光度
三、分子对称性、手性与旋光活性
四、含一个手性碳原子化合物
五、费歇尔投影式
六、构型表示法
七、含两个手性碳原子化合物
八、不含手性碳原子化合物的旋光异构现象
九、环状化合物的立体异构
十、不对称合成
十一、外消旋体拆分主 要 内 容1. 掌握旋光异构的概念及产生的原因,分子对称性、
手性与旋光活性的关系;对映异构体的构型表示方
法(R/S、D/L),Fischer投影式写法及要求;
2. 熟悉手性碳原子,手性分子,左旋体,右旋体,内
消旋体,外消旋体,对映体,非对映体及比旋光度
的概念;不含手性碳原子化合物的旋光异构现象;
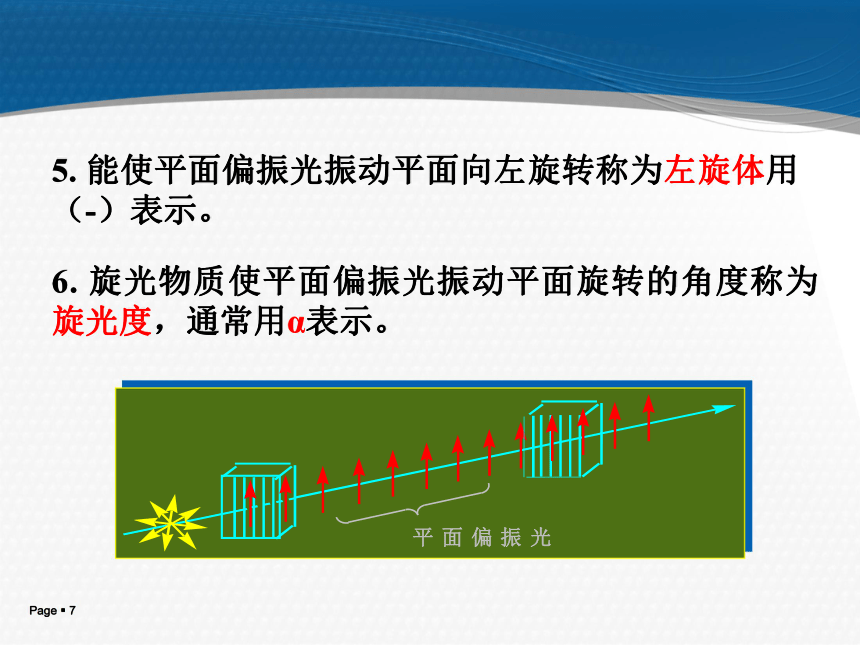
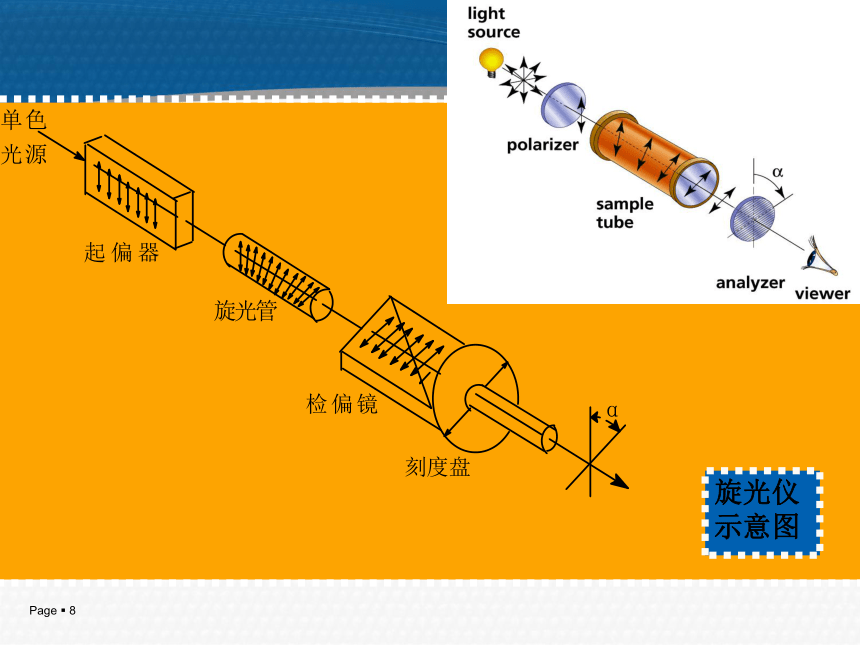
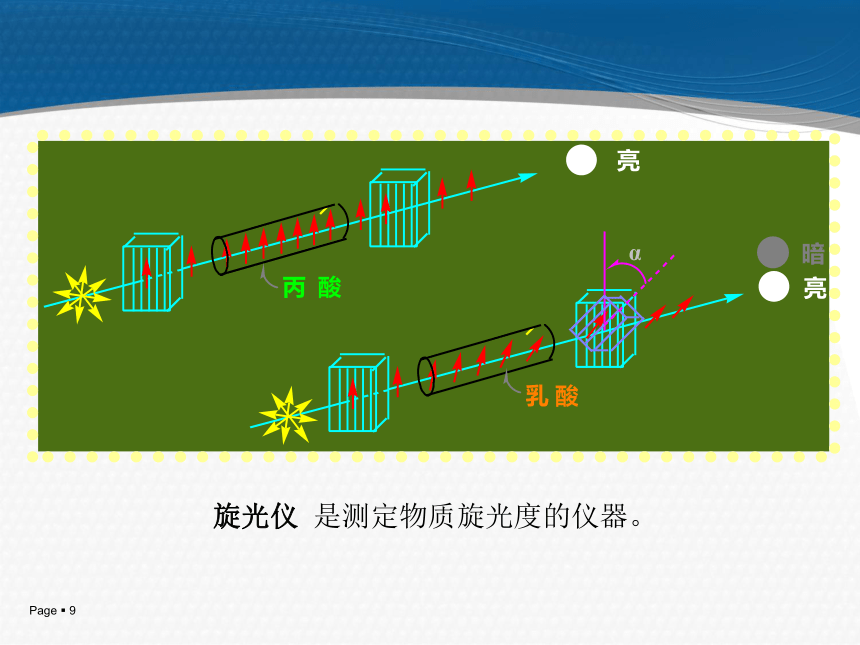
3.了解旋光异构体性质及外消旋体拆分;不对称合成。[教学目的和基本要求]对映异构:分子式、构造式相同,构型式不同且互呈镜象对映关系。旋光异构一、 偏振光和旋光性1. 只在一个平面上振动的光称为平面偏振光,简称偏振光或偏光。2. 能使平面偏振光振动平面旋转的性质称为物质的旋光性。3. 具有旋光性的物质称为旋光性物质或光活性物质。 4. 能使平面偏振光振动平面向右旋转称为右旋体用(+)表示。5. 能使平面偏振光振动平面向左旋转称为左旋体用(-)表示。6. 旋光物质使平面偏振光振动平面旋转的角度称为旋光度,通常用α表示。旋光仪示意图 旋光仪 是测定物质旋光度的仪器。 二、比旋光度 比旋光度是旋光物质特有的物理常数。 为了能比较物质的旋光性能,通常规定:
1 mL含1 g旋光物质的溶液,放在10 cm长的盛液管中测得的旋光度为该物质的比旋光度,常用为测时温度,λ为测定值,光的波长一般采用钠光(波长为589 nm,用D表示)。a- 样品的旋光度
l- 样品管的长度
c - 样品的浓度[?]?t = 三、分子对称性、手性与旋光活性 1848年,巴斯德首次成功地把一个外消旋体分成右旋
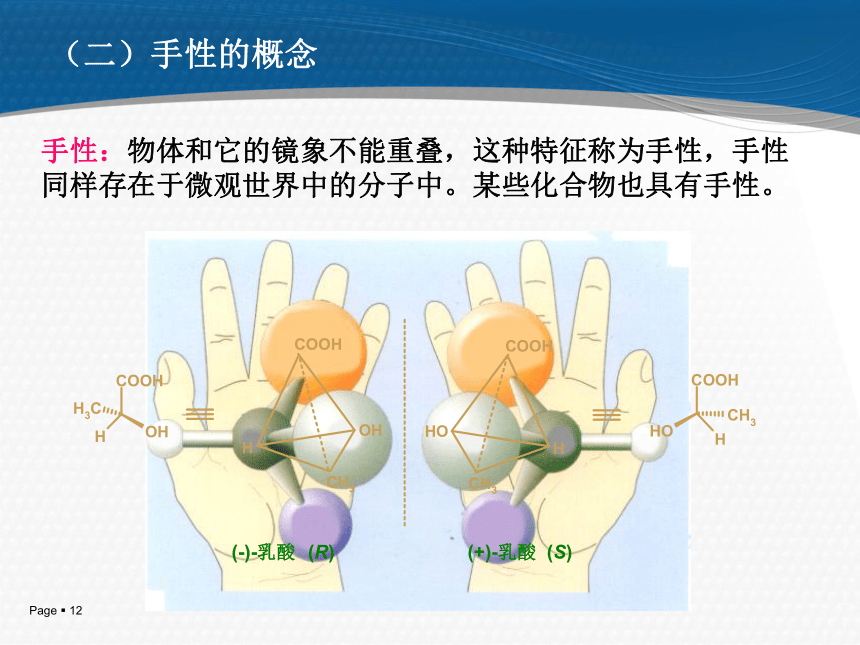
及左旋体。并首次提出光活性是由于分子的不对称结构所引起的。 1874年,范特霍夫和勒贝尔提出,如果一个C原子连有四个不同基团,这四个基团在C原子周围可以有两种不同的排列形式,有两种不同的四面体空间构型,它们互为镜象,和左右手之间的关系一样,外形相似,但不能重合。两只手的关系称作实物与镜象的对映关系。 (一) 对映异构现象的发现 (-)-乳酸 (R) (+)-乳酸 (S)手性:物体和它的镜象不能重叠,这种特征称为手性,手性同样存在于微观世界中的分子中。某些化合物也具有手性。(二)手性的概念手性是宇宙的普遍特征为什么不对称分子在体内的行为是有差异的?酶或者受体与分子的相互作用必须是相互匹配的。不对称性的重要意义(S)-引起胎儿致畸,或死亡 (R)-镇静剂,止吐Thalidomide 的悲剧…..
二十世纪五十年代它曾用于治疗妇女的早期妊娠反应。不幸的是有些曾服用过这种药的孕妇产下了畸形的婴儿。
据统计~7-10,000 名婴儿的畸形是由其中的(S)构型的异构体所致,而(R)构型的异构体是安全的。 1、手性分子,实物和镜像不能完全重叠的分子。 2、手性C原子,用*表示,连四个不同基团的中心C原子称手性C原子,又称不对称C原子。(三)手性与对称因素 1. 手性是物质具有旋光性和对映异构现象的充分必要
条件。 具有手性的分子叫手性分子,手性分子必定旋光,旋光的分子必定是手性的。 2 . 对称因素★ 手性分子在结构上有哪些特点?★ 手性物质是否一定含有手性C原子?★ 含有手性C原子的是否一定有旋光性?(1)对称面(σ)结论:具有对称面的化合物是非手性分子,它没有
对映异构体和旋光性。 (2) 对称中心(i)结论:具有对称中心的化合物是非手性分子,它没有
对映异构体和旋光性。 课堂练习:找出下列化合物中的手性碳原子四、含有一个手性碳原子化合物的对映异构 1.定义:两种立体异构体在空间有两种不同的排列方式互呈物体和镜象的对映关系,互称对映异构体,简称为对映体。 ①理化性质一般都相同。②只是对偏振光表现现不同的旋光性能,旋转角度相等,方向相反。 ③ 在手性环境的条件下如手性试剂、手性溶剂、手性催
化剂的存在下也会表现出某些不同的性质。 ④对映异构体的生理作用表现出很大的差别。对映体2.性质 1.定义:对映体中等量左、右旋体的混合物。 2.性质 ①外消旋体没有旋光性。 ②外消旋体和相应的左旋或右旋,除旋光性能不同外,其它物理性质
也有差异,化学性质则基本相同。③在生理作用方面,外消旋体仍各发挥其所含右旋和左旋的相应效能。 外消旋体费歇尔投影式光照相当于将一个立体模型放在幕前,用光照射模型,在幕上得出的平面影象五、费歇尔投影式投影原则: ① 横竖的交点为手性C原子。
② “横前竖后”。
③ 主碳链竖的排列,氧化最高的C原子放在碳链的顶端。费歇尔 投影式处理费歇尔投影式的注意事项在纸面上平移,构型不变
在平面上旋转180°,构型不变。3. 在平面上旋转90°或270°,得到对映体4. 离开平面翻转180°,得到对映体。5.取代基互换位置奇数次,得到对映体。
6. 取代基互换位置偶数次,构型不变。每旋转90?,构型改变一次;两个基团调换,构型改变;旋转180?,构型不变;六 构型的表示方法1. R / S标记法A. 三维结构:规定:当最小基团离我们最远时,其余三个基团从大到小的顺序若为顺时针,其构型为R;若为逆时针,构型为S。B. Fischer 投影式: 结论:当最小基团处于横键位置时,其余三个基团从大到小的顺序若为逆时针,其构型为R;反之,构型为S。“横前竖后”结论:当最小基团处于竖键位置时,其余三个基团从大到小的顺序若为顺时针,其构型为R;反之,构型为S。“横前竖后”SRR? 判断基团大小的依据是我们已经熟悉的次序规则例三:2,3-二氯戊烷小结a.?R/S构型与物质的旋光性之间没有必然的联系 。
b.?R构型的对映体一定是S构型。
c. 一个手性C原子的构型为R或S与所连的原子或基团在空间的相对位置次序有关。D-(+)-甘油醛 L-(-)-甘油醛2. D / L标示法D、L与 “+、-” 没有必然的联系 1.?含有两个不同手性碳原子的化合物 ①2,3,4—三羟基丁酸 HOOCC*HOHC*HClCOOH七、含两个手性碳原子化合物的对映异构其中: Ⅰ和Ⅱ,Ⅲ和Ⅳ是对映体;Ⅰ和Ⅲ,Ⅱ和Ⅳ为非对映异构体。 ② 非对映异构体:不呈镜象对映关系的立体异构称为非对映异构体。 其性质: a. 物理性质不同。
b. 比旋光度也不同,旋光方向可能一样,也
可能不一样。
c. 化学性质相似。 2.?含有两个相同手性碳原子的化合物 ① 酒石酸 HOOC-CHOH-CHOH-COOH③ 内消旋体和外消旋体其性质: a. 都不具有光学活性。
b. 内消旋体是一种纯物质,不能分离成具有旋光性
的化合物。
c. 外消旋体是混合物,可分离出具有旋光性的两种
物质。 ② 内消旋体
由于分子中含有两个相同的手性碳原子,分子的两半部分互为物体与镜象关系,从而使分子内部旋光性相互抵消的光学活性化合物为内消旋体。八. 不含手性碳原子的化合物的旋光异构1. 丙二烯的衍生物,当C1和C3各连有不同基团时,也有旋光异构体由于所连的两个相同取代基在同一平面,整个分子有对称面,没有手性。 联苯能拆开的必要条件是:
a.邻位上的基团大到足以使绕中心键的自由旋转缓慢。
b.在联苯体系的两个环上都是不对称的取代。例:2, 6-二羧-2′, 6′-二硝基联苯(2) 单键旋转受阻碍的联苯型化合物 1.两个不同的二取代基, 顺反异构都没有对称面和对称中心,因此有四个构 型异构体。九 环状化合物的立体异构 2.两个相同的取代基,1,2-二 羧基环丙烷,有三个构型异构体。 思考?手性分子、手性碳原子、对映异构体、旋光性之间什么关系?十、不对称合成(一)、烷烃的卤代反应# 凡是有立体选择性的反应,产物中必然有某一个立体异构为主要产物。这种将分子中一个非手性中心转化为手性中心时所得到的立体异构体的量是不均等的,亦即使某一个立体异构的量占优势的合成,叫不对称合成。手性药物带来的市场效益及增长的需求2001年 手性药物销售1472亿美元
2000年 手性药物销售1320亿美元,比1999年增加13%
1999年 手性药物销售1170亿美元
1997年 手性药物销售 910亿美元, 比1996年增加21%
1993年 手性药物销售 356亿美元, 比1992年增加22%
1990年 手性药物销售 180亿美元1997年全世界100个热销药物中,50个是单一对映体(手性药物) 100 个热销药物 852 亿美元
50 个手性药物 428 亿美元
而在1993年 97个热销药中,手性药物占 20%(二) 烯烃的加成反应实验事实
顺式2-丁烯得到外消旋体。#某一立体异构的反应物只得到某一种特定的立体异构产物,叫立体专一反应。 2. 历程 ② 溴翁离子中间体反-2-丁烯与溴代加成生成内消旋体:# 化学方法: 通过化学方法把组成外消旋体的一对对映体与一旋光物质反应,使生成非对映体,再利用非对映体的物理性质的差异达到分离的目的。十一 外消旋体拆分生物方法:利用生物体对于外消旋体表现出的选择性,也可以用来拆分外消旋体。 此法的特点:
1. 外消旋体中的一个异构体被生物体同化,而只得保留另一个异构体,因而原料损失了一半。
2. 用这种方法,溶液不能太浓,还需要在培养液中加入营养物质,这又给产品纯化带来了很大的困难。
3. 恰当的微生物很难找,从而在应用上有一定的局限性。晶种法:这是最经济的方法。柱层析法:作业:P94 5.5
预习:卤代烃
二、比旋光度
三、分子对称性、手性与旋光活性
四、含一个手性碳原子化合物
五、费歇尔投影式
六、构型表示法
七、含两个手性碳原子化合物
八、不含手性碳原子化合物的旋光异构现象
九、环状化合物的立体异构
十、不对称合成
十一、外消旋体拆分主 要 内 容1. 掌握旋光异构的概念及产生的原因,分子对称性、
手性与旋光活性的关系;对映异构体的构型表示方
法(R/S、D/L),Fischer投影式写法及要求;
2. 熟悉手性碳原子,手性分子,左旋体,右旋体,内
消旋体,外消旋体,对映体,非对映体及比旋光度
的概念;不含手性碳原子化合物的旋光异构现象;
3.了解旋光异构体性质及外消旋体拆分;不对称合成。[教学目的和基本要求]对映异构:分子式、构造式相同,构型式不同且互呈镜象对映关系。旋光异构一、 偏振光和旋光性1. 只在一个平面上振动的光称为平面偏振光,简称偏振光或偏光。2. 能使平面偏振光振动平面旋转的性质称为物质的旋光性。3. 具有旋光性的物质称为旋光性物质或光活性物质。 4. 能使平面偏振光振动平面向右旋转称为右旋体用(+)表示。5. 能使平面偏振光振动平面向左旋转称为左旋体用(-)表示。6. 旋光物质使平面偏振光振动平面旋转的角度称为旋光度,通常用α表示。旋光仪示意图 旋光仪 是测定物质旋光度的仪器。 二、比旋光度 比旋光度是旋光物质特有的物理常数。 为了能比较物质的旋光性能,通常规定:
1 mL含1 g旋光物质的溶液,放在10 cm长的盛液管中测得的旋光度为该物质的比旋光度,常用为测时温度,λ为测定值,光的波长一般采用钠光(波长为589 nm,用D表示)。a- 样品的旋光度
l- 样品管的长度
c - 样品的浓度[?]?t = 三、分子对称性、手性与旋光活性 1848年,巴斯德首次成功地把一个外消旋体分成右旋
及左旋体。并首次提出光活性是由于分子的不对称结构所引起的。 1874年,范特霍夫和勒贝尔提出,如果一个C原子连有四个不同基团,这四个基团在C原子周围可以有两种不同的排列形式,有两种不同的四面体空间构型,它们互为镜象,和左右手之间的关系一样,外形相似,但不能重合。两只手的关系称作实物与镜象的对映关系。 (一) 对映异构现象的发现 (-)-乳酸 (R) (+)-乳酸 (S)手性:物体和它的镜象不能重叠,这种特征称为手性,手性同样存在于微观世界中的分子中。某些化合物也具有手性。(二)手性的概念手性是宇宙的普遍特征为什么不对称分子在体内的行为是有差异的?酶或者受体与分子的相互作用必须是相互匹配的。不对称性的重要意义(S)-引起胎儿致畸,或死亡 (R)-镇静剂,止吐Thalidomide 的悲剧…..
二十世纪五十年代它曾用于治疗妇女的早期妊娠反应。不幸的是有些曾服用过这种药的孕妇产下了畸形的婴儿。
据统计~7-10,000 名婴儿的畸形是由其中的(S)构型的异构体所致,而(R)构型的异构体是安全的。 1、手性分子,实物和镜像不能完全重叠的分子。 2、手性C原子,用*表示,连四个不同基团的中心C原子称手性C原子,又称不对称C原子。(三)手性与对称因素 1. 手性是物质具有旋光性和对映异构现象的充分必要
条件。 具有手性的分子叫手性分子,手性分子必定旋光,旋光的分子必定是手性的。 2 . 对称因素★ 手性分子在结构上有哪些特点?★ 手性物质是否一定含有手性C原子?★ 含有手性C原子的是否一定有旋光性?(1)对称面(σ)结论:具有对称面的化合物是非手性分子,它没有
对映异构体和旋光性。 (2) 对称中心(i)结论:具有对称中心的化合物是非手性分子,它没有
对映异构体和旋光性。 课堂练习:找出下列化合物中的手性碳原子四、含有一个手性碳原子化合物的对映异构 1.定义:两种立体异构体在空间有两种不同的排列方式互呈物体和镜象的对映关系,互称对映异构体,简称为对映体。 ①理化性质一般都相同。②只是对偏振光表现现不同的旋光性能,旋转角度相等,方向相反。 ③ 在手性环境的条件下如手性试剂、手性溶剂、手性催
化剂的存在下也会表现出某些不同的性质。 ④对映异构体的生理作用表现出很大的差别。对映体2.性质 1.定义:对映体中等量左、右旋体的混合物。 2.性质 ①外消旋体没有旋光性。 ②外消旋体和相应的左旋或右旋,除旋光性能不同外,其它物理性质
也有差异,化学性质则基本相同。③在生理作用方面,外消旋体仍各发挥其所含右旋和左旋的相应效能。 外消旋体费歇尔投影式光照相当于将一个立体模型放在幕前,用光照射模型,在幕上得出的平面影象五、费歇尔投影式投影原则: ① 横竖的交点为手性C原子。
② “横前竖后”。
③ 主碳链竖的排列,氧化最高的C原子放在碳链的顶端。费歇尔 投影式处理费歇尔投影式的注意事项在纸面上平移,构型不变
在平面上旋转180°,构型不变。3. 在平面上旋转90°或270°,得到对映体4. 离开平面翻转180°,得到对映体。5.取代基互换位置奇数次,得到对映体。
6. 取代基互换位置偶数次,构型不变。每旋转90?,构型改变一次;两个基团调换,构型改变;旋转180?,构型不变;六 构型的表示方法1. R / S标记法A. 三维结构:规定:当最小基团离我们最远时,其余三个基团从大到小的顺序若为顺时针,其构型为R;若为逆时针,构型为S。B. Fischer 投影式: 结论:当最小基团处于横键位置时,其余三个基团从大到小的顺序若为逆时针,其构型为R;反之,构型为S。“横前竖后”结论:当最小基团处于竖键位置时,其余三个基团从大到小的顺序若为顺时针,其构型为R;反之,构型为S。“横前竖后”SRR? 判断基团大小的依据是我们已经熟悉的次序规则例三:2,3-二氯戊烷小结a.?R/S构型与物质的旋光性之间没有必然的联系 。
b.?R构型的对映体一定是S构型。
c. 一个手性C原子的构型为R或S与所连的原子或基团在空间的相对位置次序有关。D-(+)-甘油醛 L-(-)-甘油醛2. D / L标示法D、L与 “+、-” 没有必然的联系 1.?含有两个不同手性碳原子的化合物 ①2,3,4—三羟基丁酸 HOOCC*HOHC*HClCOOH七、含两个手性碳原子化合物的对映异构其中: Ⅰ和Ⅱ,Ⅲ和Ⅳ是对映体;Ⅰ和Ⅲ,Ⅱ和Ⅳ为非对映异构体。 ② 非对映异构体:不呈镜象对映关系的立体异构称为非对映异构体。 其性质: a. 物理性质不同。
b. 比旋光度也不同,旋光方向可能一样,也
可能不一样。
c. 化学性质相似。 2.?含有两个相同手性碳原子的化合物 ① 酒石酸 HOOC-CHOH-CHOH-COOH③ 内消旋体和外消旋体其性质: a. 都不具有光学活性。
b. 内消旋体是一种纯物质,不能分离成具有旋光性
的化合物。
c. 外消旋体是混合物,可分离出具有旋光性的两种
物质。 ② 内消旋体
由于分子中含有两个相同的手性碳原子,分子的两半部分互为物体与镜象关系,从而使分子内部旋光性相互抵消的光学活性化合物为内消旋体。八. 不含手性碳原子的化合物的旋光异构1. 丙二烯的衍生物,当C1和C3各连有不同基团时,也有旋光异构体由于所连的两个相同取代基在同一平面,整个分子有对称面,没有手性。 联苯能拆开的必要条件是:
a.邻位上的基团大到足以使绕中心键的自由旋转缓慢。
b.在联苯体系的两个环上都是不对称的取代。例:2, 6-二羧-2′, 6′-二硝基联苯(2) 单键旋转受阻碍的联苯型化合物 1.两个不同的二取代基, 顺反异构都没有对称面和对称中心,因此有四个构 型异构体。九 环状化合物的立体异构 2.两个相同的取代基,1,2-二 羧基环丙烷,有三个构型异构体。 思考?手性分子、手性碳原子、对映异构体、旋光性之间什么关系?十、不对称合成(一)、烷烃的卤代反应# 凡是有立体选择性的反应,产物中必然有某一个立体异构为主要产物。这种将分子中一个非手性中心转化为手性中心时所得到的立体异构体的量是不均等的,亦即使某一个立体异构的量占优势的合成,叫不对称合成。手性药物带来的市场效益及增长的需求2001年 手性药物销售1472亿美元
2000年 手性药物销售1320亿美元,比1999年增加13%
1999年 手性药物销售1170亿美元
1997年 手性药物销售 910亿美元, 比1996年增加21%
1993年 手性药物销售 356亿美元, 比1992年增加22%
1990年 手性药物销售 180亿美元1997年全世界100个热销药物中,50个是单一对映体(手性药物) 100 个热销药物 852 亿美元
50 个手性药物 428 亿美元
而在1993年 97个热销药中,手性药物占 20%(二) 烯烃的加成反应实验事实
顺式2-丁烯得到外消旋体。#某一立体异构的反应物只得到某一种特定的立体异构产物,叫立体专一反应。 2. 历程 ② 溴翁离子中间体反-2-丁烯与溴代加成生成内消旋体:# 化学方法: 通过化学方法把组成外消旋体的一对对映体与一旋光物质反应,使生成非对映体,再利用非对映体的物理性质的差异达到分离的目的。十一 外消旋体拆分生物方法:利用生物体对于外消旋体表现出的选择性,也可以用来拆分外消旋体。 此法的特点:
1. 外消旋体中的一个异构体被生物体同化,而只得保留另一个异构体,因而原料损失了一半。
2. 用这种方法,溶液不能太浓,还需要在培养液中加入营养物质,这又给产品纯化带来了很大的困难。
3. 恰当的微生物很难找,从而在应用上有一定的局限性。晶种法:这是最经济的方法。柱层析法:作业:P94 5.5
预习:卤代烃
