化学人教版(2019)必修第一册3.2.1 常见的合金及应用(共21张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册3.2.1 常见的合金及应用(共21张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 17.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-04 09:29:03 | ||
图片预览








文档简介
(共21张PPT)
第三章 铁 金属材料
第二节 金属材料
常见的合金及应用
今天你都看到了什么金属材料?
合金是由两种或两种以上的金属或金属与非金属熔合而成的具有金属特性的物质。
金属材料
纯金属
合金
80多种
几千种
金属材料
生活中用到的金属材料是纯金属较多还是合金较多?
合金多
(2)合金的特性及原因
①一般来说,合金的性能并不是各成分金属性能的总和,合金的物理、化学及机械性能 各成分金属,合金比各成分金属的硬度 。
②合金的性能可以通过所添加的合金元素的种类、含量和生成合金的条件等来加以调节。
例如:硬铝(Al、Cu、Mg、Mn、Si)的强度和硬度都比纯铝的 。
优于
大
大
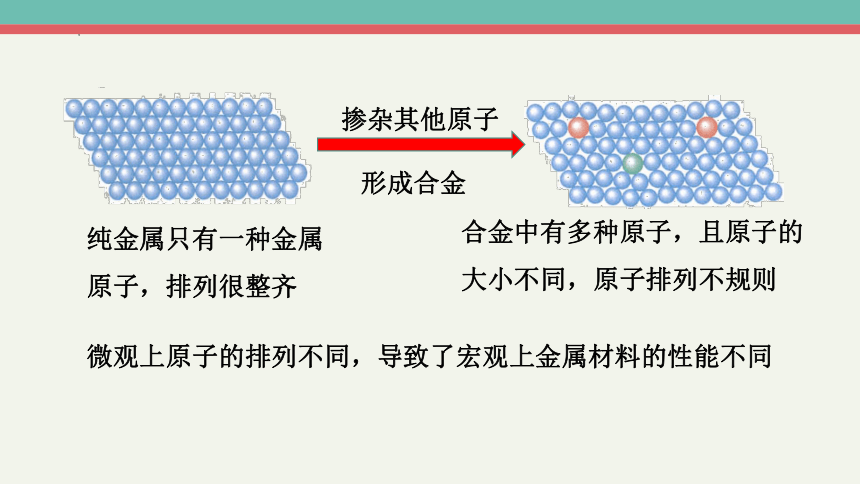
纯金属只有一种金属原子,排列很整齐
合金中有多种原子,且原子的大小不同,原子排列不规则
掺杂其他原子
形成合金
微观上原子的排列不同,导致了宏观上金属材料的性能不同
一、铁合金
生铁
钢
铁合金
含碳量不同
含碳量在2%~4.3%之间
含碳量在0.03%~2%之间
硬度大、抗压、性脆、可以铸造成型
延展性和机械性能好、可以锻轧和铸造
钢:用量最大,用途最广的合金
生铁
钢
钢
碳素钢
低碳钢
(含碳0.3%~0.6%)
高碳钢
(含碳0.03%~0.3%)
中碳钢
(含碳0.6%~2% )
合金钢
(特种钢)
在碳素钢中加入铬、锰、钨、硅等合金元素,使其具有特殊性能
钢板、钢丝、钢管
钢轨、车轮、建材
器械、弹簧、刀具
不锈钢是最常见的合金钢,其合金元素是Cr和Ni
(1)合金一定是不同金属熔合而成的具有金属特性的化合物( )
(2)生铁的熔点比纯铁低,但机械强度和硬度比纯铁高( )
(3)铁、铬、镍熔合成不锈钢是化学变化( )
(4)生铁中的铁与纯铁的化学性质不同( )
(5)地震灾区重建要使用大量钢材,钢材是合金( )
×
√
判断正误
√
×
×
深度思考
已知铜的熔点为1 083 ℃,钠的沸点为883 ℃,试问铜与钠能否形成合金?
提示 不能。当铜开始熔化时,钠已经气化,所以二者不能形成合金。
二、铝和铝合金
铝比较活泼,很容易与空气中的氧气反应在其表面形成一层致密的氧化膜,所以铝不要特殊的防腐措施。
铝块
特别提醒 在常温下形成致密保护膜的金属,如铝、镁等金属。
铁在高温下形成致密保护膜,俗称“烤蓝”,铁或铝遇到浓H2SO4或浓HNO3时,迅速反应生成致密氧化膜,称为钝化。
分别向盐酸和氢氧化钠溶液中加入铝片,观察现象
刚开始反应较慢,后反应剧烈,生成气体,可以点燃
实验:在盐酸和氢氧化钠溶液中分别加铝片
偏铝酸钠
单质铝和盐酸、氢氧化钠溶液都反应,现象相似,都生成氢气
2Al + 6HCl 2AlCl3 + 3H2↑
等质量的铝与盐酸或者氢氧化钠溶液反应生成相同量的氢气
2Al + 2NaOH + 2H2O 2NaAlO2 + 3H2↑
【练习】相同质量的两份铝,分别放入足量的盐酸和氢氧化钠溶液中,生成的氢气在同温同压下体积比为 。
1:1
2Al + 2OH- + 2H2O 2 + 3H2↑
偏铝酸根
【思考与交流】反应开始的时候气泡很少,后期才有大量气泡,为什么?
铝的表面有Al2O3,刚开始是Al2O3和溶液反应,然后才是Al与溶液反应生成大量的H2,这说明Al2O3和HCl、NaOH都能发生反应
Al2O3 + 6HCl 2AlCl3 + 3H2O
Al2O3 + 2NaOH 2NaAlO2 + H2O
既能与酸反应生成盐和水,也能与碱反应生成盐和水的氧化物,叫做两性氧化物。
铝制餐具是否可以蒸煮或长时间存放酸(碱)性食物?
不可以
练习:根据氧化物的性质对下列氧化物进行分类:
Na2O CO2 CO SO3 CaO FeO H2O Al2O3
①酸性氧化物: 。
②碱性氧化物: 。
③两性氧化物: 。
④和酸碱都不反应的是 。
CO2 SO3
Na2O CaO FeO
Al2O3
CO H2O
门窗
散热器
轮毂
餐具
管件
为什么生活中很少见到以纯铝为材料的制品?
纯铝的硬度和强度都比较小,不适合作为生产生活中的材料使用,使用较多的是具有不同组成和性质的铝合金。
1.向某溶液中加入铝粉能放出H2,下列各组离子一定不能在该溶液中大量共存的是
√
应用体验
2.向集满CO2的铝制易拉罐中加入过量NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。上述实验过程中发生的离子反应有__________________________________________________
______________________________________________________________
______________________________________________________________ 。
解析 向集满CO2的易拉罐中加入过量NaOH浓溶液,易拉罐渐渐凹瘪,是由于CO2被NaOH溶液吸收,气体压强减小,发生了①反应;
铝制易拉罐表面的Al2O3会与NaOH溶液反应,发生了②反应;
NaOH溶液能与Al发生反应生成H2,使易拉罐凸起,发生了③反应。
1. 铁合金:
小结
Al
O2
Al2O3
HCl
NaOH
HCl
NaOH
2Al+6HCl=2AlCl3+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
Al2O3+6HCl=2AlCl3+3H2O
Al2O3+2NaOH=2NaAlO2+H2O
小结
合金的性质及特点:
2、金属铝的化学性质:
硬度大于各成分金属
熔点低于各成分金属
第三章 铁 金属材料
第二节 金属材料
常见的合金及应用
今天你都看到了什么金属材料?
合金是由两种或两种以上的金属或金属与非金属熔合而成的具有金属特性的物质。
金属材料
纯金属
合金
80多种
几千种
金属材料
生活中用到的金属材料是纯金属较多还是合金较多?
合金多
(2)合金的特性及原因
①一般来说,合金的性能并不是各成分金属性能的总和,合金的物理、化学及机械性能 各成分金属,合金比各成分金属的硬度 。
②合金的性能可以通过所添加的合金元素的种类、含量和生成合金的条件等来加以调节。
例如:硬铝(Al、Cu、Mg、Mn、Si)的强度和硬度都比纯铝的 。
优于
大
大
纯金属只有一种金属原子,排列很整齐
合金中有多种原子,且原子的大小不同,原子排列不规则
掺杂其他原子
形成合金
微观上原子的排列不同,导致了宏观上金属材料的性能不同
一、铁合金
生铁
钢
铁合金
含碳量不同
含碳量在2%~4.3%之间
含碳量在0.03%~2%之间
硬度大、抗压、性脆、可以铸造成型
延展性和机械性能好、可以锻轧和铸造
钢:用量最大,用途最广的合金
生铁
钢
钢
碳素钢
低碳钢
(含碳0.3%~0.6%)
高碳钢
(含碳0.03%~0.3%)
中碳钢
(含碳0.6%~2% )
合金钢
(特种钢)
在碳素钢中加入铬、锰、钨、硅等合金元素,使其具有特殊性能
钢板、钢丝、钢管
钢轨、车轮、建材
器械、弹簧、刀具
不锈钢是最常见的合金钢,其合金元素是Cr和Ni
(1)合金一定是不同金属熔合而成的具有金属特性的化合物( )
(2)生铁的熔点比纯铁低,但机械强度和硬度比纯铁高( )
(3)铁、铬、镍熔合成不锈钢是化学变化( )
(4)生铁中的铁与纯铁的化学性质不同( )
(5)地震灾区重建要使用大量钢材,钢材是合金( )
×
√
判断正误
√
×
×
深度思考
已知铜的熔点为1 083 ℃,钠的沸点为883 ℃,试问铜与钠能否形成合金?
提示 不能。当铜开始熔化时,钠已经气化,所以二者不能形成合金。
二、铝和铝合金
铝比较活泼,很容易与空气中的氧气反应在其表面形成一层致密的氧化膜,所以铝不要特殊的防腐措施。
铝块
特别提醒 在常温下形成致密保护膜的金属,如铝、镁等金属。
铁在高温下形成致密保护膜,俗称“烤蓝”,铁或铝遇到浓H2SO4或浓HNO3时,迅速反应生成致密氧化膜,称为钝化。
分别向盐酸和氢氧化钠溶液中加入铝片,观察现象
刚开始反应较慢,后反应剧烈,生成气体,可以点燃
实验:在盐酸和氢氧化钠溶液中分别加铝片
偏铝酸钠
单质铝和盐酸、氢氧化钠溶液都反应,现象相似,都生成氢气
2Al + 6HCl 2AlCl3 + 3H2↑
等质量的铝与盐酸或者氢氧化钠溶液反应生成相同量的氢气
2Al + 2NaOH + 2H2O 2NaAlO2 + 3H2↑
【练习】相同质量的两份铝,分别放入足量的盐酸和氢氧化钠溶液中,生成的氢气在同温同压下体积比为 。
1:1
2Al + 2OH- + 2H2O 2 + 3H2↑
偏铝酸根
【思考与交流】反应开始的时候气泡很少,后期才有大量气泡,为什么?
铝的表面有Al2O3,刚开始是Al2O3和溶液反应,然后才是Al与溶液反应生成大量的H2,这说明Al2O3和HCl、NaOH都能发生反应
Al2O3 + 6HCl 2AlCl3 + 3H2O
Al2O3 + 2NaOH 2NaAlO2 + H2O
既能与酸反应生成盐和水,也能与碱反应生成盐和水的氧化物,叫做两性氧化物。
铝制餐具是否可以蒸煮或长时间存放酸(碱)性食物?
不可以
练习:根据氧化物的性质对下列氧化物进行分类:
Na2O CO2 CO SO3 CaO FeO H2O Al2O3
①酸性氧化物: 。
②碱性氧化物: 。
③两性氧化物: 。
④和酸碱都不反应的是 。
CO2 SO3
Na2O CaO FeO
Al2O3
CO H2O
门窗
散热器
轮毂
餐具
管件
为什么生活中很少见到以纯铝为材料的制品?
纯铝的硬度和强度都比较小,不适合作为生产生活中的材料使用,使用较多的是具有不同组成和性质的铝合金。
1.向某溶液中加入铝粉能放出H2,下列各组离子一定不能在该溶液中大量共存的是
√
应用体验
2.向集满CO2的铝制易拉罐中加入过量NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。上述实验过程中发生的离子反应有__________________________________________________
______________________________________________________________
______________________________________________________________ 。
解析 向集满CO2的易拉罐中加入过量NaOH浓溶液,易拉罐渐渐凹瘪,是由于CO2被NaOH溶液吸收,气体压强减小,发生了①反应;
铝制易拉罐表面的Al2O3会与NaOH溶液反应,发生了②反应;
NaOH溶液能与Al发生反应生成H2,使易拉罐凸起,发生了③反应。
1. 铁合金:
小结
Al
O2
Al2O3
HCl
NaOH
HCl
NaOH
2Al+6HCl=2AlCl3+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
Al2O3+6HCl=2AlCl3+3H2O
Al2O3+2NaOH=2NaAlO2+H2O
小结
合金的性质及特点:
2、金属铝的化学性质:
硬度大于各成分金属
熔点低于各成分金属
