黑龙江省哈尔滨市名校2022-2023学年高二上学期9月开学验收考试化学试题(Word版含答案)
文档属性
| 名称 | 黑龙江省哈尔滨市名校2022-2023学年高二上学期9月开学验收考试化学试题(Word版含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 913.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-04 00:00:00 | ||
图片预览




文档简介
哈尔滨市名校2022-2023学年高二上学期9月开学验收考试
化学试卷
可能用到的相对原子质量:N-14 O-16 Na-23 S-32 I-127
第Ⅰ卷
一、单选题(每小题只有一个选项符合题意,每小题2分,共50分)
1.下列说法错误的是( )
A.煤、石油、天然气是当今世界最重要的三种化石燃料
B.化学反应必伴随能量的变化
C.化学反应释放的能量一定是热能
D.有化学键断裂的变化不一定是化学变化
2.“水也是重要的反应物质”,下列物质中,不能发生水解反应的是
A.纤维素 B.葡萄糖 C.油脂 D.酶
3.下列变化中,属于吸热反应的有几个( )
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓稀释 ④碳酸氢钠和盐酸反应
⑤生石灰跟水反应生成熟石灰 ⑥高温分解 ⑦与盐酸反应
⑧与固体混合 ⑨
⑩
A.5 B.6 C.7 D.8
4.硫元素的价类二维图如图所示.下列说法错误的是( )
A.a与c、d、e都有可能反应生成b
B.d溶液久置于空气中会生成e,溶液的酸性增强
C.盐g与盐f之间也可能发生反应
D.铜与c的浓溶液共热产生的气体通入液中,无明显现象
5.标准状况下,将盛满二氧化氮的大试管倒扣在盛水的水槽中,充分吸收后,试管内溶液的物质的量浓度是( )
A. B. C. D.
6.根据实验目的,下列操作、现象及结论都正确的是( )
选项 目的 操作及现象 结论
A 检验酸性条件蔗糖的水解产物是否含有葡萄糖 向水解液中加入新制,未出现砖红色沉淀 不含葡萄糖
B 检验补铁口服液中是否含有 加入溶液无明显现象,再滴加少量氯水,溶液立即变为红色 含有
C 检验固体是否变质 溶解后,滴加硝酸酸化的硝酸钡溶液,产生白色沉淀 己变质
D 检验某溶液中是否含有 滴加稀溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝 不含
A.A B.B C.C D.D
7.下列说法正确的是( )
A.吸热反应中反应物的总能量大于生成物的总能量
B.将片用导线连接后放入氢氧化钠溶液组成原电池,为负极,为正极
C.由、空气和稀硫酸构成的燃料电池的负极反应是
D.充电电池可以无限制地反复放电、充电
8.下列不能使酸性高锰酸钾溶液褪色的是( )
A. B.聚乙烯 C.乙炔 D.
9.喷泉实验装置如图所示.应用下列各组气体和溶液,不能出现喷泉现象的是( )
气体 溶液
A 溶液
B 溶液
C 稀溶液
D 饱和溶液
A.A B.B C.C D.D
10.由粗制备纯的流程如图所示,下列说法不正确的是( )
A.X可用作木材防火剂
B.步骤Ⅱ的反应是
C.步骤Ⅱ中的稀硫酸可用替代
D.若在实验室中完成步骤Ⅲ,一般在蒸发皿中进行
11.以下关于甲烷的说法中,正确的是( )
①一氯甲烷分子具有四面体结构 ②二氯甲烷有两种同分异构体 ③甲烷与发生光照取代,取代需 ④甲烷分子中四个键,任意两个之间的类角均相等
A.②③④ B.②③ C.①④ D.①③
12.铜锌原电池如图所示,电解质溶液为硫酸铜.下列说法不正确的是( )
A.铜电极为正极,发生氧化反应 B.锌电极为负极,将逐渐被腐蚀
C.铜电极上的反应为: D.电子从锌电极经过导线流向铜电极
13.下列关于离子检验的说法中正确的是( )
A.向某溶液中加入稀盐酸,将产生的无色无味气体通入澄清石灰水中,石灰水变浑浊,则原溶液中一定含有或
B.向某溶液中加入溶液有白色沉淀产生,再加稀盐酸,沉淀不消失,则原溶液中一定有
C.向溶液中先加入溶液,再滴加溶液,溶液变红,则原溶液中含而不含
D.向某溶液中加入溶液产生白色沉淀,再加稀盐酸,沉淀不消失,则原溶液中一定有
14.一定温度下,在固定体积的密闭容器中发生下列反应:.若由降到时,需要,那么由降到时,所需反应的时间为( )
A.等于 B.等于 C.大于 D.小于
15.下列各组物质中互为同系物的是( )
A.和
B.和
C.和
D.和
16.下列各组有机物中,其一氯代物的数目不相等的是( )
A.正戊烷和正已烷 B.新戊烷和
C.甲烷和乙烷 D.丙烷和
17.以下物质间的每步转化,不能通过一步反应实现的是( )
A. B.
C. D.
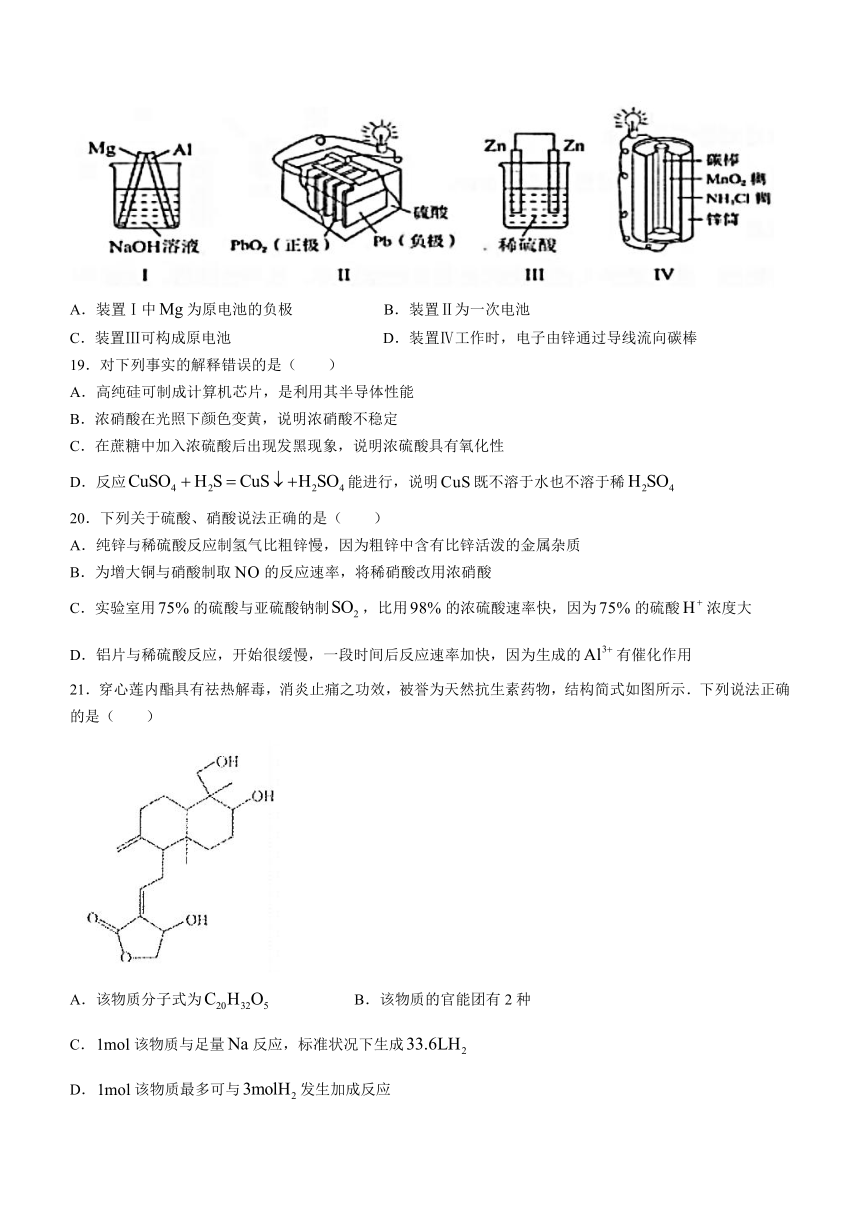
18.下列有关装置的说法正确的是( )
A.装置Ⅰ中为原电池的负极 B.装置Ⅱ为一次电池
C.装置Ⅲ可构成原电池 D.装置Ⅳ工作时,电子由锌通过导线流向碳棒
19.对下列事实的解释错误的是( )
A.高纯硅可制成计算机芯片,是利用其半导体性能
B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有氧化性
D.反应能进行,说明既不溶于水也不溶于稀
20.下列关于硫酸、硝酸说法正确的是( )
A.纯锌与稀硫酸反应制氢气比粗锌慢,因为粗锌中含有比锌活泼的金属杂质
B.为增大铜与硝酸制取的反应速率,将稀硝酸改用浓硝酸
C.实验室用的硫酸与亚硫酸钠制,比用的浓硫酸速率快,因为的硫酸浓度大
D.铝片与稀硫酸反应,开始很缓慢,一段时间后反应速率加快,因为生成的有催化作用
21.穿心莲内酯具有祛热解毒,消炎止痛之功效,被誉为天然抗生素药物,结构简式如图所示.下列说法正确的是( )
A.该物质分子式为 B.该物质的官能团有2种
C.该物质与足量反应,标准状况下生成
D.该物质最多可与发生加成反应
22.下列化学用语表达正确的是( )
A.丙烯的结构简式: B.乙炔的分子式:
C.二氧化碳的空间填充模型: D.醛基的电子式:
23.设为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,含有的分子数为
B.铵根离子中含有的电子数为
C.工业制硫酸用与过量空气反应制转移电子
D.标况下乙烷中含有碳氢键的数目为
24.在一绝热(不与外界发生热交换)的恒容密闭容器中,发生反应:.下列描述中能表明反应已达到平衡状态的有( )个
①容器内温度不变 ②混合气体的密度不变 ③混合气体的压强不变
④混合气体的平均相对分子质量不变 ⑤的物质的量浓度不变
⑥容器内A、C、D三种气体的浓度之比为 ⑦某时刻且不等于零
③单位时间内生成,同时生成
A.4 B.5 C.6 D.7
25.已知反应:生成的初始速率与、的初始浓度的关系为,k为速率常数.在时测得的相关数据如表所示.
实验数据 初始浓度 生成的初始速率
1
2
3
下列说法中不正确的是( )
A.关系式中 B.时,k的值为
C.若时,初始浓度,则生成的初始速率为
D.当其他条件不变时,升高温度,速率常数将增大
Ⅱ卷
二、填空题
26.(8分)一定条件下铁可以和发生反应.一定温度下,向某密闭容器中加入足量铁粉并充入一定量的气体,反应过程中气体和气体的浓度与时间的关系如图所示:
(1)时,正、逆反应速率的大小关系为______(填“>”“<”或“=”).
(2)内,的平均反应速率__________.
(3)下列条件的改变能减慢其反应速率的是____________(填序号,下同).
①降低温度 ②减少铁粉的质量 ③保持压强不变,充入使容器的体积增大
④保持容积不变,充入使体系压强增大
(4)下列描述能说明上述反应已达平衡状态的是________.
① ②单位时间内生成的同时生成
③容器中气体压强不随时间变化而变化
④容器中气体的平均相对分子质量不随时间变化而变化
27.(15分)Ⅰ.某实验小组在实验室制备氨气并进行氨的催化氧化实验,实验装置如图1:
(1)写出上述制备氨气的化学方程式_____________.
(2)U形管中的于燥剂可用__________(填名称),收集氨气应选择安装_______.(选填“a”或“b”).
(3)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨的是__________(填序号).
A. B. C. D.
(4)如图2所示,锥形瓶中是氨气与空气的混合气体,将灼热的铂丝插入锥形瓶中,观察到出现红棕色和白雾.写出氨催化氧化的化学方程式:_________________.
Ⅱ.浓硫酸和木炭在加热时发生化学反应.用如图所示各装置设计一个实验,验证浓硫酸与木炭在加热条件下反应产生的各种产物.
(5)写出浓硫酸和木炭在加热时反应的化学方程:___________.
(6)这些装置的连接顺序(按产物气流从左到右的方向)____________→__________→_________→(填装置的序号).
(7)装置②中要检验产物中有水蒸气,则放入的药品是_________;装置③中要检验产物中有二氧化碳气体,则放入的药品是___________;实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色,B瓶溶液的作用是___________.
28.(12分)某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应.请回答下列问题:
(1)写出B、D的结构简式:B___________ D____________.
(2)写出①⑤两步反应的化学方程式,并注明反应类型:
①____________反应类型___________.
⑤____________反应类型___________.
(3)戊烷的同分异构体中,在相同条件下沸点最低的是___________(写结构简式).
29.(15分)海洋资源的利用具有非常广阔的前景.
Ⅰ.从海水中提取溴的过程如下:
(1)步骤“氧化”中已获得,步骤“吸收”中又将反应为,其目的为____________.
(2)热空气吹出,利用了溴的_______________.
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)步骤“吸收”用纯碱溶液吸收,反应生成了,则该反应的化学方程式为____________.
Ⅱ.离子交换法从海带中提取碘是一种较为先进的制碘工艺,下图是使用离子交换树脂的“离子交换法”从海带中提取碘的主要流程.
已知:①
②强碱性阴离子树脂(用表示,可被其它更易被吸附的阴离子替代)对多碘离子有很强的交换吸附能力.
③步骤“交换吸附”发生的反应:.
回答下列问题:
(4)下列各步反应中,包含氧化还原反应的有:________(填序号)
A.交换吸附 B.洗脱 C.酸化 D.洗脱
(5)酸性条件下,原料被氧化时发生的反应有:
①_________;②.
依据整个生产流程分析是否可以加过量;_____________(填“是”或“否”).并说明理由:___________.
(6)实验室模拟步骤“酸化氧化”,一般选用氯水.工业上生产企业可以按照自己的实际情况,选择合适的氧化剂.若某企业在酸性条件下选择为氧化剂,反应生成一种无色气体,遇空气立即变为红棕色,则添加氧化剂与的质量比应不少于______________.
哈尔滨市名校2022-2023学年高二上学期9月开学验收考试
化学答案
一、单选题
CBBDA BBBDD CAACA BCDCC CADCA
二、填空题
26.(8分,每空2分)> ①③ ②④
27.(15分,除标记外每空2分)(1)
(2)碱石灰(1分) a(1分) (3)BD
(4)
(5)
(6)④;②;①;③
(7)无水硫酸铜(1分) 澄清石灰水(1分) 除去二氧化硫(1分)
28.(12分,除标记外每空2分)(1)
(2) 加成反应(1分)
取代反应(1分)
(3)
29.(15分,除标记外每空2分)(1)富集溴 (2)C
(3)
(4)BC
(5) 否(1分) 会将全部氧化生成,无法进行反应
(6)
化学试卷
可能用到的相对原子质量:N-14 O-16 Na-23 S-32 I-127
第Ⅰ卷
一、单选题(每小题只有一个选项符合题意,每小题2分,共50分)
1.下列说法错误的是( )
A.煤、石油、天然气是当今世界最重要的三种化石燃料
B.化学反应必伴随能量的变化
C.化学反应释放的能量一定是热能
D.有化学键断裂的变化不一定是化学变化
2.“水也是重要的反应物质”,下列物质中,不能发生水解反应的是
A.纤维素 B.葡萄糖 C.油脂 D.酶
3.下列变化中,属于吸热反应的有几个( )
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓稀释 ④碳酸氢钠和盐酸反应
⑤生石灰跟水反应生成熟石灰 ⑥高温分解 ⑦与盐酸反应
⑧与固体混合 ⑨
⑩
A.5 B.6 C.7 D.8
4.硫元素的价类二维图如图所示.下列说法错误的是( )
A.a与c、d、e都有可能反应生成b
B.d溶液久置于空气中会生成e,溶液的酸性增强
C.盐g与盐f之间也可能发生反应
D.铜与c的浓溶液共热产生的气体通入液中,无明显现象
5.标准状况下,将盛满二氧化氮的大试管倒扣在盛水的水槽中,充分吸收后,试管内溶液的物质的量浓度是( )
A. B. C. D.
6.根据实验目的,下列操作、现象及结论都正确的是( )
选项 目的 操作及现象 结论
A 检验酸性条件蔗糖的水解产物是否含有葡萄糖 向水解液中加入新制,未出现砖红色沉淀 不含葡萄糖
B 检验补铁口服液中是否含有 加入溶液无明显现象,再滴加少量氯水,溶液立即变为红色 含有
C 检验固体是否变质 溶解后,滴加硝酸酸化的硝酸钡溶液,产生白色沉淀 己变质
D 检验某溶液中是否含有 滴加稀溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝 不含
A.A B.B C.C D.D
7.下列说法正确的是( )
A.吸热反应中反应物的总能量大于生成物的总能量
B.将片用导线连接后放入氢氧化钠溶液组成原电池,为负极,为正极
C.由、空气和稀硫酸构成的燃料电池的负极反应是
D.充电电池可以无限制地反复放电、充电
8.下列不能使酸性高锰酸钾溶液褪色的是( )
A. B.聚乙烯 C.乙炔 D.
9.喷泉实验装置如图所示.应用下列各组气体和溶液,不能出现喷泉现象的是( )
气体 溶液
A 溶液
B 溶液
C 稀溶液
D 饱和溶液
A.A B.B C.C D.D
10.由粗制备纯的流程如图所示,下列说法不正确的是( )
A.X可用作木材防火剂
B.步骤Ⅱ的反应是
C.步骤Ⅱ中的稀硫酸可用替代
D.若在实验室中完成步骤Ⅲ,一般在蒸发皿中进行
11.以下关于甲烷的说法中,正确的是( )
①一氯甲烷分子具有四面体结构 ②二氯甲烷有两种同分异构体 ③甲烷与发生光照取代,取代需 ④甲烷分子中四个键,任意两个之间的类角均相等
A.②③④ B.②③ C.①④ D.①③
12.铜锌原电池如图所示,电解质溶液为硫酸铜.下列说法不正确的是( )
A.铜电极为正极,发生氧化反应 B.锌电极为负极,将逐渐被腐蚀
C.铜电极上的反应为: D.电子从锌电极经过导线流向铜电极
13.下列关于离子检验的说法中正确的是( )
A.向某溶液中加入稀盐酸,将产生的无色无味气体通入澄清石灰水中,石灰水变浑浊,则原溶液中一定含有或
B.向某溶液中加入溶液有白色沉淀产生,再加稀盐酸,沉淀不消失,则原溶液中一定有
C.向溶液中先加入溶液,再滴加溶液,溶液变红,则原溶液中含而不含
D.向某溶液中加入溶液产生白色沉淀,再加稀盐酸,沉淀不消失,则原溶液中一定有
14.一定温度下,在固定体积的密闭容器中发生下列反应:.若由降到时,需要,那么由降到时,所需反应的时间为( )
A.等于 B.等于 C.大于 D.小于
15.下列各组物质中互为同系物的是( )
A.和
B.和
C.和
D.和
16.下列各组有机物中,其一氯代物的数目不相等的是( )
A.正戊烷和正已烷 B.新戊烷和
C.甲烷和乙烷 D.丙烷和
17.以下物质间的每步转化,不能通过一步反应实现的是( )
A. B.
C. D.
18.下列有关装置的说法正确的是( )
A.装置Ⅰ中为原电池的负极 B.装置Ⅱ为一次电池
C.装置Ⅲ可构成原电池 D.装置Ⅳ工作时,电子由锌通过导线流向碳棒
19.对下列事实的解释错误的是( )
A.高纯硅可制成计算机芯片,是利用其半导体性能
B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有氧化性
D.反应能进行,说明既不溶于水也不溶于稀
20.下列关于硫酸、硝酸说法正确的是( )
A.纯锌与稀硫酸反应制氢气比粗锌慢,因为粗锌中含有比锌活泼的金属杂质
B.为增大铜与硝酸制取的反应速率,将稀硝酸改用浓硝酸
C.实验室用的硫酸与亚硫酸钠制,比用的浓硫酸速率快,因为的硫酸浓度大
D.铝片与稀硫酸反应,开始很缓慢,一段时间后反应速率加快,因为生成的有催化作用
21.穿心莲内酯具有祛热解毒,消炎止痛之功效,被誉为天然抗生素药物,结构简式如图所示.下列说法正确的是( )
A.该物质分子式为 B.该物质的官能团有2种
C.该物质与足量反应,标准状况下生成
D.该物质最多可与发生加成反应
22.下列化学用语表达正确的是( )
A.丙烯的结构简式: B.乙炔的分子式:
C.二氧化碳的空间填充模型: D.醛基的电子式:
23.设为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,含有的分子数为
B.铵根离子中含有的电子数为
C.工业制硫酸用与过量空气反应制转移电子
D.标况下乙烷中含有碳氢键的数目为
24.在一绝热(不与外界发生热交换)的恒容密闭容器中,发生反应:.下列描述中能表明反应已达到平衡状态的有( )个
①容器内温度不变 ②混合气体的密度不变 ③混合气体的压强不变
④混合气体的平均相对分子质量不变 ⑤的物质的量浓度不变
⑥容器内A、C、D三种气体的浓度之比为 ⑦某时刻且不等于零
③单位时间内生成,同时生成
A.4 B.5 C.6 D.7
25.已知反应:生成的初始速率与、的初始浓度的关系为,k为速率常数.在时测得的相关数据如表所示.
实验数据 初始浓度 生成的初始速率
1
2
3
下列说法中不正确的是( )
A.关系式中 B.时,k的值为
C.若时,初始浓度,则生成的初始速率为
D.当其他条件不变时,升高温度,速率常数将增大
Ⅱ卷
二、填空题
26.(8分)一定条件下铁可以和发生反应.一定温度下,向某密闭容器中加入足量铁粉并充入一定量的气体,反应过程中气体和气体的浓度与时间的关系如图所示:
(1)时,正、逆反应速率的大小关系为______(填“>”“<”或“=”).
(2)内,的平均反应速率__________.
(3)下列条件的改变能减慢其反应速率的是____________(填序号,下同).
①降低温度 ②减少铁粉的质量 ③保持压强不变,充入使容器的体积增大
④保持容积不变,充入使体系压强增大
(4)下列描述能说明上述反应已达平衡状态的是________.
① ②单位时间内生成的同时生成
③容器中气体压强不随时间变化而变化
④容器中气体的平均相对分子质量不随时间变化而变化
27.(15分)Ⅰ.某实验小组在实验室制备氨气并进行氨的催化氧化实验,实验装置如图1:
(1)写出上述制备氨气的化学方程式_____________.
(2)U形管中的于燥剂可用__________(填名称),收集氨气应选择安装_______.(选填“a”或“b”).
(3)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨的是__________(填序号).
A. B. C. D.
(4)如图2所示,锥形瓶中是氨气与空气的混合气体,将灼热的铂丝插入锥形瓶中,观察到出现红棕色和白雾.写出氨催化氧化的化学方程式:_________________.
Ⅱ.浓硫酸和木炭在加热时发生化学反应.用如图所示各装置设计一个实验,验证浓硫酸与木炭在加热条件下反应产生的各种产物.
(5)写出浓硫酸和木炭在加热时反应的化学方程:___________.
(6)这些装置的连接顺序(按产物气流从左到右的方向)____________→__________→_________→(填装置的序号).
(7)装置②中要检验产物中有水蒸气,则放入的药品是_________;装置③中要检验产物中有二氧化碳气体,则放入的药品是___________;实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色,B瓶溶液的作用是___________.
28.(12分)某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应.请回答下列问题:
(1)写出B、D的结构简式:B___________ D____________.
(2)写出①⑤两步反应的化学方程式,并注明反应类型:
①____________反应类型___________.
⑤____________反应类型___________.
(3)戊烷的同分异构体中,在相同条件下沸点最低的是___________(写结构简式).
29.(15分)海洋资源的利用具有非常广阔的前景.
Ⅰ.从海水中提取溴的过程如下:
(1)步骤“氧化”中已获得,步骤“吸收”中又将反应为,其目的为____________.
(2)热空气吹出,利用了溴的_______________.
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)步骤“吸收”用纯碱溶液吸收,反应生成了,则该反应的化学方程式为____________.
Ⅱ.离子交换法从海带中提取碘是一种较为先进的制碘工艺,下图是使用离子交换树脂的“离子交换法”从海带中提取碘的主要流程.
已知:①
②强碱性阴离子树脂(用表示,可被其它更易被吸附的阴离子替代)对多碘离子有很强的交换吸附能力.
③步骤“交换吸附”发生的反应:.
回答下列问题:
(4)下列各步反应中,包含氧化还原反应的有:________(填序号)
A.交换吸附 B.洗脱 C.酸化 D.洗脱
(5)酸性条件下,原料被氧化时发生的反应有:
①_________;②.
依据整个生产流程分析是否可以加过量;_____________(填“是”或“否”).并说明理由:___________.
(6)实验室模拟步骤“酸化氧化”,一般选用氯水.工业上生产企业可以按照自己的实际情况,选择合适的氧化剂.若某企业在酸性条件下选择为氧化剂,反应生成一种无色气体,遇空气立即变为红棕色,则添加氧化剂与的质量比应不少于______________.
哈尔滨市名校2022-2023学年高二上学期9月开学验收考试
化学答案
一、单选题
CBBDA BBBDD CAACA BCDCC CADCA
二、填空题
26.(8分,每空2分)> ①③ ②④
27.(15分,除标记外每空2分)(1)
(2)碱石灰(1分) a(1分) (3)BD
(4)
(5)
(6)④;②;①;③
(7)无水硫酸铜(1分) 澄清石灰水(1分) 除去二氧化硫(1分)
28.(12分,除标记外每空2分)(1)
(2) 加成反应(1分)
取代反应(1分)
(3)
29.(15分,除标记外每空2分)(1)富集溴 (2)C
(3)
(4)BC
(5) 否(1分) 会将全部氧化生成,无法进行反应
(6)
同课章节目录
