浙教版科学2022-2023学年上学期九年级“一课一练”:1.3常见的酸(2)【word,含解析】
文档属性
| 名称 | 浙教版科学2022-2023学年上学期九年级“一课一练”:1.3常见的酸(2)【word,含解析】 |  | |
| 格式 | doc | ||
| 文件大小 | 452.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
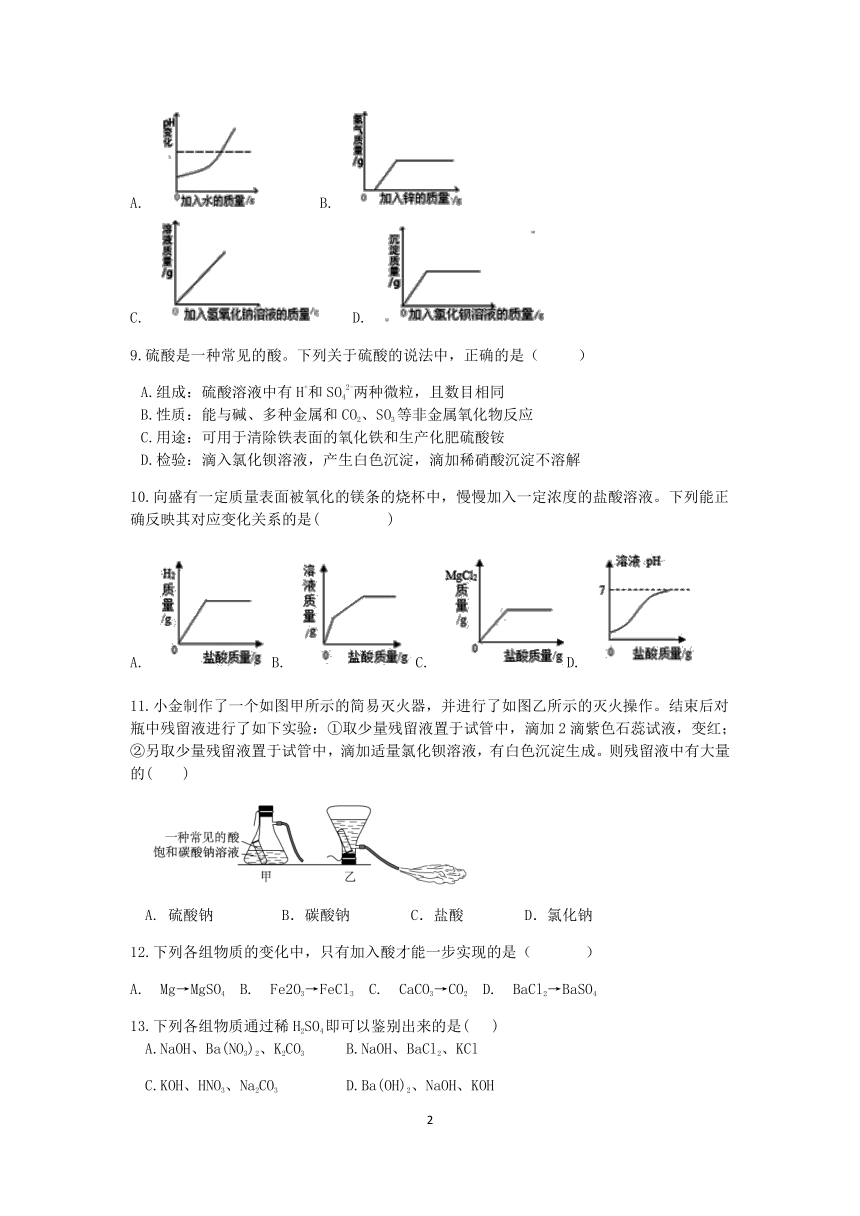
| 更新时间 | 2022-09-05 19:46:26 | ||
图片预览

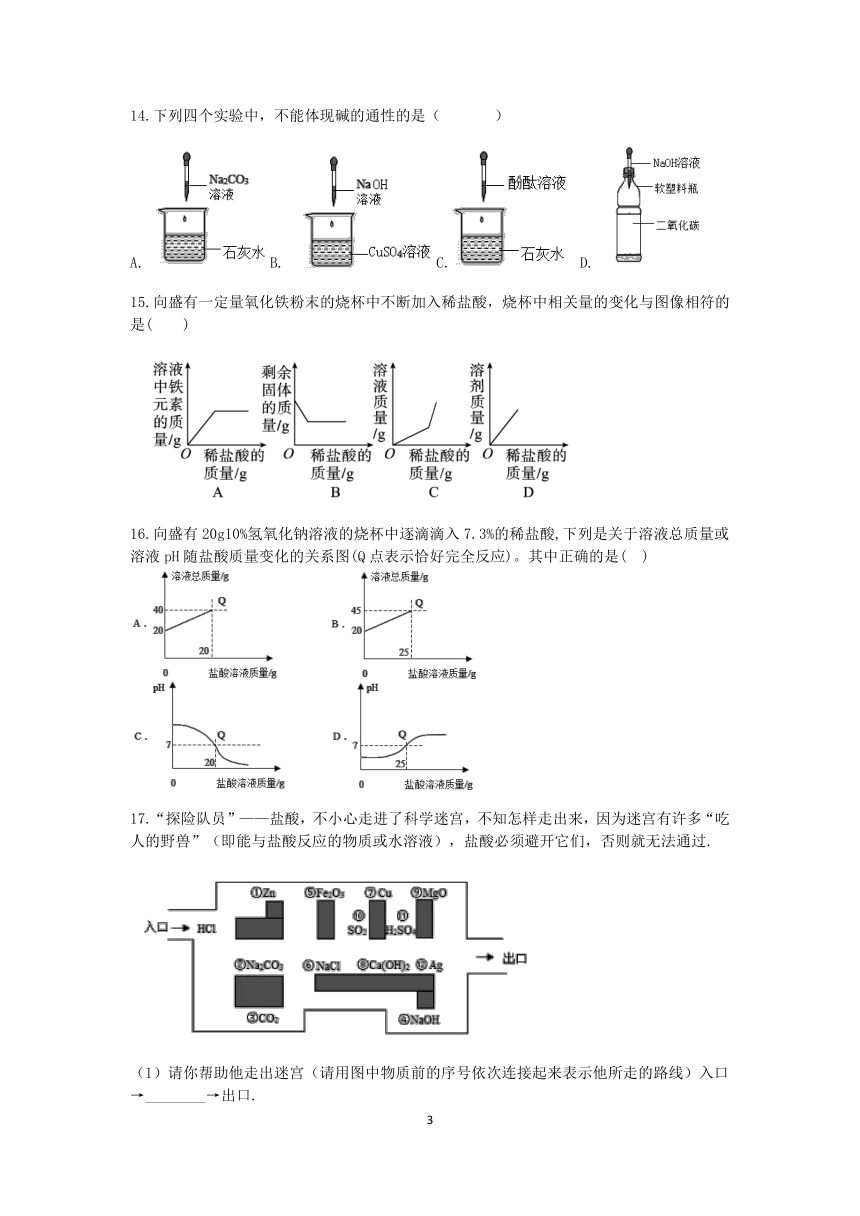

文档简介
1.为研究盐酸的化学性质,小明进行如下实验。其中能产生白色沉淀的是( )
A.B. C. D.
2.下列关于H2SO4性质描述中,不属于酸的通性的是( )
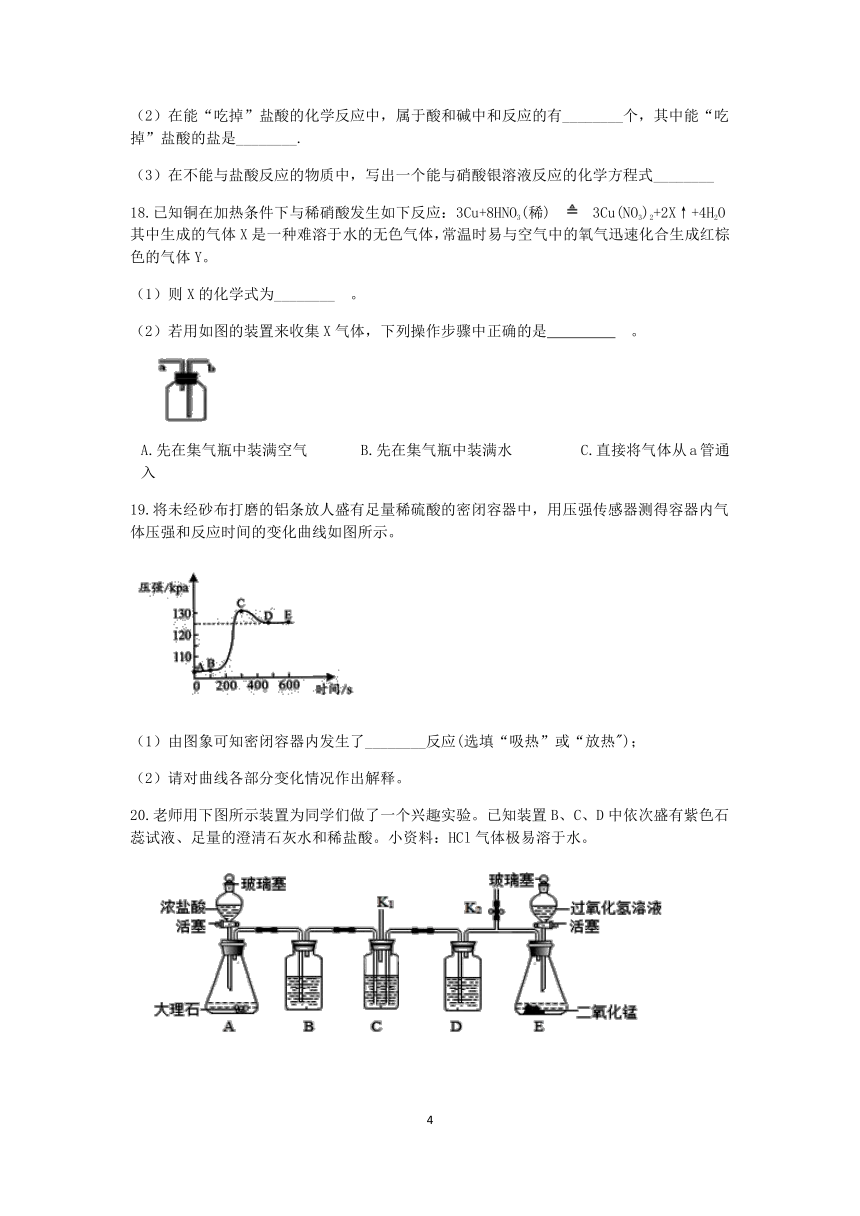
A. 使紫色石蕊溶液变红 B. 与NaOH发生中和反应
C. 浓硫酸滴到白纸上使纸变黑D. 与Mg反应放出氢气
3.将一根生锈的铁钉放入稀硫酸中,下列对发生变化的预测不正确的是( )
A.铁钉表面铁锈将会消失 B.过一段时间后铁钉表面将产生气泡
C.溶液的颜色由无色变为黄色 D.溶液的质量将会减少
4.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )
A. NaOH溶液 B. NaCl溶液C. KCl固体D. AgNO3溶液
5.在四只分别盛有稀盐酸的烧杯中,滴有石蕊溶液,现往这四只烧杯中不断加入下列物质直至过量,其中能使溶液最后呈紫色的物质是( )
A.CaCO3 B.CaO C.NaOH D.Na2SO4
6.酸具有通性是因为酸电离时生成的阳离子都是氢离子的缘故;不同的酸还具有不同的个性,是因为酸根离子不同的缘故.下列酸的性质中,不属于酸的通性的是( )
A. 酸能与锌粒反应生成气体 B. 稀硫酸能与氯化钡溶液反应生成白色沉淀
C. 醋酸能除水垢(主要成分是碳酸钙) D. 稀盐酸能除铁锈
7.稀硝酸中混有少量的盐酸,为了除去盐酸,可以加入适量的( )
A.BaCl2 B.AgNO3 C.KOH D.Fe
8.向一定量硫酸溶液中,分别加入足量的水、金属锌、氢氧化钠溶液、氯化钡溶液,图示正确的是( )
A. B.
C. D.
9.硫酸是一种常见的酸。下列关于硫酸的说法中,正确的是( )
A.组成:硫酸溶液中有H+和SO42-两种微粒,且数目相同
B.性质:能与碱、多种金属和CO2、SO3等非金属氧化物反应
C.用途:可用于清除铁表面的氧化铁和生产化肥硫酸铵
D.检验:滴入氯化钡溶液,产生白色沉淀,滴加稀硝酸沉淀不溶解
10.向盛有一定质量表面被氧化的镁条的烧杯中,慢慢加入一定浓度的盐酸溶液。下列能正确反映其对应变化关系的是( )
A. B. C. D.
11.小金制作了一个如图甲所示的简易灭火器,并进行了如图乙所示的灭火操作。结束后对瓶中残留液进行了如下实验:①取少量残留液置于试管中,滴加2滴紫色石蕊试液,变红;②另取少量残留液置于试管中,滴加适量氯化钡溶液,有白色沉淀生成。则残留液中有大量的( )
A. 硫酸钠 B.碳酸钠 C.盐酸 D.氯化钠
12.下列各组物质的变化中,只有加入酸才能一步实现的是( )
A. Mg→MgSO4 B. Fe2O3→FeCl3 C. CaCO3→CO2 D. BaCl2→BaSO4
13.下列各组物质通过稀H2SO4即可以鉴别出来的是( )
A.NaOH、Ba(NO3)2、K2CO3 B.NaOH、BaCl2、KCl
C.KOH、HNO3、Na2CO3 D.Ba(OH)2、NaOH、KOH
14.下列四个实验中,不能体现碱的通性的是( )
A.B. C.D.
15.向盛有一定量氧化铁粉末的烧杯中不断加入稀盐酸,烧杯中相关量的变化与图像相符的是( )
16.向盛有20g10%氢氧化钠溶液的烧杯中逐滴滴入7.3%的稀盐酸,下列是关于溶液总质量或溶液pH随盐酸质量变化的关系图(Q点表示恰好完全反应)。其中正确的是( )
17.“探险队员”——盐酸,不小心走进了科学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或水溶液),盐酸必须避开它们,否则就无法通过.
(1)请你帮助他走出迷宫(请用图中物质前的序号依次连接起来表示他所走的路线)入口→________→出口.
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有________个,其中能“吃掉”盐酸的盐是________.
(3)在不能与盐酸反应的物质中,写出一个能与硝酸银溶液反应的化学方程式________
18.已知铜在加热条件下与稀硝酸发生如下反应:3Cu+8HNO3(稀) 3Cu(NO3)2+2X↑+4H2O其中生成的气体X是一种难溶于水的无色气体,常温时易与空气中的氧气迅速化合生成红棕色的气体Y。
(1)则X的化学式为________ 。
(2)若用如图的装置来收集X气体,下列操作步骤中正确的是 。
A.先在集气瓶中装满空气 B.先在集气瓶中装满水 C.直接将气体从a管通入
19.将未经砂布打磨的铝条放人盛有足量稀硫酸的密闭容器中,用压强传感器测得容器内气体压强和反应时间的变化曲线如图所示。
(1)由图象可知密闭容器内发生了________反应(选填“吸热”或“放热");
(2)请对曲线各部分变化情况作出解释。
20.老师用下图所示装置为同学们做了一个兴趣实验。已知装置B、C、D中依次盛有紫色石蕊试液、足量的澄清石灰水和稀盐酸。小资料:HCl气体极易溶于水。
(1)打开A中的玻璃塞和活塞,C中反应的化学方程式为________。甲同学认为通过B中的现象能说明二氧化碳与水反应生成了碳酸,你认为他的看法是否合理,并说明原因________。
(2)一段时间后,关闭A中的活塞和玻璃塞,打开弹簧夹K2及E中的玻璃塞和活塞,待足量的过氧化氢溶液流入锥形瓶后,立即关闭E中的活塞,并用弹簧夹K2夹紧橡皮管。C中可能出现的现象是________。
21.军军化学兴趣小组的同学想通过实验制备NO气体并验证它的性质。在查阅资料后得知:①NO常温下是一种无色、有毒,难溶于水的气体,②NO常温下能与氧气迅速反应,生成红棕色的NO2气体,NO2能和水反应,3NO2+H2O=2HNO3+NO③实验室常用铜与稀硝酸反应制取NO:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑十4H2O。他们设计了以下装置图。
(1)图中A仪器的名称为________。
(2)若试管C中是空气,E为尾气吸收装置,试管D中液体是紫色石蕊溶液,则打开A中活塞后,试管C中的现象是________。试管D出现的现象是________。
(3)做完本实验后他们讨论以铜和稀硝酸为主要原料制取Cu(NO3)2时设计了两种方案:
方案一:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑十4H2O;
方案二:2Cu+O2 2CuO,CuO+2HNO3=Cu(NO3)2+H2O。
你认为以上两种方案中哪一方案更好。并说明理由。________(理由答出两点)
答案及解析
1.【答案】 A
【解析】A.AgNO3溶液与稀盐酸反应生成不溶于水的白色沉淀AgCl,故A符合题意;
B.NaOH与稀盐酸反应生成溶于水的NaCl,故B不合题意;
C.CuO与稀盐酸反应生成溶于水的CuCl2,故C不合题意;
D.Zn与稀盐酸反应生成溶于水的ZnCl2故D不合题意。故选A
2.【答案】 C
【解析】根据酸能与指示剂反应、与酸反应、与活泼金属反应,但浓硫酸的脱水性是浓硫酸的特殊性质分析。
【解答】A、硫酸呈酸性,能使紫色石蕊溶液变红 ,属于酸的通性,不符合题意;
B、酸和碱能发生中和反应,所以硫酸与氢氧化钠可发生中和反应,不符合题意;
C、 浓硫酸滴在白纸上变黑,是浓硫酸的特殊性质脱水性,不是酸的通性,符合题意;
D、酸能与活泼金属反应生成氢气,硫酸与镁能反应属于酸的通性,不符合题意;
故选C。
3.【答案】D
【解析】A、铁钉表面的铁锈是氧化铁,能与硫酸反应,故铁锈会消失,正确;
B、铁能与硫酸反应生成硫酸亚铁和氢气,故一段时间后会观察到有气泡产生,正确;
C、氧化铁与硫酸反应生成的是硫酸铁,硫酸铁的水溶液呈黄色,正确;
D、由于氧化铁溶于硫酸,导致溶液的质量增大,错误; 故选D
4.【答案】 B
【解析】化学反应的速率与反应物的浓度有关,浓度越小,反应越慢;生成物的质量由反应物的质量决定,据此分析判断即可。
【解答】要减缓盐酸和铁粉的反应速率,就要减小盐酸的浓度;要保证氢气的质量不受影响,那么加入的物质就不能与稀盐酸反应。
NaOH和AgNO3 , 都会与稀盐酸反应,从而消耗稀盐酸,使生成氢气的质量减小,故A、D错误;
KCl固体虽然不与稀盐酸反应,但是对稀盐酸的浓度没有影响,不会改变氢气的生成速率,故C错误;
NaCl不与稀盐酸反应,且会将稀盐酸稀释,减小它的浓度,减缓反应速率,故B正确。
故选B。
5.【答案】A
【解析】A、碳酸钙与盐酸反应会不断消耗盐酸生成中性物质,过量后不会对溶液酸碱性有影响,能使石蕊变成紫色,故正确.
B、氧化钙能消耗稀盐酸,但过量后氧化钙与水会生成氢氧化钙使溶液呈碱性,石蕊变蓝,故错误.
C、氢氧化钠能与盐酸发生中和反应,过量会使溶液变成碱性,石蕊变蓝,故错误.
D、硫酸钠不能与盐酸反应,溶液的性质没变,石蕊仍是红色,故错误. 故选A.
6.【答案】 B
【解析】酸的通性有:
①和指示剂发生显色反应;②和活泼金属反应;③和碱反应生成盐和水;
④和碱性氧化物反应生成盐和水;⑤和部分盐反应生成新酸和新盐。
【解答】A.与活泼金属反应生成盐和氢气,属于酸的通性,故A不合题意;
B.硫酸能够和氯化钡反应生成白色沉淀,但是其它的酸例如盐酸不能和氯化钡反应,故该项不属于酸的通性,故B符合题意;
C.酸能与盐(碳酸钙反应),该项是酸的通性,故C不合题意;
D.酸与金属氧化物反应生成盐和水,属于酸的通性,故D不合题意。
故选B。
7.【答案】B
【解析】A、加入氯化钡溶液,盐酸不能发生反应,不符合题意;
B、加入硝酸银溶液,杂质盐酸与硝酸银反应生成氯化银沉淀和硝酸,符合题意;
C、加入氢氧化钾,硝酸和盐酸都能发生反应,不符合题意;
D、加入铁,硝酸和盐酸都能发生反应,不符合题意
8.【答案】 D
【解析】(1)酸被稀释后,酸性减小,pH增大;碱被稀释后,减小减小,pH减小。但是无论怎样,二者都不会有原来的碱性变成酸性,或由酸性变成碱性。
(2)根据生成氢气的开始时间分析;
(3)分析开始时溶液质量是否为零;
(4)根据沉淀生成的情况判断。
【解答】A.硫酸溶液加水后,酸性减小,pH增大,但是绝对不会等于7,甚至大于7,故A错误;
B.金属锌加入硫酸溶液后,马上会有氢气产生,不会隔一段时间,故B错误;
C.在加入氢氧化钠溶液前,硫酸溶液的质量也不是零,故C错误;
D.随着氯化钡的加入,沉淀的质量不断增大;当硫酸完全反应后,沉淀的质量不再增大,故D正确。
故选D。
9.【答案】C
【解析】A.根据H2SO4可知,硫酸溶液中有H+和SO42-两种微粒的数目之比为2:1,故A错误;
B.硫酸能够与金属氧化物反应,不能与非金属氧化物反应,故B错误;
C.硫酸与氧化铁反应生成硫酸铁和水,可以除去铁锈;硫酸与氨水反应生成硫酸铵,故C正确;
D.白色沉淀可能是硫酸钡,也可能是氯化银,因此无法检验硫酸,故D错误。
10.【答案】 C
【解析】稀盐酸先和表面的氧化镁反应,再和里面的镁单质反应,据此分析即可。
【解答】A.稀盐酸先和表面的氧化镁反应,生成氯化镁和水,因此开始一段时间内没有氢气生成,故A错误;
B.稀盐酸先和表面的氧化镁反应,生成氯化镁和水。等氧化镁完全反应后,镁单质与稀盐酸反应生成氯化镁和氢气。由于后者有气体生成会造成溶液质量减小,所以后者溶液质量的增加速度小于前者,即图线的倾斜角度小于前者。当镁完全反应后,溶液质量的增加量再次等于加入的稀盐酸的质量,图线倾斜角度变大,肯定不是平行的,故B错误;
C.两个反应的产物都是氯化镁,因此氯化镁的质量随盐酸质量的增大而增大。当完全反应后,氯化镁的质量保持不变,故C正确;
D.在反应进行的一段时间内,由于加入稀盐酸生成氯化镁,因此溶液始终保持中性。当完全反应后,随着稀盐酸的加入,溶液的pH逐渐减小,故D错误。
故选C。
11.【答案】A
【解析】取少量残留液置于试管中,滴加2滴紫色石蕊试液,变红,由此判断残留液呈酸性;另取少量残留液置于试管中,滴加适量氯化钡溶液,有白色沉淀生成,证明含有硫酸根离子,所以残留液中含有硫酸和硫酸钠。
12.【答案】 B
【解析】根据酸的化学性质分析判断。
【解答】A.镁和硫酸铜反应,生成硫酸镁和铜单质,故A不合题意;
B.氧化铁只能与稀盐酸反应,才能一步生成氯化铁和水,故B符合题意;
C.碳酸钙高温分解,生成二氧化碳和氧化钙,故C不合题意;
D.氯化钡和硫酸钠反应,生成硫酸钡沉淀和氯化钠,故D不合题意。
故选B。
13.【答案】A
【解析】稀硫酸与氢氧化钠反应没有现象,与硝酸钡反应产生白色沉淀,与碳酸钾反应有气泡产生。故选A。
14.【答案】 A
【解析】碱的通性包括: ①碱使指示剂变色;
②碱 + 酸 = 盐 + 水 ③碱 + 某些非金属氧化物= 盐 + 水 ④碱 + 某些盐 = 新碱 + 新盐
【解答】A.氢氧化钙和碳酸钠反应生成白色沉淀碳酸钙,就钙离子和碳酸根离子的结合,碱的共性是氢氧根离子显示的性质,故A错误,符合题意;
B.2NaOH+CuSO4=Na2SO4+Cu(OH)2↓,体现碱的通性:碱 + 某些盐 = 新碱 + 新盐 ,故B不合题意;
C.石灰水(Ca(OH)2)能使无色的酚酞试液变红色,体现碱的通性:碱使指示剂变色,故C不合题意;
D.NaOH+CO2=Na2CO3+H2O,体现碱的通性:碱 + 某些非金属氧化物= 盐 + 水,故D不合题意。
故选:A
15.【答案】A
【解析】氧化铁和盐酸反应生成氯化铁和水,所以溶液中铁元素的质量从零开始逐渐增加,增加到一定值后不再变化;随着稀盐酸的加入,固体质量会逐渐减小到零;反应生成氯化铁和水,且氯化铁能溶于水,所以溶液质量随稀盐酸质量的变化曲线应先陡后缓;溶剂的质量开始增加的多,完全反应后,溶剂的质量增加的少。
16.【答案】B
【解析】A、设与20g10%氢氧化钠溶液恰好反应时,消耗7.3%的稀盐酸的质量为x,20g10%氢氧化钠溶液中所含氢氧化钠的质量是:20gx10%=2g.
NaOH + HC1 = NaCl + H2O
40 36.5
2g xx7.3%
解得x=25g,因此Q点对应的横坐标应该是25,选项A错误;
B、与20g10%氢 氧化钠溶液恰好反应时,消耗7.3%的稀盐酸的质量为25g,溶液总质量为45g,选项B正确;
C、Q点对应的横坐标应该是25,选项C错误;
D、该反应是将稀盐酸滴入氢氧化钠溶液中,图像的起点位置从大于7开始逐渐减小,当稀盐酸过量时,溶液的pH<7,选项D错误。故选B.
17.【答案】 (1)③⑥⑩⑦ (2)2;碳酸钠(3)NaCl+AgNO3=AgCl↓+NaNO3
【解析】盐酸是氢氯酸的俗称,是氯化氢(HCl)气体的水溶液,为无色透明的一元强酸。盐酸具有极强的挥发性,因此打开盛有浓盐酸的容器后能在其上方看到白雾,实际为氯化氢挥发后与空气中的水蒸气结合产生的盐酸小液滴。
【解答】(1)解决该题应该找出一条不能和盐酸发生反应的物质构成的路路线。酸的化学性质有:能够和酸碱指示剂变色,能够和活泼金属反应,能够和金属氧化物反应,能够和碱反应,能够和某些盐反应。活泼金属即在金属活动性顺序表中氢前的金属,酸和金属氧化物、碱、盐发生的反应是复分解反应,因此必须有水、沉淀或气体生成。利用图示的物质对相关的与盐酸不能反应的物质作出判断即可,由于盐酸不能和二氧化碳、二氧化硫、硫酸、氯气反应,故答案为:③→⑥→⑩→⑦→ → 。
(2) 中和反应是酸与碱反应,根据碱的种类确定中和反应的个数,碱有2种所以中和反应有2个;能与盐酸反应的盐只有碳酸钠。
(3) 不能与盐酸反应的物质有:③⑥⑩ ,氯化钠与硝酸银反应的反应物是氯化钠、硝酸银,生成物是氯化银沉淀和硝酸钠,在氯化银后面标上沉淀符号,所以方程式是:NaCl+AgNO3═AgCl↓+NaNO3, 是两种化合物相互交换成分生成两种新的化合物的反应类型,属于复分解反应。
故答案为:(1)③⑥⑩⑦ (2)2;碳酸钠(3)NaCl+AgNO3═AgCl↓+NaNO3
18.【答案】(1)NO(2)B
【解析】(1)根据质量守恒定律可知,反应前后原子的种类和个数保持不变,据此推算X的化学式;
(2)根据气体X的性质选择合适的收集方法。
【解答】(1)根据方程式 3Cu+8HNO3(稀) 3Cu(NO3)2+2X↑+4H2O ,根据质量守恒定律得到:3Cu+8H+8N+24O=3Cu+6N+22O+8H+2X,那么2X=2N+2O,即X=NO;
(2)因为气体X难溶于水,且与氧气接触会迅速生成气体Y,所以肯定不能用排空气法收集,应该使用排水法收集,即在集气瓶中先装满水,故选B
19.【答案】(1)放热
(2)AB段:氧化铝和稀硫酸反应无气体生成,气压变化不大;
BC段:铝和稀硫酸反应生成了氢气,放热导致气体膨胀,气压增大
CD段:完全反应后温度下降,气压减小;
DE段:反应停止,温度不变,气压不变
【解析】(1)在封闭容器中,物质放热,温度升高,气压增大;物质吸热,温度降低,气压减小,据此分析;
(2)未经打磨的铝条表面有氧化铝薄膜,加入稀硫酸中后,氧化铝先与稀硫酸反应,生成硫酸铝和水,这段时间没有气体生成。然后金属铝与稀硫酸反应,生成硫酸铝和氢气,并放出热量,这段时间内气压增大。当反应完全结束后,不再有热量产生,因此温度下降,气压减小。当温度到达室温时,温度保持不变,气压不变,据此分析解答。
【解答】(1)根据图像可知,封闭容器内气压增大,过段时间后气压减小,那么温度应该影响里面的气压变化,即开始时容器内发生放热反应。
(2)AB段:氧化铝和稀硫酸反应无气体生成,气压变化不大;
BC段:铝和稀硫酸反应生成了氢气,放热导致气体膨胀,气压增大;
CD段:完全反应后温度下降,气压减小;
DE段:反应停止,温度不变,气压不变。
20.【答案】(1)Ca(OH)2+CO2=CaCO3↓+H2O;不合理,浓盐酸有挥发性,使产生的二氧化碳中含有大量氯化氢气体
(2)澄清石灰水又变澄清,且有气泡产生
【解析】(1)在装置C中,反应生成的二氧化碳和氢氧化钙反应生成碳酸钙白色沉淀和水,据此写出反应的方程式。紫色石蕊试液变成红色,说明B中有酸性物质生成;不但二氧化碳和水能够形成碳酸,浓盐酸挥发出的HCl气体溶于水也会形成稀盐酸,据此分析判断;
(2)E中的过氧化氢溶液在二氧化锰的催化作用下分解,生成氧气和水,从而使D装置内气压增大,将其中的稀盐酸压入装置C。于是稀盐酸与碳酸钙反应,生成了氯化钙、水和二氧化碳气体,据此描述C中的实验现象。
【解答】(1)打开A中的玻璃塞和活塞,C中反应的化学方程式为: Ca(OH)2+CO2=CaCO3↓+H2O 。甲同学认为通过B中的现象能说明二氧化碳与水反应生成了碳酸,我认为他的看法是不合理,原因是:浓盐酸有挥发性,使产生的二氧化碳中含有大量氯化氢气体。
(2)C中可能出现的现象是:澄清石灰水又变澄清,且有气泡产生。
21.【答案】(1)分液漏斗(2)出现红棕色气体;紫色石蕊溶液变红
(3)方案二,因为方案二中没有有害气体产生,原料(硝酸)的利用率高
【解析】(1)根据所指仪器的名称解答;
(2)装置A中的稀硝酸和B中的金属铜反应生成一氧化氮,一氧化氮与C中的氧气反应生成红棕色的二氧化氮气体;二氧化氮在D中与水生成稀硝酸,使紫色石蕊试液变红;
(3)可从反应产物是否有害以及原料的利用率等角度思考解答。
【解答】(1)图中A仪器的名称为分液漏斗。
(2)若试管C中是空气,E为尾气吸收装置,试管D中液体是紫色石蕊溶液,则打开A中活塞后,试管C中的现象是出现红棕色气体。试管D出现的现象是紫色石蕊溶液变红。
(3)我认为方案二更好一些,理由是:方案二中没有有害气体产生,原料(硝酸)的利用率高。
1.3常见的酸(2)
A.B. C. D.
2.下列关于H2SO4性质描述中,不属于酸的通性的是( )
A. 使紫色石蕊溶液变红 B. 与NaOH发生中和反应
C. 浓硫酸滴到白纸上使纸变黑D. 与Mg反应放出氢气
3.将一根生锈的铁钉放入稀硫酸中,下列对发生变化的预测不正确的是( )
A.铁钉表面铁锈将会消失 B.过一段时间后铁钉表面将产生气泡
C.溶液的颜色由无色变为黄色 D.溶液的质量将会减少
4.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )
A. NaOH溶液 B. NaCl溶液C. KCl固体D. AgNO3溶液
5.在四只分别盛有稀盐酸的烧杯中,滴有石蕊溶液,现往这四只烧杯中不断加入下列物质直至过量,其中能使溶液最后呈紫色的物质是( )
A.CaCO3 B.CaO C.NaOH D.Na2SO4
6.酸具有通性是因为酸电离时生成的阳离子都是氢离子的缘故;不同的酸还具有不同的个性,是因为酸根离子不同的缘故.下列酸的性质中,不属于酸的通性的是( )
A. 酸能与锌粒反应生成气体 B. 稀硫酸能与氯化钡溶液反应生成白色沉淀
C. 醋酸能除水垢(主要成分是碳酸钙) D. 稀盐酸能除铁锈
7.稀硝酸中混有少量的盐酸,为了除去盐酸,可以加入适量的( )
A.BaCl2 B.AgNO3 C.KOH D.Fe
8.向一定量硫酸溶液中,分别加入足量的水、金属锌、氢氧化钠溶液、氯化钡溶液,图示正确的是( )
A. B.
C. D.
9.硫酸是一种常见的酸。下列关于硫酸的说法中,正确的是( )
A.组成:硫酸溶液中有H+和SO42-两种微粒,且数目相同
B.性质:能与碱、多种金属和CO2、SO3等非金属氧化物反应
C.用途:可用于清除铁表面的氧化铁和生产化肥硫酸铵
D.检验:滴入氯化钡溶液,产生白色沉淀,滴加稀硝酸沉淀不溶解
10.向盛有一定质量表面被氧化的镁条的烧杯中,慢慢加入一定浓度的盐酸溶液。下列能正确反映其对应变化关系的是( )
A. B. C. D.
11.小金制作了一个如图甲所示的简易灭火器,并进行了如图乙所示的灭火操作。结束后对瓶中残留液进行了如下实验:①取少量残留液置于试管中,滴加2滴紫色石蕊试液,变红;②另取少量残留液置于试管中,滴加适量氯化钡溶液,有白色沉淀生成。则残留液中有大量的( )
A. 硫酸钠 B.碳酸钠 C.盐酸 D.氯化钠
12.下列各组物质的变化中,只有加入酸才能一步实现的是( )
A. Mg→MgSO4 B. Fe2O3→FeCl3 C. CaCO3→CO2 D. BaCl2→BaSO4
13.下列各组物质通过稀H2SO4即可以鉴别出来的是( )
A.NaOH、Ba(NO3)2、K2CO3 B.NaOH、BaCl2、KCl
C.KOH、HNO3、Na2CO3 D.Ba(OH)2、NaOH、KOH
14.下列四个实验中,不能体现碱的通性的是( )
A.B. C.D.
15.向盛有一定量氧化铁粉末的烧杯中不断加入稀盐酸,烧杯中相关量的变化与图像相符的是( )
16.向盛有20g10%氢氧化钠溶液的烧杯中逐滴滴入7.3%的稀盐酸,下列是关于溶液总质量或溶液pH随盐酸质量变化的关系图(Q点表示恰好完全反应)。其中正确的是( )
17.“探险队员”——盐酸,不小心走进了科学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或水溶液),盐酸必须避开它们,否则就无法通过.
(1)请你帮助他走出迷宫(请用图中物质前的序号依次连接起来表示他所走的路线)入口→________→出口.
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有________个,其中能“吃掉”盐酸的盐是________.
(3)在不能与盐酸反应的物质中,写出一个能与硝酸银溶液反应的化学方程式________
18.已知铜在加热条件下与稀硝酸发生如下反应:3Cu+8HNO3(稀) 3Cu(NO3)2+2X↑+4H2O其中生成的气体X是一种难溶于水的无色气体,常温时易与空气中的氧气迅速化合生成红棕色的气体Y。
(1)则X的化学式为________ 。
(2)若用如图的装置来收集X气体,下列操作步骤中正确的是 。
A.先在集气瓶中装满空气 B.先在集气瓶中装满水 C.直接将气体从a管通入
19.将未经砂布打磨的铝条放人盛有足量稀硫酸的密闭容器中,用压强传感器测得容器内气体压强和反应时间的变化曲线如图所示。
(1)由图象可知密闭容器内发生了________反应(选填“吸热”或“放热");
(2)请对曲线各部分变化情况作出解释。
20.老师用下图所示装置为同学们做了一个兴趣实验。已知装置B、C、D中依次盛有紫色石蕊试液、足量的澄清石灰水和稀盐酸。小资料:HCl气体极易溶于水。
(1)打开A中的玻璃塞和活塞,C中反应的化学方程式为________。甲同学认为通过B中的现象能说明二氧化碳与水反应生成了碳酸,你认为他的看法是否合理,并说明原因________。
(2)一段时间后,关闭A中的活塞和玻璃塞,打开弹簧夹K2及E中的玻璃塞和活塞,待足量的过氧化氢溶液流入锥形瓶后,立即关闭E中的活塞,并用弹簧夹K2夹紧橡皮管。C中可能出现的现象是________。
21.军军化学兴趣小组的同学想通过实验制备NO气体并验证它的性质。在查阅资料后得知:①NO常温下是一种无色、有毒,难溶于水的气体,②NO常温下能与氧气迅速反应,生成红棕色的NO2气体,NO2能和水反应,3NO2+H2O=2HNO3+NO③实验室常用铜与稀硝酸反应制取NO:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑十4H2O。他们设计了以下装置图。
(1)图中A仪器的名称为________。
(2)若试管C中是空气,E为尾气吸收装置,试管D中液体是紫色石蕊溶液,则打开A中活塞后,试管C中的现象是________。试管D出现的现象是________。
(3)做完本实验后他们讨论以铜和稀硝酸为主要原料制取Cu(NO3)2时设计了两种方案:
方案一:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑十4H2O;
方案二:2Cu+O2 2CuO,CuO+2HNO3=Cu(NO3)2+H2O。
你认为以上两种方案中哪一方案更好。并说明理由。________(理由答出两点)
答案及解析
1.【答案】 A
【解析】A.AgNO3溶液与稀盐酸反应生成不溶于水的白色沉淀AgCl,故A符合题意;
B.NaOH与稀盐酸反应生成溶于水的NaCl,故B不合题意;
C.CuO与稀盐酸反应生成溶于水的CuCl2,故C不合题意;
D.Zn与稀盐酸反应生成溶于水的ZnCl2故D不合题意。故选A
2.【答案】 C
【解析】根据酸能与指示剂反应、与酸反应、与活泼金属反应,但浓硫酸的脱水性是浓硫酸的特殊性质分析。
【解答】A、硫酸呈酸性,能使紫色石蕊溶液变红 ,属于酸的通性,不符合题意;
B、酸和碱能发生中和反应,所以硫酸与氢氧化钠可发生中和反应,不符合题意;
C、 浓硫酸滴在白纸上变黑,是浓硫酸的特殊性质脱水性,不是酸的通性,符合题意;
D、酸能与活泼金属反应生成氢气,硫酸与镁能反应属于酸的通性,不符合题意;
故选C。
3.【答案】D
【解析】A、铁钉表面的铁锈是氧化铁,能与硫酸反应,故铁锈会消失,正确;
B、铁能与硫酸反应生成硫酸亚铁和氢气,故一段时间后会观察到有气泡产生,正确;
C、氧化铁与硫酸反应生成的是硫酸铁,硫酸铁的水溶液呈黄色,正确;
D、由于氧化铁溶于硫酸,导致溶液的质量增大,错误; 故选D
4.【答案】 B
【解析】化学反应的速率与反应物的浓度有关,浓度越小,反应越慢;生成物的质量由反应物的质量决定,据此分析判断即可。
【解答】要减缓盐酸和铁粉的反应速率,就要减小盐酸的浓度;要保证氢气的质量不受影响,那么加入的物质就不能与稀盐酸反应。
NaOH和AgNO3 , 都会与稀盐酸反应,从而消耗稀盐酸,使生成氢气的质量减小,故A、D错误;
KCl固体虽然不与稀盐酸反应,但是对稀盐酸的浓度没有影响,不会改变氢气的生成速率,故C错误;
NaCl不与稀盐酸反应,且会将稀盐酸稀释,减小它的浓度,减缓反应速率,故B正确。
故选B。
5.【答案】A
【解析】A、碳酸钙与盐酸反应会不断消耗盐酸生成中性物质,过量后不会对溶液酸碱性有影响,能使石蕊变成紫色,故正确.
B、氧化钙能消耗稀盐酸,但过量后氧化钙与水会生成氢氧化钙使溶液呈碱性,石蕊变蓝,故错误.
C、氢氧化钠能与盐酸发生中和反应,过量会使溶液变成碱性,石蕊变蓝,故错误.
D、硫酸钠不能与盐酸反应,溶液的性质没变,石蕊仍是红色,故错误. 故选A.
6.【答案】 B
【解析】酸的通性有:
①和指示剂发生显色反应;②和活泼金属反应;③和碱反应生成盐和水;
④和碱性氧化物反应生成盐和水;⑤和部分盐反应生成新酸和新盐。
【解答】A.与活泼金属反应生成盐和氢气,属于酸的通性,故A不合题意;
B.硫酸能够和氯化钡反应生成白色沉淀,但是其它的酸例如盐酸不能和氯化钡反应,故该项不属于酸的通性,故B符合题意;
C.酸能与盐(碳酸钙反应),该项是酸的通性,故C不合题意;
D.酸与金属氧化物反应生成盐和水,属于酸的通性,故D不合题意。
故选B。
7.【答案】B
【解析】A、加入氯化钡溶液,盐酸不能发生反应,不符合题意;
B、加入硝酸银溶液,杂质盐酸与硝酸银反应生成氯化银沉淀和硝酸,符合题意;
C、加入氢氧化钾,硝酸和盐酸都能发生反应,不符合题意;
D、加入铁,硝酸和盐酸都能发生反应,不符合题意
8.【答案】 D
【解析】(1)酸被稀释后,酸性减小,pH增大;碱被稀释后,减小减小,pH减小。但是无论怎样,二者都不会有原来的碱性变成酸性,或由酸性变成碱性。
(2)根据生成氢气的开始时间分析;
(3)分析开始时溶液质量是否为零;
(4)根据沉淀生成的情况判断。
【解答】A.硫酸溶液加水后,酸性减小,pH增大,但是绝对不会等于7,甚至大于7,故A错误;
B.金属锌加入硫酸溶液后,马上会有氢气产生,不会隔一段时间,故B错误;
C.在加入氢氧化钠溶液前,硫酸溶液的质量也不是零,故C错误;
D.随着氯化钡的加入,沉淀的质量不断增大;当硫酸完全反应后,沉淀的质量不再增大,故D正确。
故选D。
9.【答案】C
【解析】A.根据H2SO4可知,硫酸溶液中有H+和SO42-两种微粒的数目之比为2:1,故A错误;
B.硫酸能够与金属氧化物反应,不能与非金属氧化物反应,故B错误;
C.硫酸与氧化铁反应生成硫酸铁和水,可以除去铁锈;硫酸与氨水反应生成硫酸铵,故C正确;
D.白色沉淀可能是硫酸钡,也可能是氯化银,因此无法检验硫酸,故D错误。
10.【答案】 C
【解析】稀盐酸先和表面的氧化镁反应,再和里面的镁单质反应,据此分析即可。
【解答】A.稀盐酸先和表面的氧化镁反应,生成氯化镁和水,因此开始一段时间内没有氢气生成,故A错误;
B.稀盐酸先和表面的氧化镁反应,生成氯化镁和水。等氧化镁完全反应后,镁单质与稀盐酸反应生成氯化镁和氢气。由于后者有气体生成会造成溶液质量减小,所以后者溶液质量的增加速度小于前者,即图线的倾斜角度小于前者。当镁完全反应后,溶液质量的增加量再次等于加入的稀盐酸的质量,图线倾斜角度变大,肯定不是平行的,故B错误;
C.两个反应的产物都是氯化镁,因此氯化镁的质量随盐酸质量的增大而增大。当完全反应后,氯化镁的质量保持不变,故C正确;
D.在反应进行的一段时间内,由于加入稀盐酸生成氯化镁,因此溶液始终保持中性。当完全反应后,随着稀盐酸的加入,溶液的pH逐渐减小,故D错误。
故选C。
11.【答案】A
【解析】取少量残留液置于试管中,滴加2滴紫色石蕊试液,变红,由此判断残留液呈酸性;另取少量残留液置于试管中,滴加适量氯化钡溶液,有白色沉淀生成,证明含有硫酸根离子,所以残留液中含有硫酸和硫酸钠。
12.【答案】 B
【解析】根据酸的化学性质分析判断。
【解答】A.镁和硫酸铜反应,生成硫酸镁和铜单质,故A不合题意;
B.氧化铁只能与稀盐酸反应,才能一步生成氯化铁和水,故B符合题意;
C.碳酸钙高温分解,生成二氧化碳和氧化钙,故C不合题意;
D.氯化钡和硫酸钠反应,生成硫酸钡沉淀和氯化钠,故D不合题意。
故选B。
13.【答案】A
【解析】稀硫酸与氢氧化钠反应没有现象,与硝酸钡反应产生白色沉淀,与碳酸钾反应有气泡产生。故选A。
14.【答案】 A
【解析】碱的通性包括: ①碱使指示剂变色;
②碱 + 酸 = 盐 + 水 ③碱 + 某些非金属氧化物= 盐 + 水 ④碱 + 某些盐 = 新碱 + 新盐
【解答】A.氢氧化钙和碳酸钠反应生成白色沉淀碳酸钙,就钙离子和碳酸根离子的结合,碱的共性是氢氧根离子显示的性质,故A错误,符合题意;
B.2NaOH+CuSO4=Na2SO4+Cu(OH)2↓,体现碱的通性:碱 + 某些盐 = 新碱 + 新盐 ,故B不合题意;
C.石灰水(Ca(OH)2)能使无色的酚酞试液变红色,体现碱的通性:碱使指示剂变色,故C不合题意;
D.NaOH+CO2=Na2CO3+H2O,体现碱的通性:碱 + 某些非金属氧化物= 盐 + 水,故D不合题意。
故选:A
15.【答案】A
【解析】氧化铁和盐酸反应生成氯化铁和水,所以溶液中铁元素的质量从零开始逐渐增加,增加到一定值后不再变化;随着稀盐酸的加入,固体质量会逐渐减小到零;反应生成氯化铁和水,且氯化铁能溶于水,所以溶液质量随稀盐酸质量的变化曲线应先陡后缓;溶剂的质量开始增加的多,完全反应后,溶剂的质量增加的少。
16.【答案】B
【解析】A、设与20g10%氢氧化钠溶液恰好反应时,消耗7.3%的稀盐酸的质量为x,20g10%氢氧化钠溶液中所含氢氧化钠的质量是:20gx10%=2g.
NaOH + HC1 = NaCl + H2O
40 36.5
2g xx7.3%
解得x=25g,因此Q点对应的横坐标应该是25,选项A错误;
B、与20g10%氢 氧化钠溶液恰好反应时,消耗7.3%的稀盐酸的质量为25g,溶液总质量为45g,选项B正确;
C、Q点对应的横坐标应该是25,选项C错误;
D、该反应是将稀盐酸滴入氢氧化钠溶液中,图像的起点位置从大于7开始逐渐减小,当稀盐酸过量时,溶液的pH<7,选项D错误。故选B.
17.【答案】 (1)③⑥⑩⑦ (2)2;碳酸钠(3)NaCl+AgNO3=AgCl↓+NaNO3
【解析】盐酸是氢氯酸的俗称,是氯化氢(HCl)气体的水溶液,为无色透明的一元强酸。盐酸具有极强的挥发性,因此打开盛有浓盐酸的容器后能在其上方看到白雾,实际为氯化氢挥发后与空气中的水蒸气结合产生的盐酸小液滴。
【解答】(1)解决该题应该找出一条不能和盐酸发生反应的物质构成的路路线。酸的化学性质有:能够和酸碱指示剂变色,能够和活泼金属反应,能够和金属氧化物反应,能够和碱反应,能够和某些盐反应。活泼金属即在金属活动性顺序表中氢前的金属,酸和金属氧化物、碱、盐发生的反应是复分解反应,因此必须有水、沉淀或气体生成。利用图示的物质对相关的与盐酸不能反应的物质作出判断即可,由于盐酸不能和二氧化碳、二氧化硫、硫酸、氯气反应,故答案为:③→⑥→⑩→⑦→ → 。
(2) 中和反应是酸与碱反应,根据碱的种类确定中和反应的个数,碱有2种所以中和反应有2个;能与盐酸反应的盐只有碳酸钠。
(3) 不能与盐酸反应的物质有:③⑥⑩ ,氯化钠与硝酸银反应的反应物是氯化钠、硝酸银,生成物是氯化银沉淀和硝酸钠,在氯化银后面标上沉淀符号,所以方程式是:NaCl+AgNO3═AgCl↓+NaNO3, 是两种化合物相互交换成分生成两种新的化合物的反应类型,属于复分解反应。
故答案为:(1)③⑥⑩⑦ (2)2;碳酸钠(3)NaCl+AgNO3═AgCl↓+NaNO3
18.【答案】(1)NO(2)B
【解析】(1)根据质量守恒定律可知,反应前后原子的种类和个数保持不变,据此推算X的化学式;
(2)根据气体X的性质选择合适的收集方法。
【解答】(1)根据方程式 3Cu+8HNO3(稀) 3Cu(NO3)2+2X↑+4H2O ,根据质量守恒定律得到:3Cu+8H+8N+24O=3Cu+6N+22O+8H+2X,那么2X=2N+2O,即X=NO;
(2)因为气体X难溶于水,且与氧气接触会迅速生成气体Y,所以肯定不能用排空气法收集,应该使用排水法收集,即在集气瓶中先装满水,故选B
19.【答案】(1)放热
(2)AB段:氧化铝和稀硫酸反应无气体生成,气压变化不大;
BC段:铝和稀硫酸反应生成了氢气,放热导致气体膨胀,气压增大
CD段:完全反应后温度下降,气压减小;
DE段:反应停止,温度不变,气压不变
【解析】(1)在封闭容器中,物质放热,温度升高,气压增大;物质吸热,温度降低,气压减小,据此分析;
(2)未经打磨的铝条表面有氧化铝薄膜,加入稀硫酸中后,氧化铝先与稀硫酸反应,生成硫酸铝和水,这段时间没有气体生成。然后金属铝与稀硫酸反应,生成硫酸铝和氢气,并放出热量,这段时间内气压增大。当反应完全结束后,不再有热量产生,因此温度下降,气压减小。当温度到达室温时,温度保持不变,气压不变,据此分析解答。
【解答】(1)根据图像可知,封闭容器内气压增大,过段时间后气压减小,那么温度应该影响里面的气压变化,即开始时容器内发生放热反应。
(2)AB段:氧化铝和稀硫酸反应无气体生成,气压变化不大;
BC段:铝和稀硫酸反应生成了氢气,放热导致气体膨胀,气压增大;
CD段:完全反应后温度下降,气压减小;
DE段:反应停止,温度不变,气压不变。
20.【答案】(1)Ca(OH)2+CO2=CaCO3↓+H2O;不合理,浓盐酸有挥发性,使产生的二氧化碳中含有大量氯化氢气体
(2)澄清石灰水又变澄清,且有气泡产生
【解析】(1)在装置C中,反应生成的二氧化碳和氢氧化钙反应生成碳酸钙白色沉淀和水,据此写出反应的方程式。紫色石蕊试液变成红色,说明B中有酸性物质生成;不但二氧化碳和水能够形成碳酸,浓盐酸挥发出的HCl气体溶于水也会形成稀盐酸,据此分析判断;
(2)E中的过氧化氢溶液在二氧化锰的催化作用下分解,生成氧气和水,从而使D装置内气压增大,将其中的稀盐酸压入装置C。于是稀盐酸与碳酸钙反应,生成了氯化钙、水和二氧化碳气体,据此描述C中的实验现象。
【解答】(1)打开A中的玻璃塞和活塞,C中反应的化学方程式为: Ca(OH)2+CO2=CaCO3↓+H2O 。甲同学认为通过B中的现象能说明二氧化碳与水反应生成了碳酸,我认为他的看法是不合理,原因是:浓盐酸有挥发性,使产生的二氧化碳中含有大量氯化氢气体。
(2)C中可能出现的现象是:澄清石灰水又变澄清,且有气泡产生。
21.【答案】(1)分液漏斗(2)出现红棕色气体;紫色石蕊溶液变红
(3)方案二,因为方案二中没有有害气体产生,原料(硝酸)的利用率高
【解析】(1)根据所指仪器的名称解答;
(2)装置A中的稀硝酸和B中的金属铜反应生成一氧化氮,一氧化氮与C中的氧气反应生成红棕色的二氧化氮气体;二氧化氮在D中与水生成稀硝酸,使紫色石蕊试液变红;
(3)可从反应产物是否有害以及原料的利用率等角度思考解答。
【解答】(1)图中A仪器的名称为分液漏斗。
(2)若试管C中是空气,E为尾气吸收装置,试管D中液体是紫色石蕊溶液,则打开A中活塞后,试管C中的现象是出现红棕色气体。试管D出现的现象是紫色石蕊溶液变红。
(3)我认为方案二更好一些,理由是:方案二中没有有害气体产生,原料(硝酸)的利用率高。
1.3常见的酸(2)
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
