化学人教版2019必修第一册1.2.3 离子反应的应用(共27张ppt)
文档属性
| 名称 | 化学人教版2019必修第一册1.2.3 离子反应的应用(共27张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-06 15:15:26 | ||
图片预览




文档简介
(共27张PPT)
新人教版 化学 必修一
第一章 物质的分类及其变化
第二节 离子反应
第3课时:离子反应的应用
离子反应的应用
01
离子共存
02
离子反应的应用
物质的提纯
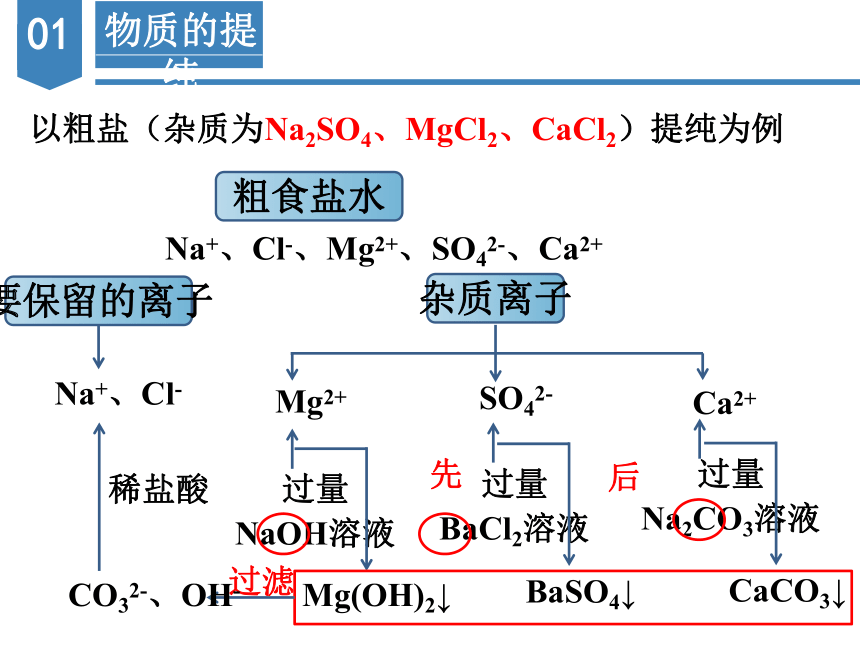
以粗盐(杂质为Na2SO4、MgCl2、CaCl2)提纯为例
粗食盐水
Na+、Cl-、Mg2+、SO42-、Ca2+
要保留的离子
杂质离子
Na+、Cl-
Mg2+
SO42-
Ca2+
过量
NaOH溶液
过量
BaCl2溶液
过量
Na2CO3溶液
Mg(OH)2↓
BaSO4↓
CaCO3↓
过滤
CO32-、OH-
先
后
稀盐酸
物质的提纯
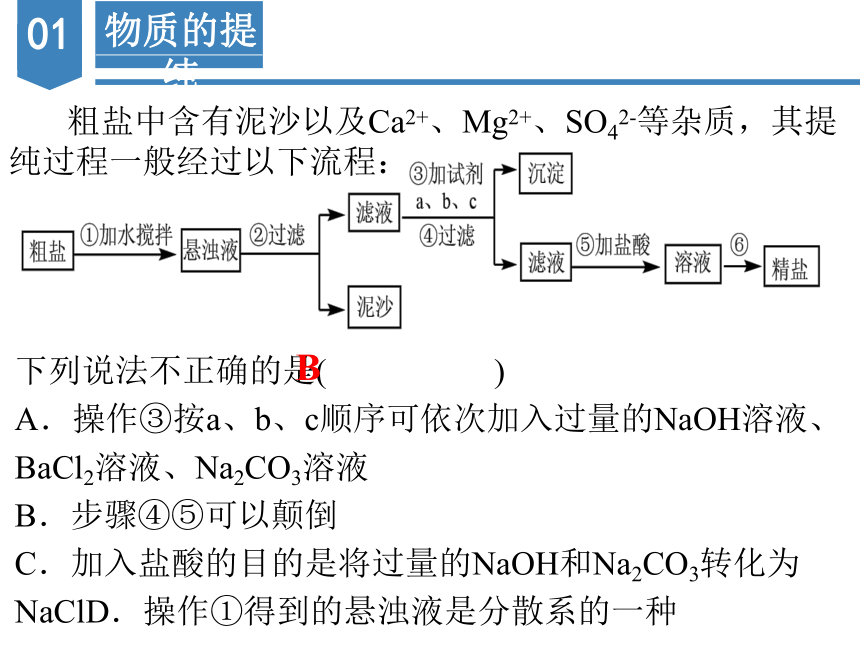
粗盐中含有泥沙以及Ca2+、Mg2+、SO42-等杂质,其提纯过程一般经过以下流程:
下列说法不正确的是( )
A.操作③按a、b、c顺序可依次加入过量的NaOH溶液、BaCl2溶液、Na2CO3溶液
B.步骤④⑤可以颠倒
C.加入盐酸的目的是将过量的NaOH和Na2CO3转化为NaClD.操作①得到的悬浊液是分散系的一种
B
混合物的分离
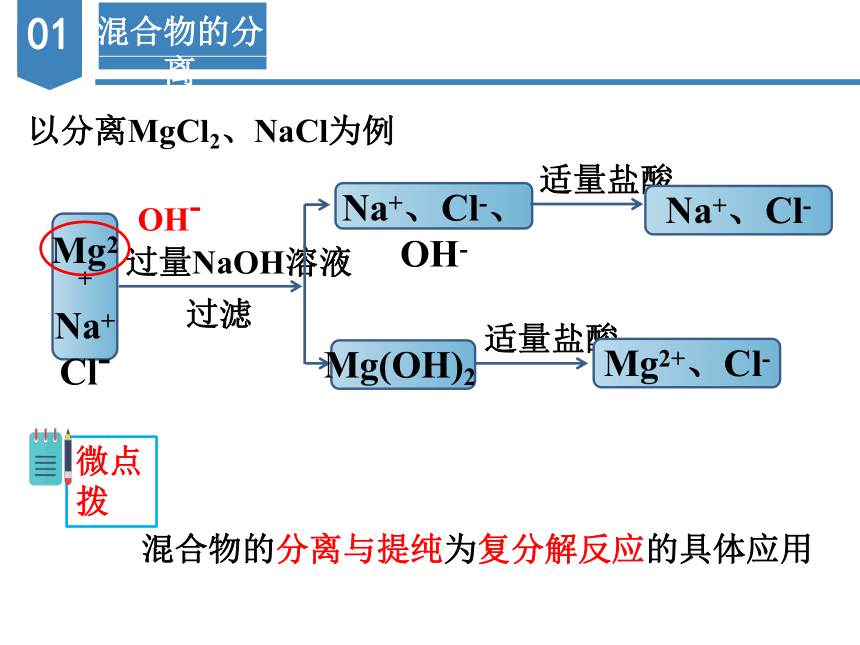
以分离MgCl2、NaCl为例
Mg2+
Na+
Cl-
过量NaOH溶液
过滤
OH-
Na+、Cl-、OH-
Mg(OH)2
适量盐酸
Na+、Cl-
适量盐酸
Mg2+、Cl-
微点拨
混合物的分离与提纯为复分解反应的具体应用
物质鉴定
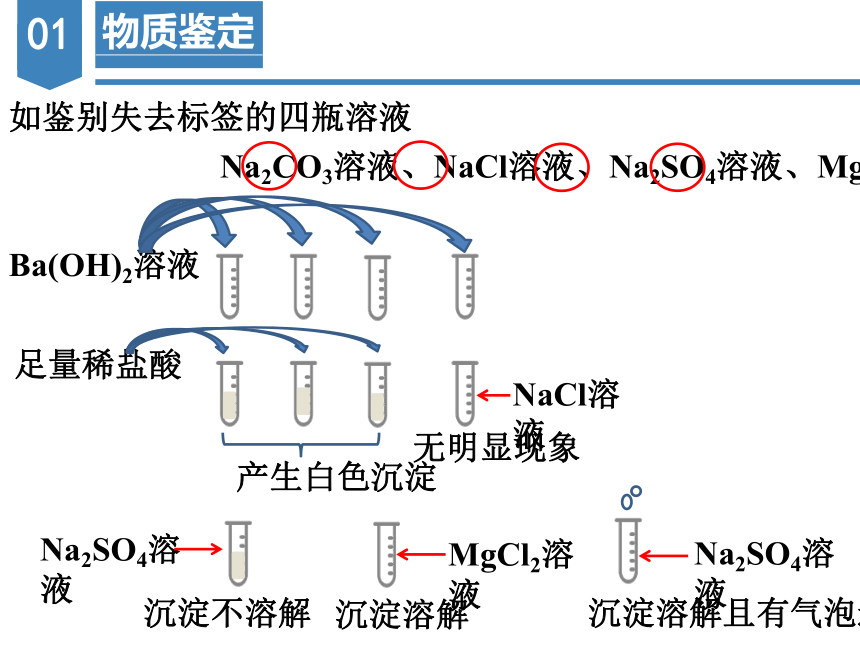
如鉴别失去标签的四瓶溶液
Na2CO3溶液、NaCl溶液、Na2SO4溶液、MgCl2溶液
Ba(OH)2溶液
产生白色沉淀
无明显现象
NaCl溶液
足量稀盐酸
沉淀不溶解
沉淀溶解
Na2SO4溶液
沉淀溶解且有气泡逸出
Na2SO4溶液
MgCl2溶液
物质鉴定
有五瓶失去标签的溶液,已知它们是:①Ba(NO3)2溶液,②KCl溶液,③NaOH溶液,④CuSO4溶液,⑤Na2SO4溶液。若不用其他任何试剂,用最简便的方法就能将它们一一鉴别。下列鉴别顺序中最合理的是( )
A.④③①⑤② B.④⑤①②③ C.①⑤③④② D.③④①⑤②
课堂检测
A
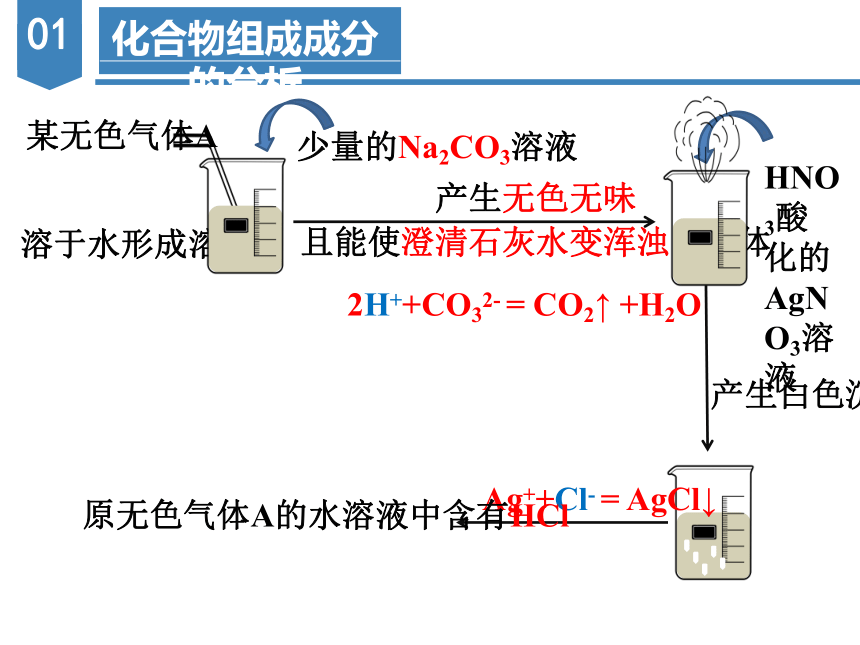
化合物组成成分的分析
某无色气体A
少量的Na2CO3溶液
产生无色无味
且能使澄清石灰水变浑浊的气体
2H++CO32- = CO2↑ +H2O
HNO3酸化的AgNO3溶液
产生白色沉淀
溶于水形成溶液
Ag++Cl- = AgCl↓
原无色气体A的水溶液中含有HCl
处理水中污染物
含有KC1
含有AgNO3
完全反应的比例混合
用这样的水浇灌农田
又为植物提供了营养
(KNO3)
减轻了水污染
回收AgC1
处理水中污染物
某河道两旁有甲、乙两厂,它们排放的工业废水中共含K+、Ag+、Fe3+、Cl-、OH-、NO3- 六种离子。
(1)甲厂的废水含有OH-,则甲厂废水中所含的另外两种离子是___________和___________(填离子符号)。
(2)乙厂的废水中一定含有的阴离子是___________(填离子符号),加入铁粉后可回收某种金属,写出该反应的离子方程式:___________________。
(3)另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的___________________________(写离子符号)转化为沉淀。经过滤后的废水主要含___________(写化学式),可用来浇灌农田。
Cl-
K+
NO3-
Fe+2Ag+=Fe2++2Ag
Ag+、Fe3+、Cl-、OH-
KNO3
课堂检测
离子共存
离子共存
1.离子共存的本质
几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
2.离子不能大量共存的常见类型
(1)复分解反应类型
(2)氧化还原应类型
(3)水解相互促进类型
(4)络合反应类型
以后学习
复分解反应类型
弱酸、弱碱、水
H+:
与CH3COO-、CO32-、S2-、SO32-、ClO-、F-等生成弱酸不能大量共存
OH-:
与NH4+、Cu2+、Mg2+等生成弱碱不能大量共存
OH-:
与H+、HCO3-、HSO3-、HS-等生成水不能大量共存
生成难电离物质的离子不能大量共存
OH-:
与除了Na+、K+、Ba2+以外常见金属离子均不能大量共存
CO32-/SO32-/S2-:
与除了Na+、K+以外常见金属离子均不能大量共存
SO42-:
与Ba2+、Ca2+、Pb2+、Ag+等不能大量共存
Cl-:
与Hg2+、Ag+等不能大量共存
生成难溶物或微溶物的离子不能大量共存
复分解反应类型
H+:
与CO32-、HCO3-、S2-、HS-、SO32-、HSO3-、S2O32--不能大量共存
OH-:
与NH4+不能大量共存
生成易挥发的离子不能大量共存
复分解反应类型
课堂检测
下列各组中的离子,能在溶液中大量共存的是( )
A.K+、H+、SO42-、Al3+
B.OH-、Fe3+、NO3-、Cl-C.Ba2+、Na+、Cl-、SO42-
D.Na+、K+、OH-、HCO3-
A
复分解反应类型
限定条件
Fe3+ 棕黄色 CrO42- 黄色
Fe2+ 浅绿色 Cr2O72- 橙色
Cu2+ 蓝色 Cr3+ 绿色
MnO4- 紫红色
透明不代表无色,即透明溶液中有色离子可以大量共存
微提醒
无色溶液限定条件
限定条件
①常温下pH< 7的溶液;
②使紫色石蕊溶液呈红色(或蓝色石蕊试纸变红);
③使pH试纸变红;
④使甲基橙呈红色;
⑤加镁粉放氢气;
⑥c(H+)>c(OH-)的溶液;
限制酸性溶液的条件(隐含有H+)
限定条件
限制碱性溶液的条件(隐含有OH-)
①常温下pH>7的溶液;
②使pH试纸变蓝;
③使红色石蕊试纸变蓝(紫色石蕊溶液呈蓝色);
④使酚酞呈红色;
⑤c(OH-)>c(H+)的溶液
限定条件
①加入铝粉有氢气产生
②HCO3-不能稳定存在的溶液
③与NH4HCO3反应能产生气体的溶液
常见表示溶液既可能呈酸性又可能呈碱性的条件
1.常温下,下列各组离子在给定溶液中能大量共存的是( )
A.pH=1的溶液:Fe2+、Mg2+、、
B.pH=12的溶液:K+、Na+、、
C.pH=7的溶液:Na+、Cu2+、S2-、Cl-
D.pH=7的溶液:Al3+、K+、Cl-、
B
2.下列各组离子在选项条件下一定能大量共存的是( )
A.无色溶液:Na+、Cu2+、Cl-、NO3-、
B.酸性溶液:NH4+、Fe3+、S2 、SO42-C.遇酚酞变红的溶液:Na+、K+、SO42-、NO3-
D.碱性溶液:K+、Al3+、SO42-、NO3-
C
3.某溶液中含有较大量的Cl-、SO42-、CO32-三种阴离子,如果只取一次该溶液就能够分别将 三种阴离子依次检验出来,则下列实验操作顺序中正确的是( )
①滴加 HNO3 溶液;②过滤;③滴加 AgNO3 溶液;④滴加 Ba(NO3)2 溶液;⑤滴加 BaCl2 溶液;
A.①⑤②③② B.④②③②①C.①④②③② D.③②①②④
C
4.不能用于鉴别K2CO3和NaCl溶液的试剂或方法是( )
A.BaCl2溶液
B.盐酸
C.CaCl2溶液
D.AgNO3溶液
D
物质的分离
A
物质的提纯
B
物质的鉴定
C
化合物组成成分的分析
D
离子共存
E
第3课时:离子反应的应用
新人教版 化学 必修一
新人教版 化学 必修一
第一章 物质的分类及其变化
第二节 离子反应
第3课时:离子反应的应用
离子反应的应用
01
离子共存
02
离子反应的应用
物质的提纯
以粗盐(杂质为Na2SO4、MgCl2、CaCl2)提纯为例
粗食盐水
Na+、Cl-、Mg2+、SO42-、Ca2+
要保留的离子
杂质离子
Na+、Cl-
Mg2+
SO42-
Ca2+
过量
NaOH溶液
过量
BaCl2溶液
过量
Na2CO3溶液
Mg(OH)2↓
BaSO4↓
CaCO3↓
过滤
CO32-、OH-
先
后
稀盐酸
物质的提纯
粗盐中含有泥沙以及Ca2+、Mg2+、SO42-等杂质,其提纯过程一般经过以下流程:
下列说法不正确的是( )
A.操作③按a、b、c顺序可依次加入过量的NaOH溶液、BaCl2溶液、Na2CO3溶液
B.步骤④⑤可以颠倒
C.加入盐酸的目的是将过量的NaOH和Na2CO3转化为NaClD.操作①得到的悬浊液是分散系的一种
B
混合物的分离
以分离MgCl2、NaCl为例
Mg2+
Na+
Cl-
过量NaOH溶液
过滤
OH-
Na+、Cl-、OH-
Mg(OH)2
适量盐酸
Na+、Cl-
适量盐酸
Mg2+、Cl-
微点拨
混合物的分离与提纯为复分解反应的具体应用
物质鉴定
如鉴别失去标签的四瓶溶液
Na2CO3溶液、NaCl溶液、Na2SO4溶液、MgCl2溶液
Ba(OH)2溶液
产生白色沉淀
无明显现象
NaCl溶液
足量稀盐酸
沉淀不溶解
沉淀溶解
Na2SO4溶液
沉淀溶解且有气泡逸出
Na2SO4溶液
MgCl2溶液
物质鉴定
有五瓶失去标签的溶液,已知它们是:①Ba(NO3)2溶液,②KCl溶液,③NaOH溶液,④CuSO4溶液,⑤Na2SO4溶液。若不用其他任何试剂,用最简便的方法就能将它们一一鉴别。下列鉴别顺序中最合理的是( )
A.④③①⑤② B.④⑤①②③ C.①⑤③④② D.③④①⑤②
课堂检测
A
化合物组成成分的分析
某无色气体A
少量的Na2CO3溶液
产生无色无味
且能使澄清石灰水变浑浊的气体
2H++CO32- = CO2↑ +H2O
HNO3酸化的AgNO3溶液
产生白色沉淀
溶于水形成溶液
Ag++Cl- = AgCl↓
原无色气体A的水溶液中含有HCl
处理水中污染物
含有KC1
含有AgNO3
完全反应的比例混合
用这样的水浇灌农田
又为植物提供了营养
(KNO3)
减轻了水污染
回收AgC1
处理水中污染物
某河道两旁有甲、乙两厂,它们排放的工业废水中共含K+、Ag+、Fe3+、Cl-、OH-、NO3- 六种离子。
(1)甲厂的废水含有OH-,则甲厂废水中所含的另外两种离子是___________和___________(填离子符号)。
(2)乙厂的废水中一定含有的阴离子是___________(填离子符号),加入铁粉后可回收某种金属,写出该反应的离子方程式:___________________。
(3)另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的___________________________(写离子符号)转化为沉淀。经过滤后的废水主要含___________(写化学式),可用来浇灌农田。
Cl-
K+
NO3-
Fe+2Ag+=Fe2++2Ag
Ag+、Fe3+、Cl-、OH-
KNO3
课堂检测
离子共存
离子共存
1.离子共存的本质
几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
2.离子不能大量共存的常见类型
(1)复分解反应类型
(2)氧化还原应类型
(3)水解相互促进类型
(4)络合反应类型
以后学习
复分解反应类型
弱酸、弱碱、水
H+:
与CH3COO-、CO32-、S2-、SO32-、ClO-、F-等生成弱酸不能大量共存
OH-:
与NH4+、Cu2+、Mg2+等生成弱碱不能大量共存
OH-:
与H+、HCO3-、HSO3-、HS-等生成水不能大量共存
生成难电离物质的离子不能大量共存
OH-:
与除了Na+、K+、Ba2+以外常见金属离子均不能大量共存
CO32-/SO32-/S2-:
与除了Na+、K+以外常见金属离子均不能大量共存
SO42-:
与Ba2+、Ca2+、Pb2+、Ag+等不能大量共存
Cl-:
与Hg2+、Ag+等不能大量共存
生成难溶物或微溶物的离子不能大量共存
复分解反应类型
H+:
与CO32-、HCO3-、S2-、HS-、SO32-、HSO3-、S2O32--不能大量共存
OH-:
与NH4+不能大量共存
生成易挥发的离子不能大量共存
复分解反应类型
课堂检测
下列各组中的离子,能在溶液中大量共存的是( )
A.K+、H+、SO42-、Al3+
B.OH-、Fe3+、NO3-、Cl-C.Ba2+、Na+、Cl-、SO42-
D.Na+、K+、OH-、HCO3-
A
复分解反应类型
限定条件
Fe3+ 棕黄色 CrO42- 黄色
Fe2+ 浅绿色 Cr2O72- 橙色
Cu2+ 蓝色 Cr3+ 绿色
MnO4- 紫红色
透明不代表无色,即透明溶液中有色离子可以大量共存
微提醒
无色溶液限定条件
限定条件
①常温下pH< 7的溶液;
②使紫色石蕊溶液呈红色(或蓝色石蕊试纸变红);
③使pH试纸变红;
④使甲基橙呈红色;
⑤加镁粉放氢气;
⑥c(H+)>c(OH-)的溶液;
限制酸性溶液的条件(隐含有H+)
限定条件
限制碱性溶液的条件(隐含有OH-)
①常温下pH>7的溶液;
②使pH试纸变蓝;
③使红色石蕊试纸变蓝(紫色石蕊溶液呈蓝色);
④使酚酞呈红色;
⑤c(OH-)>c(H+)的溶液
限定条件
①加入铝粉有氢气产生
②HCO3-不能稳定存在的溶液
③与NH4HCO3反应能产生气体的溶液
常见表示溶液既可能呈酸性又可能呈碱性的条件
1.常温下,下列各组离子在给定溶液中能大量共存的是( )
A.pH=1的溶液:Fe2+、Mg2+、、
B.pH=12的溶液:K+、Na+、、
C.pH=7的溶液:Na+、Cu2+、S2-、Cl-
D.pH=7的溶液:Al3+、K+、Cl-、
B
2.下列各组离子在选项条件下一定能大量共存的是( )
A.无色溶液:Na+、Cu2+、Cl-、NO3-、
B.酸性溶液:NH4+、Fe3+、S2 、SO42-C.遇酚酞变红的溶液:Na+、K+、SO42-、NO3-
D.碱性溶液:K+、Al3+、SO42-、NO3-
C
3.某溶液中含有较大量的Cl-、SO42-、CO32-三种阴离子,如果只取一次该溶液就能够分别将 三种阴离子依次检验出来,则下列实验操作顺序中正确的是( )
①滴加 HNO3 溶液;②过滤;③滴加 AgNO3 溶液;④滴加 Ba(NO3)2 溶液;⑤滴加 BaCl2 溶液;
A.①⑤②③② B.④②③②①C.①④②③② D.③②①②④
C
4.不能用于鉴别K2CO3和NaCl溶液的试剂或方法是( )
A.BaCl2溶液
B.盐酸
C.CaCl2溶液
D.AgNO3溶液
D
物质的分离
A
物质的提纯
B
物质的鉴定
C
化合物组成成分的分析
D
离子共存
E
第3课时:离子反应的应用
新人教版 化学 必修一
