2022-2023学年人教版九年级化学上册 第五单元 课题1 质量守恒定律 课时作业(word版有答案)
文档属性
| 名称 | 2022-2023学年人教版九年级化学上册 第五单元 课题1 质量守恒定律 课时作业(word版有答案) |  | |
| 格式 | zip | ||
| 文件大小 | 466.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-05 22:22:50 | ||
图片预览


文档简介
课题1 质量守恒定律
第1课时 质量守恒定律
基础强化
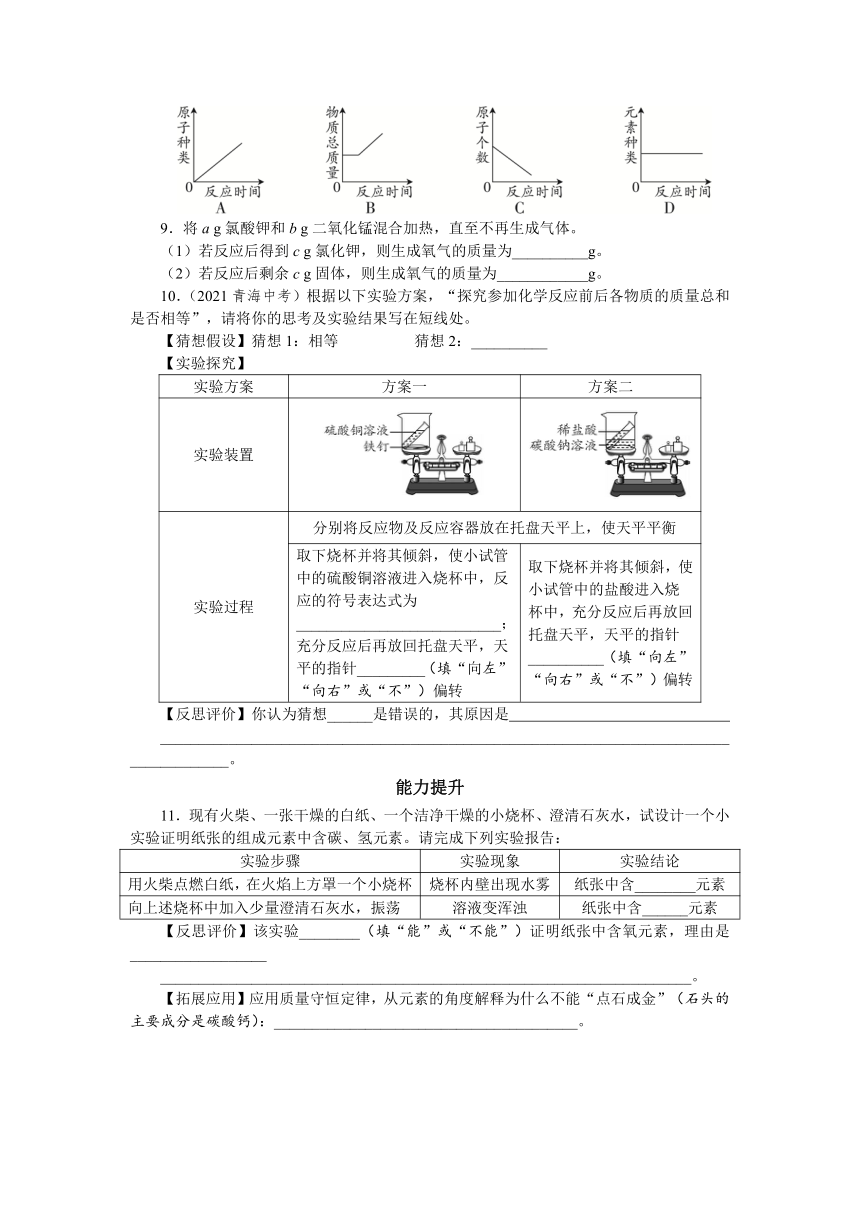
1.(2021秋驻马店期末)在距地面10~50 km的高空有一层臭氧,它能吸收大部分紫外线,保护地球生物。臭氧(O3)与氧气在一定条件下能相互转化,在此过程中发生变化的是( )
A.总质量 B.原子个数 C.分子种类 D.元素种类
2.(2021秋绵阳期末)硝酸铜受热分解会产生一种污染空气的有毒气体,该气体可能是( )
A.N2 B.NO2 C.CO D.SO2
3.(2021秋七台河期末)将15 g A、10 g B、9 g C的固体混合物充分加热,使其完全反应后,测得A剩余3 g,B增加至25 g,C无剩余,同时生成了气体D,则D的质量为( )
A.6 g B.9 g C.16 g D.34 g
4.(2021秋保定期中)下列对质量守恒定律的理解正确的是( )
A.5 g铁和5 g铜混合后物质的总质量为10 g,遵守质量守恒定律
B.镁条燃烧后质量增加,不遵守质量守恒定律
C.在氧气中燃烧的细铁丝的质量等于生成的四氧化三铁的质量
D.5 g硫和5 g氧气恰好完全反应,生成物二氧化硫的质量为10 g
5.(2021衡阳中考)下列化学反应微观示意图中,“”与“”分别表示两种不同元素的原子,则X处的粒子示意图正确的是( )
A. B. C. D.
6.(2021秋中山期末)下列实验(天平未画出)能直接用于验证质量守恒定律的是( )
7.(2021秋成都期末)关于质量守恒定律的探究实验,下列说法错误的是( )
A.甲中红磷燃烧产生大量白烟
B.甲中气球可防止橡胶塞弹开
C.乙中产生大量气泡,天平不平衡
D.甲中反应遵守质量守恒定律,乙中反应不遵守
8.(2021秋百色期末)碳在充满氧气的密闭容器中燃烧,容器内有关量随反应时间变化的图像正确的是( )
9.将a g氯酸钾和b g二氧化锰混合加热,直至不再生成气体。
(1)若反应后得到c g氯化钾,则生成氧气的质量为__________g。
(2)若反应后剩余c g固体,则生成氧气的质量为____________g。
10.(2021青海中考)根据以下实验方案,“探究参加化学反应前后各物质的质量总和是否相等”,请将你的思考及实验结果写在短线处。
【猜想假设】猜想1:相等 猜想2:__________
【实验探究】
实验方案 方案一 方案二
实验装置
实验过程 分别将反应物及反应容器放在托盘天平上,使天平平衡
取下烧杯并将其倾斜,使小试管中的硫酸铜溶液进入烧杯中,反应的符号表达式为___________________________;充分反应后再放回托盘天平,天平的指针_________(填“向左” “向右”或“不”)偏转 取下烧杯并将其倾斜,使小试管中的盐酸进入烧杯中,充分反应后再放回托盘天平,天平的指针__________(填“向左” “向右”或“不”)偏转
【反思评价】你认为猜想______是错误的,其原因是
________________________________________________________________________________________。
能力提升
11.现有火柴、一张干燥的白纸、一个洁净干燥的小烧杯、澄清石灰水,试设计一个小实验证明纸张的组成元素中含碳、氢元素。请完成下列实验报告:
实验步骤 实验现象 实验结论
用火柴点燃白纸,在火焰上方罩一个小烧杯 烧杯内壁出现水雾 纸张中含________元素
向上述烧杯中加入少量澄清石灰水,振荡 溶液变浑浊 纸张中含______元素
【反思评价】该实验________(填“能”或“不能”)证明纸张中含氧元素,理由是__________________
______________________________________________________________________。
【拓展应用】应用质量守恒定律,从元素的角度解释为什么不能“点石成金”(石头的主要成分是碳酸钙):________________________________________。
第2课时 化学方程式
基础强化
1.乙醇俗称酒精,其完全燃烧的化学方程式为C2H5OH+3O2 2CO2+3H2O,根据该化学方程式无法获取的信息是( )
A.反应物和生成物 B.反应所需条件
C.反应物的颜色和状态 D.生成物的分子个数比
2.(2021海南中考)火药是我国古代四大发明之一,《天工开物》中记载:“凡硫黄配硝,而后火药成声。”化学方程式为S+2KNO3+3C=== K2S+X↑+3CO2↑,则X的化学式为( )
A.O2 B.SO2 C.NO2 D.N2
3.下列四个化学方程式中,同时符合这四位同学描述的是( )
A.2H2+O2 2H2O B.CH4+2O2 CO2+2H2O
C.3Fe+2O2 Fe3O4 D.2C+O2 2CO
4.(2021秋大连期中)下列关于2H2O2 2H2O+O2↑的理解中,正确的是( )
A.表示过氧化氢和二氧化锰反应生成水和氧气
B.反应生成的水和氧气的分子个数比是2∶1
C.2个过氧化氢完全反应可以生成2个水和1个氧气
D.36 g过氧化氢完全反应可以生成20 g水
5.为切实做好疫情防控,阻断病毒传播,可使用一定浓度的84消毒液(有效成分NaClO)消毒杀菌。NaClO具有强氧化性,见光或受热后会迅速分解,其制取方法为Cl2+2NaOH=== NaClO+NaCl+X。下列说法错误的是( )
A.X的化学式为H2O
B.84消毒液应低温避光密封保存
C.制取NaClO反应前后原子、分子的种类均发生改变
D.制取NaClO反应前后涉及氯元素的化合价有:0、+1、-1
6.※※(2021秋佛山期中)在一定条件下,甲、乙、丙、丁四种物质在密闭容器中发生反应,测得反应前后各物质的质量如图所示。下列说法正确的是( )
A.a的数值为6 B.丁是该反应的催化剂
C.丙一定是化合物,乙可能是单质 D.该反应中甲、丙的质量变化之比为35∶3
7.(2021秋南阳期中)某同学看到化学方程式H2+Cl2 2HCl,立即想到以下两点。你能想到更多吗?请把你的想法补充到空格中。
①反应前后原子的个数不变;②反应前后元素的种类不变,都是氢元素和氯元素。
(1)________________________________________________________________。
(2)________________________________________________________________。
(3)________________________________________________________________。
8.化学与生产、科技密切相关,请回答下列问题:
(1)工业制钛的一个反应为TiF4+2H2SO4 4HF+2X+TiO2,则X的化学式为________。
(2)2021年10月神舟十三号载人飞船成功发射,火箭所用的燃料偏二甲肼(C2H8N2)与N2O4反应的化学方程式为C2H8N2+2N2O4=== 3N2↑+2CO2↑+nH2O,则n=______。
9.(2022宁夏模拟改编)近年来,我国科研人员在“甲烷-二氧化碳重整和Ni基催化剂”的研究方面取得突破。如图是甲烷与二氧化碳反应的微观示意图。
(1)X的化学式为__________,画出X的微观模型图____________。
(2)该反应中参加反应的两种物质的质量比为____________。
(3)该反应利用两种温室气体,兼具环保和经济价值。反应难点之一是破坏甲烷分子、二氧化碳分子的稳定结构,分解为________________________(填微粒名称)并重新组合。
10.※※在一定条件下,一密闭容器内发生某反应,测得反应前后各物质的质量如表所示。据此回答:
物质 A B C D
反应前的质量/g 51 9 3 17
反应后的质量/g 23 3 x 51
(1)x=______。
(2)A是__________(填“反应物”或“生成物”),参加反应的D的质量为________g。
(3)该反应属于____________(填基本反应类型)。
能力提升
11.※※碳在氧气中充分燃烧的化学方程式为C+O2 CO2,下列说法符合质量守恒定律的是( )
A.2 g C和9 g O2反应生成11 g CO2 B.5 g C和6 g O2反应生成11 g CO2
C.4 g C和7 g O2反应生成11 g CO2 D.3 g C和8 g O2反应生成11 g CO2
12.※※(2021济宁模拟)已知4.6 g某纯净物在足量的氧气中充分燃烧后,生成8.8 g二氧化碳和5.4 g水。请分析:
(1)参加反应的氧气的质量为________g。
(2)该纯净物中碳、氢元素的质量比为________________,____________(填“一定”“一定不”或“可能”)含有氧元素。
参考答案
第1课时 质量守恒定律
1.C 2.B 3.A 4.D 5.A 6.C 7.D 8.D
9.(1)a-c (2)a+b-c
10.【猜想假设】不相等 【实验探究】Fe+CuSO4―→ FeSO4+Cu 不 向右
【反思评价】2 方案二的反应会生成二氧化碳气体,但没有在密闭容器中进行,气体逸出,再称量时,质量减小
氢 碳 【反思评价】不能 反应物中有氧气,不能判断生成物中的氧元素是否来自于纸张
【拓展应用】反应前后元素种类不变,石头中不含金元素
第2课时 化学方程式
1.C 2.D 3.A 4.B 5.C
6.C 【解析】A.密闭容器中,反应前后物质的总质量守恒,据此可知70+14+6+10=42+a+40+10,a=8,错误;B.反应前后丁的质量不变,可能是该反应的催化剂,也可能是杂质(不参加反应),错误;C.反应后甲、乙的质量减小,都是反应物,丙的质量增大,是生成物,因此该反应是甲和乙反应生成丙,故丙一定是化合物,乙可能是单质,正确;D.该反应中甲、丙的质量变化之比为(70-42)g∶(40-6)g=14∶17,错误。故选C。
7.(1)反应物是氢气和氯气,生成物是氯化氢
(2)反应条件是点燃 (3)1个氢分子和1个氯分子反应生成2个氯化氢分子(合理即可)
8.(1)SO3 (2)4
9.(1)H2 (2)4∶11(或11∶4) (3)碳原子、氢原子、氧原子
10.(1)3 (2)反应物 34 (3)化合反应
【解析】(1)密闭容器中,反应前后物质的总质量守恒,据此可知51+9+3+17=23+3+x+51,x=3。
(2)反应前后A的质量减小,是反应物;参加反应的D的质量为(51-17)g=34 g。
(3)根据反应后质量减小的是反应物,质量增大的是生成物,质量不变的可能是催化剂或杂质,可知A、B是反应物, D是生成物,C可能是催化剂或杂质,该反应可表示为A+B→D,属于化合反应。
11.D 【解析】由化学方程式C+O2 CO2知,每12份质量的碳和32份质量的氧气在点燃条件下完全反应生成44份质量的二氧化碳,即参加反应的碳、氧气和生成的二氧化碳的质量比为3∶8∶11。因此3 g C和8 g O2恰好完全反应生成11 g CO2。故选D。
12.(1)9.6 (2) 4∶1 一定
【解析】(1)根据参加反应的各物质的质量总和等于反应后生成的各物质的质量总和,可计算出参加反应的氧气的质量为8.8 g+5.4 g-4.6 g=9.6 g。
(2)根据反应前后元素质量守恒可知,该纯净物中碳元素的质量为8.8 g×=2.4 g,氢元素的质量为5.4 g×=0.6 g,故碳、氢元素的质量比为2.4 g∶0.6 g=4∶1;该纯净物中碳、氢元素的质量和为2.4 g+0.6 g<4.6 g,故该纯净物中一定含有氧元素。
第1课时 质量守恒定律
基础强化
1.(2021秋驻马店期末)在距地面10~50 km的高空有一层臭氧,它能吸收大部分紫外线,保护地球生物。臭氧(O3)与氧气在一定条件下能相互转化,在此过程中发生变化的是( )
A.总质量 B.原子个数 C.分子种类 D.元素种类
2.(2021秋绵阳期末)硝酸铜受热分解会产生一种污染空气的有毒气体,该气体可能是( )
A.N2 B.NO2 C.CO D.SO2
3.(2021秋七台河期末)将15 g A、10 g B、9 g C的固体混合物充分加热,使其完全反应后,测得A剩余3 g,B增加至25 g,C无剩余,同时生成了气体D,则D的质量为( )
A.6 g B.9 g C.16 g D.34 g
4.(2021秋保定期中)下列对质量守恒定律的理解正确的是( )
A.5 g铁和5 g铜混合后物质的总质量为10 g,遵守质量守恒定律
B.镁条燃烧后质量增加,不遵守质量守恒定律
C.在氧气中燃烧的细铁丝的质量等于生成的四氧化三铁的质量
D.5 g硫和5 g氧气恰好完全反应,生成物二氧化硫的质量为10 g
5.(2021衡阳中考)下列化学反应微观示意图中,“”与“”分别表示两种不同元素的原子,则X处的粒子示意图正确的是( )
A. B. C. D.
6.(2021秋中山期末)下列实验(天平未画出)能直接用于验证质量守恒定律的是( )
7.(2021秋成都期末)关于质量守恒定律的探究实验,下列说法错误的是( )
A.甲中红磷燃烧产生大量白烟
B.甲中气球可防止橡胶塞弹开
C.乙中产生大量气泡,天平不平衡
D.甲中反应遵守质量守恒定律,乙中反应不遵守
8.(2021秋百色期末)碳在充满氧气的密闭容器中燃烧,容器内有关量随反应时间变化的图像正确的是( )
9.将a g氯酸钾和b g二氧化锰混合加热,直至不再生成气体。
(1)若反应后得到c g氯化钾,则生成氧气的质量为__________g。
(2)若反应后剩余c g固体,则生成氧气的质量为____________g。
10.(2021青海中考)根据以下实验方案,“探究参加化学反应前后各物质的质量总和是否相等”,请将你的思考及实验结果写在短线处。
【猜想假设】猜想1:相等 猜想2:__________
【实验探究】
实验方案 方案一 方案二
实验装置
实验过程 分别将反应物及反应容器放在托盘天平上,使天平平衡
取下烧杯并将其倾斜,使小试管中的硫酸铜溶液进入烧杯中,反应的符号表达式为___________________________;充分反应后再放回托盘天平,天平的指针_________(填“向左” “向右”或“不”)偏转 取下烧杯并将其倾斜,使小试管中的盐酸进入烧杯中,充分反应后再放回托盘天平,天平的指针__________(填“向左” “向右”或“不”)偏转
【反思评价】你认为猜想______是错误的,其原因是
________________________________________________________________________________________。
能力提升
11.现有火柴、一张干燥的白纸、一个洁净干燥的小烧杯、澄清石灰水,试设计一个小实验证明纸张的组成元素中含碳、氢元素。请完成下列实验报告:
实验步骤 实验现象 实验结论
用火柴点燃白纸,在火焰上方罩一个小烧杯 烧杯内壁出现水雾 纸张中含________元素
向上述烧杯中加入少量澄清石灰水,振荡 溶液变浑浊 纸张中含______元素
【反思评价】该实验________(填“能”或“不能”)证明纸张中含氧元素,理由是__________________
______________________________________________________________________。
【拓展应用】应用质量守恒定律,从元素的角度解释为什么不能“点石成金”(石头的主要成分是碳酸钙):________________________________________。
第2课时 化学方程式
基础强化
1.乙醇俗称酒精,其完全燃烧的化学方程式为C2H5OH+3O2 2CO2+3H2O,根据该化学方程式无法获取的信息是( )
A.反应物和生成物 B.反应所需条件
C.反应物的颜色和状态 D.生成物的分子个数比
2.(2021海南中考)火药是我国古代四大发明之一,《天工开物》中记载:“凡硫黄配硝,而后火药成声。”化学方程式为S+2KNO3+3C=== K2S+X↑+3CO2↑,则X的化学式为( )
A.O2 B.SO2 C.NO2 D.N2
3.下列四个化学方程式中,同时符合这四位同学描述的是( )
A.2H2+O2 2H2O B.CH4+2O2 CO2+2H2O
C.3Fe+2O2 Fe3O4 D.2C+O2 2CO
4.(2021秋大连期中)下列关于2H2O2 2H2O+O2↑的理解中,正确的是( )
A.表示过氧化氢和二氧化锰反应生成水和氧气
B.反应生成的水和氧气的分子个数比是2∶1
C.2个过氧化氢完全反应可以生成2个水和1个氧气
D.36 g过氧化氢完全反应可以生成20 g水
5.为切实做好疫情防控,阻断病毒传播,可使用一定浓度的84消毒液(有效成分NaClO)消毒杀菌。NaClO具有强氧化性,见光或受热后会迅速分解,其制取方法为Cl2+2NaOH=== NaClO+NaCl+X。下列说法错误的是( )
A.X的化学式为H2O
B.84消毒液应低温避光密封保存
C.制取NaClO反应前后原子、分子的种类均发生改变
D.制取NaClO反应前后涉及氯元素的化合价有:0、+1、-1
6.※※(2021秋佛山期中)在一定条件下,甲、乙、丙、丁四种物质在密闭容器中发生反应,测得反应前后各物质的质量如图所示。下列说法正确的是( )
A.a的数值为6 B.丁是该反应的催化剂
C.丙一定是化合物,乙可能是单质 D.该反应中甲、丙的质量变化之比为35∶3
7.(2021秋南阳期中)某同学看到化学方程式H2+Cl2 2HCl,立即想到以下两点。你能想到更多吗?请把你的想法补充到空格中。
①反应前后原子的个数不变;②反应前后元素的种类不变,都是氢元素和氯元素。
(1)________________________________________________________________。
(2)________________________________________________________________。
(3)________________________________________________________________。
8.化学与生产、科技密切相关,请回答下列问题:
(1)工业制钛的一个反应为TiF4+2H2SO4 4HF+2X+TiO2,则X的化学式为________。
(2)2021年10月神舟十三号载人飞船成功发射,火箭所用的燃料偏二甲肼(C2H8N2)与N2O4反应的化学方程式为C2H8N2+2N2O4=== 3N2↑+2CO2↑+nH2O,则n=______。
9.(2022宁夏模拟改编)近年来,我国科研人员在“甲烷-二氧化碳重整和Ni基催化剂”的研究方面取得突破。如图是甲烷与二氧化碳反应的微观示意图。
(1)X的化学式为__________,画出X的微观模型图____________。
(2)该反应中参加反应的两种物质的质量比为____________。
(3)该反应利用两种温室气体,兼具环保和经济价值。反应难点之一是破坏甲烷分子、二氧化碳分子的稳定结构,分解为________________________(填微粒名称)并重新组合。
10.※※在一定条件下,一密闭容器内发生某反应,测得反应前后各物质的质量如表所示。据此回答:
物质 A B C D
反应前的质量/g 51 9 3 17
反应后的质量/g 23 3 x 51
(1)x=______。
(2)A是__________(填“反应物”或“生成物”),参加反应的D的质量为________g。
(3)该反应属于____________(填基本反应类型)。
能力提升
11.※※碳在氧气中充分燃烧的化学方程式为C+O2 CO2,下列说法符合质量守恒定律的是( )
A.2 g C和9 g O2反应生成11 g CO2 B.5 g C和6 g O2反应生成11 g CO2
C.4 g C和7 g O2反应生成11 g CO2 D.3 g C和8 g O2反应生成11 g CO2
12.※※(2021济宁模拟)已知4.6 g某纯净物在足量的氧气中充分燃烧后,生成8.8 g二氧化碳和5.4 g水。请分析:
(1)参加反应的氧气的质量为________g。
(2)该纯净物中碳、氢元素的质量比为________________,____________(填“一定”“一定不”或“可能”)含有氧元素。
参考答案
第1课时 质量守恒定律
1.C 2.B 3.A 4.D 5.A 6.C 7.D 8.D
9.(1)a-c (2)a+b-c
10.【猜想假设】不相等 【实验探究】Fe+CuSO4―→ FeSO4+Cu 不 向右
【反思评价】2 方案二的反应会生成二氧化碳气体,但没有在密闭容器中进行,气体逸出,再称量时,质量减小
氢 碳 【反思评价】不能 反应物中有氧气,不能判断生成物中的氧元素是否来自于纸张
【拓展应用】反应前后元素种类不变,石头中不含金元素
第2课时 化学方程式
1.C 2.D 3.A 4.B 5.C
6.C 【解析】A.密闭容器中,反应前后物质的总质量守恒,据此可知70+14+6+10=42+a+40+10,a=8,错误;B.反应前后丁的质量不变,可能是该反应的催化剂,也可能是杂质(不参加反应),错误;C.反应后甲、乙的质量减小,都是反应物,丙的质量增大,是生成物,因此该反应是甲和乙反应生成丙,故丙一定是化合物,乙可能是单质,正确;D.该反应中甲、丙的质量变化之比为(70-42)g∶(40-6)g=14∶17,错误。故选C。
7.(1)反应物是氢气和氯气,生成物是氯化氢
(2)反应条件是点燃 (3)1个氢分子和1个氯分子反应生成2个氯化氢分子(合理即可)
8.(1)SO3 (2)4
9.(1)H2 (2)4∶11(或11∶4) (3)碳原子、氢原子、氧原子
10.(1)3 (2)反应物 34 (3)化合反应
【解析】(1)密闭容器中,反应前后物质的总质量守恒,据此可知51+9+3+17=23+3+x+51,x=3。
(2)反应前后A的质量减小,是反应物;参加反应的D的质量为(51-17)g=34 g。
(3)根据反应后质量减小的是反应物,质量增大的是生成物,质量不变的可能是催化剂或杂质,可知A、B是反应物, D是生成物,C可能是催化剂或杂质,该反应可表示为A+B→D,属于化合反应。
11.D 【解析】由化学方程式C+O2 CO2知,每12份质量的碳和32份质量的氧气在点燃条件下完全反应生成44份质量的二氧化碳,即参加反应的碳、氧气和生成的二氧化碳的质量比为3∶8∶11。因此3 g C和8 g O2恰好完全反应生成11 g CO2。故选D。
12.(1)9.6 (2) 4∶1 一定
【解析】(1)根据参加反应的各物质的质量总和等于反应后生成的各物质的质量总和,可计算出参加反应的氧气的质量为8.8 g+5.4 g-4.6 g=9.6 g。
(2)根据反应前后元素质量守恒可知,该纯净物中碳元素的质量为8.8 g×=2.4 g,氢元素的质量为5.4 g×=0.6 g,故碳、氢元素的质量比为2.4 g∶0.6 g=4∶1;该纯净物中碳、氢元素的质量和为2.4 g+0.6 g<4.6 g,故该纯净物中一定含有氧元素。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
