化学人教版(2019)必修第一册3.1铁及其化合物(共22张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册3.1铁及其化合物(共22张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-06 16:22:56 | ||
图片预览







文档简介
(共22张PPT)
铁及其化合物的氧化性和还原性
铁的存在
陨铁 单质(游离态)
赤铁矿
氧化铁Fe2O3
磁铁矿
四氧化三铁Fe3O4
化合态
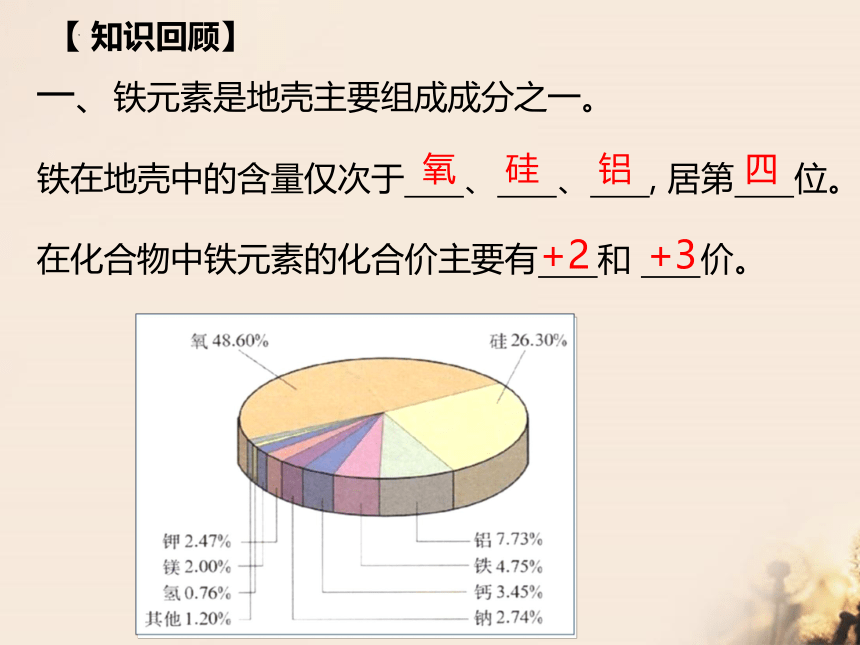
一、铁元素是地壳主要组成成分之一。
铁在地壳中的含量仅次于 、 、 , 居第 位。
在化合物中铁元素的化合价主要有 和 价。
【 知识回顾】
氧 硅 铝
四
+2 +3
一、铁单质
(1)物理性质
银白色金属,密度大,熔沸点高,有良好的延展性、导热性,导电性比铜、铝差,能被磁铁吸引。
(2)化学性质
与非金属反应:Cl2,S等
与水蒸气反应
与非氧化性酸:HCl,稀H2SO4
与盐溶液
3Fe+4H2O(g) ====Fe3O4+4H2
高温
常温下,铁与水是不反应的。但在高温下可与水蒸气反应:
思考:在钢铁厂的生产中,炽热的铁水或钢水注入模具之前必须进行充分的干燥处理,不得留有水,这是为什么呢?
避免高温下铁与水反应,生成四氧化三铁。
FeO 、 Fe2O3 、Fe3O4
Fe(OH)2 、Fe(OH)3
FeSO4 、FeCl3
(黑色) (红棕色)
(黑色晶体)
(浅绿色) (黄色)
二、含铁化合物
1、氧化物:
2、氢氧化物:
(白色) (红褐色)
3、盐:
铁红,赤铁矿
磁性氧化铁
含铁元素的矿物
黄铁矿
磁铁矿
赤铁矿
(主要成分为FeS2)
(主要成分为Fe2O3)
(主要成分为Fe3O4 )
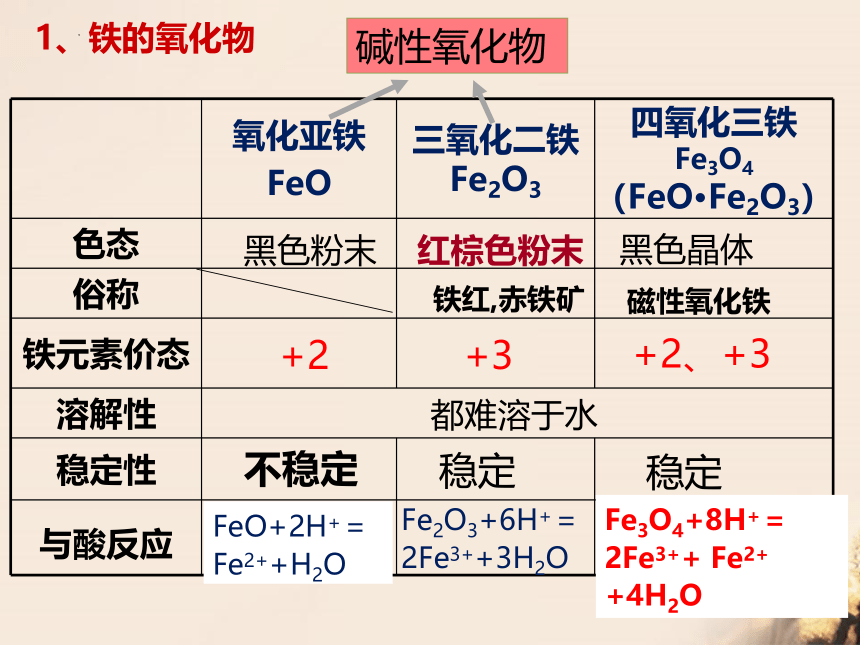
1、铁的氧化物
氧化亚铁 FeO 三氧化二铁 Fe2O3 四氧化三铁 Fe3O4(FeO Fe2O3)
色态
俗称
铁元素价态
溶解性
稳定性
与酸反应
黑色粉末
红棕色粉末
黑色晶体
+2
+3
+2、+3
都难溶于水
不稳定
稳定
稳定
FeO+2H+=
Fe2++H2O
Fe2O3+6H+=
2Fe3++3H2O
Fe3O4+8H+=2Fe3++ Fe2+ +4H2O
铁红,赤铁矿
磁性氧化铁
碱性氧化物
氧化铁颜料的应用
汽车涂料
木器涂料
外墙涂料
印刷油墨
美术涂料
化妆品
氧化铁:涂料、冶炼铁的原料等
玉石中的FeO经氧化而成三价铁,颜色变成红棕色,特别是裂缝部位或有空隙的部位,还有暴露在外的截面部分也容易氧化而成红棕色。
实验室里的含铁试剂
FeSO4·7H2O
(绿矾)
FeCl3·6H2O
Fe(OH)3 沉淀
2、铁的氢氧化物
氢氧化亚铁 Fe(OH)2 氢氧化铁 Fe(OH)3
颜色
溶解性
稳定性
制备
Fe2++2OH-=Fe(OH)2↓
(隔绝空气)
Fe3++3OH-=Fe(OH)3↓
白色
红褐色
难溶于水
难溶于水
受热易分解
极易被空气中氧气氧化成氢氧化铁
4Fe(OH)2+2H2O+O2=4Fe(OH)3
白色 — 灰绿色 — 红褐色
思考:Fe(OH)2 不稳定易被氧化,那么用FeSO4与NaOH制备Fe(OH)2 应注意哪些问题?
1.使用新制的FeSO4
2.使用加热煮沸法除去O2的NaOH溶液
3.滴管末端伸入液面以下
4.可以采用液封(上加煤油或苯)
隔绝空气
制备Fe(OH)2
你需要掌握的是:
1.通过铁与Cl2,S的反应,知道氧化性Cl2>S。
2.铁的氧化物的颜色、俗称
3.氢氧化铁和氢氧化亚铁的颜色,转换,制备。
Fe 有还原性
Fe3+ 有氧化性
Fe2+ 既有氧化性又有还原性
以Fe、 FeCl2 、 FeCl3为例进行探究
预测:
课本P54 活动探究
还原剂:
氧化剂:
氯水,稀HNO3、稀H2SO4,FeCl3, FeCl2 …
Zn、Fe 、 Cu、 FeCl2 …
Fe3+ 与SCN-反应生成显红色的物质,即利用KSCN(硫氰酸钾)检验Fe3+的存在
Fe3+的检验方法
检验Fe3+
KSCN
铁及其化合物的氧化性和还原性
三、铁及其化合物的氧化性还原性
(一)、Fe
1、化合价:
3、性质验证:
2、性质预测:
0价
只有还原性
实验内容
实验现象
反应原理
铁和稀硫酸反应
铁和氯水反应
铁粉逐渐溶解,有气泡生成。
铁粉逐渐溶解,溶液呈棕黄色
Fe+2H+=== Fe++H2↑
2Fe+3Cl2=== 6Cl-+2Fe3+
(二)、Fe2+
1、化合价:
2、性质预测:
3、性质验证:
实验内容
实验现象
反应原理
既有氧化性又有还原性
+2价
氯化亚铁和锌反应
氯化亚铁和氯水反应
溶液颜色由浅绿色变为无色。
加入KSCN溶液无明显现象,加入氯水后溶液变红色。
2Fe2++Cl2===2Fe3++2Cl-
Fe2++Zn===Fe+Zn2+
(验证氧化性)
(验证还原性)
(三)、Fe3+
1、化合价:
2、性质预测:
3、性质验证:
实验内容
实验现象
反应原理
只有氧化性
+3价
氯化铁和铁反应
氯化铁和铜反应
加入KSCN溶液变红色,
再加铁粉,溶液变为浅绿色。
2Fe3++Fe=3Fe2+
加入KSCN溶液变红色,
再加铜片,溶液变为蓝色。
2Fe3++Cu=2Fe2++Cu2+
Fe
Fe2+
Fe3+
H+、Cu2+
强还原剂
强氧化剂
Cl2,O2,HNO3
Fe、Cu
还原剂
“铁三角”
四、不同价态铁之间的转化
Cl2、HNO3
Zn、Al
强还原剂
C、CO 、 H2
强氧化剂
氧化剂
1. Fe2+,Fe3+的鉴别
(1)直接观察颜色:
(2)利用Fe3+的显色反应(KSCN):
(3)利用沉淀的颜色:
(4)利用Fe2+的还原性
2. Fe2+溶液的保存:
加少量的铁粉,防止Fe2+被氧化。
3. 除杂
FeCl3 (FeCl2)——
FeCl2 (FeCl3)——
Fe
Cl2
方法技巧
C
练习
D
练习
B
C
铁及其化合物的氧化性和还原性
铁的存在
陨铁 单质(游离态)
赤铁矿
氧化铁Fe2O3
磁铁矿
四氧化三铁Fe3O4
化合态
一、铁元素是地壳主要组成成分之一。
铁在地壳中的含量仅次于 、 、 , 居第 位。
在化合物中铁元素的化合价主要有 和 价。
【 知识回顾】
氧 硅 铝
四
+2 +3
一、铁单质
(1)物理性质
银白色金属,密度大,熔沸点高,有良好的延展性、导热性,导电性比铜、铝差,能被磁铁吸引。
(2)化学性质
与非金属反应:Cl2,S等
与水蒸气反应
与非氧化性酸:HCl,稀H2SO4
与盐溶液
3Fe+4H2O(g) ====Fe3O4+4H2
高温
常温下,铁与水是不反应的。但在高温下可与水蒸气反应:
思考:在钢铁厂的生产中,炽热的铁水或钢水注入模具之前必须进行充分的干燥处理,不得留有水,这是为什么呢?
避免高温下铁与水反应,生成四氧化三铁。
FeO 、 Fe2O3 、Fe3O4
Fe(OH)2 、Fe(OH)3
FeSO4 、FeCl3
(黑色) (红棕色)
(黑色晶体)
(浅绿色) (黄色)
二、含铁化合物
1、氧化物:
2、氢氧化物:
(白色) (红褐色)
3、盐:
铁红,赤铁矿
磁性氧化铁
含铁元素的矿物
黄铁矿
磁铁矿
赤铁矿
(主要成分为FeS2)
(主要成分为Fe2O3)
(主要成分为Fe3O4 )
1、铁的氧化物
氧化亚铁 FeO 三氧化二铁 Fe2O3 四氧化三铁 Fe3O4(FeO Fe2O3)
色态
俗称
铁元素价态
溶解性
稳定性
与酸反应
黑色粉末
红棕色粉末
黑色晶体
+2
+3
+2、+3
都难溶于水
不稳定
稳定
稳定
FeO+2H+=
Fe2++H2O
Fe2O3+6H+=
2Fe3++3H2O
Fe3O4+8H+=2Fe3++ Fe2+ +4H2O
铁红,赤铁矿
磁性氧化铁
碱性氧化物
氧化铁颜料的应用
汽车涂料
木器涂料
外墙涂料
印刷油墨
美术涂料
化妆品
氧化铁:涂料、冶炼铁的原料等
玉石中的FeO经氧化而成三价铁,颜色变成红棕色,特别是裂缝部位或有空隙的部位,还有暴露在外的截面部分也容易氧化而成红棕色。
实验室里的含铁试剂
FeSO4·7H2O
(绿矾)
FeCl3·6H2O
Fe(OH)3 沉淀
2、铁的氢氧化物
氢氧化亚铁 Fe(OH)2 氢氧化铁 Fe(OH)3
颜色
溶解性
稳定性
制备
Fe2++2OH-=Fe(OH)2↓
(隔绝空气)
Fe3++3OH-=Fe(OH)3↓
白色
红褐色
难溶于水
难溶于水
受热易分解
极易被空气中氧气氧化成氢氧化铁
4Fe(OH)2+2H2O+O2=4Fe(OH)3
白色 — 灰绿色 — 红褐色
思考:Fe(OH)2 不稳定易被氧化,那么用FeSO4与NaOH制备Fe(OH)2 应注意哪些问题?
1.使用新制的FeSO4
2.使用加热煮沸法除去O2的NaOH溶液
3.滴管末端伸入液面以下
4.可以采用液封(上加煤油或苯)
隔绝空气
制备Fe(OH)2
你需要掌握的是:
1.通过铁与Cl2,S的反应,知道氧化性Cl2>S。
2.铁的氧化物的颜色、俗称
3.氢氧化铁和氢氧化亚铁的颜色,转换,制备。
Fe 有还原性
Fe3+ 有氧化性
Fe2+ 既有氧化性又有还原性
以Fe、 FeCl2 、 FeCl3为例进行探究
预测:
课本P54 活动探究
还原剂:
氧化剂:
氯水,稀HNO3、稀H2SO4,FeCl3, FeCl2 …
Zn、Fe 、 Cu、 FeCl2 …
Fe3+ 与SCN-反应生成显红色的物质,即利用KSCN(硫氰酸钾)检验Fe3+的存在
Fe3+的检验方法
检验Fe3+
KSCN
铁及其化合物的氧化性和还原性
三、铁及其化合物的氧化性还原性
(一)、Fe
1、化合价:
3、性质验证:
2、性质预测:
0价
只有还原性
实验内容
实验现象
反应原理
铁和稀硫酸反应
铁和氯水反应
铁粉逐渐溶解,有气泡生成。
铁粉逐渐溶解,溶液呈棕黄色
Fe+2H+=== Fe++H2↑
2Fe+3Cl2=== 6Cl-+2Fe3+
(二)、Fe2+
1、化合价:
2、性质预测:
3、性质验证:
实验内容
实验现象
反应原理
既有氧化性又有还原性
+2价
氯化亚铁和锌反应
氯化亚铁和氯水反应
溶液颜色由浅绿色变为无色。
加入KSCN溶液无明显现象,加入氯水后溶液变红色。
2Fe2++Cl2===2Fe3++2Cl-
Fe2++Zn===Fe+Zn2+
(验证氧化性)
(验证还原性)
(三)、Fe3+
1、化合价:
2、性质预测:
3、性质验证:
实验内容
实验现象
反应原理
只有氧化性
+3价
氯化铁和铁反应
氯化铁和铜反应
加入KSCN溶液变红色,
再加铁粉,溶液变为浅绿色。
2Fe3++Fe=3Fe2+
加入KSCN溶液变红色,
再加铜片,溶液变为蓝色。
2Fe3++Cu=2Fe2++Cu2+
Fe
Fe2+
Fe3+
H+、Cu2+
强还原剂
强氧化剂
Cl2,O2,HNO3
Fe、Cu
还原剂
“铁三角”
四、不同价态铁之间的转化
Cl2、HNO3
Zn、Al
强还原剂
C、CO 、 H2
强氧化剂
氧化剂
1. Fe2+,Fe3+的鉴别
(1)直接观察颜色:
(2)利用Fe3+的显色反应(KSCN):
(3)利用沉淀的颜色:
(4)利用Fe2+的还原性
2. Fe2+溶液的保存:
加少量的铁粉,防止Fe2+被氧化。
3. 除杂
FeCl3 (FeCl2)——
FeCl2 (FeCl3)——
Fe
Cl2
方法技巧
C
练习
D
练习
B
C
