浙教版科学2022-2023学年上学期九年级“一课一练”:2.2金属的化学性质(1)【word,含解析】
文档属性
| 名称 | 浙教版科学2022-2023学年上学期九年级“一课一练”:2.2金属的化学性质(1)【word,含解析】 |

|
|
| 格式 | doc | ||
| 文件大小 | 155.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-09-06 00:00:00 | ||
图片预览




文档简介
1.下列关于金属与氧气反应的说法中正确的是( )
A.红热的铁丝在空气中能燃烧
B.根据金属与氧气反应的难易程度,可以初步比较一些金属的活动性
C.各种金属在常温下都能与氧气反应
D.在较高温度下能与氧气反应的金属,在常温下也能与氧气反应
2.铕(Eu)是非常活泼的金属,能与冷水反应,应保存在氩气中。铕与水反应的化学方程式为:Eu+2H2O═Eu(OH)2↓+H2↑,该反应属于( )
A. 化合反应 B. 分解反应C. 置换反应 D. 复分解反应
3.如图所示,分别向甲,乙两支试管中加入形状和大小完全相同的铁片,再向甲中加入植物油,U形玻璃管内为红墨水(开始时两端液面相平),塞上橡皮塞后,放置一段时间。下列说法错误的是( )。
A.植物油用于隔绝氧气和水
B.甲试管中铁片比乙试管中铁片不易生锈
C.U形玻璃管两端的液面变为右低左高
D.U形玻璃管两端的液面变为左低右高
4.下列物质中不能通过金属与硫酸反应得到的是( )
A. FeSO4 B. Al2(SO4)3 C. Fe2(SO4)3D. ZnSO4
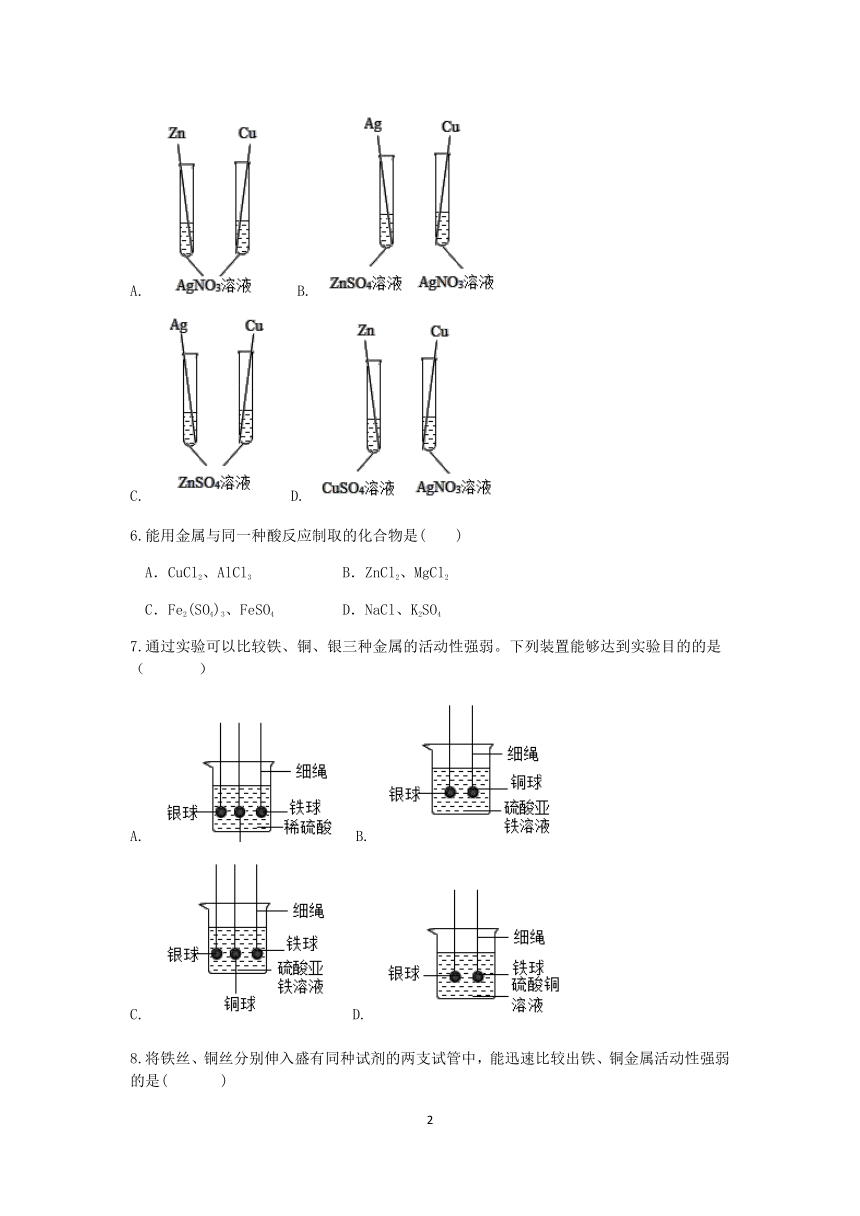
5.小科为验证锌、铜、银三种金属的活动性顺序,设计了下列四种方案,其中合理的是( )
A. B.
C. D.
6.能用金属与同一种酸反应制取的化合物是( )
A.CuCl2、AlCl3 B.ZnCl2、MgCl2
C.Fe2(SO4)3、FeSO4 D.NaCl、K2SO4
7.通过实验可以比较铁、铜、银三种金属的活动性强弱。下列装置能够达到实验目的的是( )
A. B.
C. D.
8.将铁丝、铜丝分别伸入盛有同种试剂的两支试管中,能迅速比较出铁、铜金属活动性强弱的是( )
A.蒸馏水 B.稀硫酸 C.硫酸钠溶液 D.氢氧化钠溶液
9.由Ag和另一种金属组成的混合物共8g,将其加入足量的稀硫酸完全反应后,共收集到0.4gH2 , 则另一种金属可能是( )
A. Cu B. Zn C. Mg D. Fe
10.我国发明的新型钛合金,为“奋斗者”号下潜万米海底、从事科考任务解决了材料难题。工业制取金属钛的主要反应式是: ① 2FeTiO3+6C+7Cl2 2FeCl3+2TiCl4+6CO;②2Mg+TiCl4 2MgCl2+Ti 下列说法合理的是( )
A.FeTiO3属于氧化物 B.钛合金是一种金属单质
C.反应②属于置换反应 D.TiCl4中钛元素和氯元素的质量比为96:71
11.某同学为确认所回收易拉罐的主要成分是铝还是铁,剪取金属片打磨后,设计了如图所示的两种不同方法进行检验。这样设计的依据是( ) 。
A.活泼金属易与氧气反应
B.铁与铝有不同的物理性质
C.排在氢前面的金属可以把酸中的氢置换出来
D.活动性较强的金属可把活动性较弱的金属从它的盐溶液中置换出来
12.用等质量的锌、铁、镁三种金属分别与三份溶质质量分数相同的稀盐酸充分反应。产生氢气的质量与反应时间的关系如图所示。下列说法中正确的是( )
反应后可能没有剩余的金属是锌和铁
B. 反应后不一定有剩余的金属是镁
C. 根据图像分析,金属镁产生氢气最多
D. 曲线X、Y、Z分别表示锌、铁、镁的反应情况
13.为探究镁、铁、铜三种金属的活动性顺序,小涛设计了如图所示的实验方案。请完成下列问题:
(1)同学们经讨论后认为该方案可以优化,________试管的实验是多余的;
(2)去掉多余的实验,同学们将另两只试管中反应后的物质倒入同一大烧杯中,一段时间后过滤,向滤渣中加入稀硫酸,有气泡产生,则组成滤渣的所有可能是 ________。
14.2021年3月,四川三星堆遗址进行了新一轮考古发掘。至今三星堆已出土了黄金面具、青铜纵目面具等一批珍贵文物,如图。
(1)出土的黄金面具仍金光灿灿,而青铜纵目面具已锈迹斑斑,这说明金的活动性比铜________(选填“强”或“弱”)。
(2)古代制作青铜器的铜来源于铜矿,如黄铜矿。黄铜矿的主要成分为二硫化亚铁铜 (CuFeS2),其中铁元素和铜元素均为+2价,硫元素的化合价为 ________。
(3)应用碳-14测出三星堆遗址距今3000年左右,碳-12和碳-14是碳元素的两种同位素原子,它们的主要区别是原子核中________ 数不同。
15.垃圾的分类回收再利用越来越受社会的关注。下图是某工厂处理含铜垃圾的生产流程:
(1)根据相关现象可知加入的A单质可能是________。
(2)若在回收含铜垃圾中发现混有金属铝,它________(填“会”或“不会”)出现在最终得到的红色粉末中。
16.某科学兴趣小组为研究不同金属跟稀硫酸反应的快慢,将甲、乙、丙、丁四种金属片分别与相同体积、相同溶质质量分数的稀硫酸反应,观察30秒内产生的氢气泡的多少,记录在下表中。(“+”越多表示产生的气泡越多)
金属 甲 乙 丙 丁
氢气泡的多少 ++ ++++ +++ +
(1)从实验结果可看出,甲、乙、丙、丁四种金属与稀硫酸反应由快到慢的顺序是________。
(2)要获得令人信服的实验结论,除了稀硫酸的体积和溶质质量分数必须相同外,4种金属的________也必须相同。
17.含铜离子的盐溶液一般呈蓝色,但老师在做氧化铜粉末与新配制的稀盐酸反应实验时,反应后的溶液却是绿色的,这是怎么回事呢 他们对此进行了科学探究:
猜想一:生成物中除铜离子外可能还有其它离子;
猜想二:可能与铜离子浓度偏大有关;
(1)为了验证猜想一,同学们先查阅了常见离子的颜色,知道了亚铁离子的颜色为浅绿色。于是,他们向反应后的溶液中加入金属锌,结果在锌表面只生成红色固体,则证明猜想一是________。
(2)为了验证猜想二,上网进行了查询,发现氯化铜溶液的颜色与溶液的浓度有关,见下表。那么,实验若要得到蓝色的氯化铜溶液,老师可采取的措施是:________。
溶液浓度 溶液很浓 溶液较浓 溶液很稀
溶液颜色 黄色 绿色 蓝色
(3)进一步查阅网上资料可知:氯化铜溶液的颜色变化的真正原因是氯离子的浓度不同产生的。为了验证上述资料是否正确。小宁同学向反应后蓝色的溶液中加入NaCI固体, 溶液出现________,则该资料是正确的。
18.某金属混合物的主要成分是锌、铁和铜,课外兴趣小组将500克稀硫酸溶液不断加到50克金属混合物中得到如下数据:
次数 第1次 第2次 第3次 第4次 第5次
加入稀硫酸溶液的质量/克 100 100 100 100 100
剩余固体的质量/克 37 24.9 a 3 3
(1)表格中“a”的值为________;
(2)其所用稀硫酸溶液的溶质质量分数为多少?
(3)第2次反应结束后,溶液中含有的溶质有________。
答案及解析
1.【答案】B
【解析】A.铁丝在空气中不能燃烧,在氧气中能燃烧,不符合题意;
B.根据金属与氧气反应的难易程度,可以初步比较一些金属的活动性,符合题意;
C.不是所有金属常温下都能与氧气反应,不符合题意;
D.在较高温度下能与氧气反应的金属,在常温下不一定与氧气反应,不符合题意;
2.【答案】 C
【解析】根据反应物和生成物的种类和种数,确定化学反应的基本类型。
【解答】根据方程式 Eu+2H2O═Eu(OH)2↓+H2↑ 可知,反应物和生成物都由单质和化合物组成,则该反应为置换反应,故C正确,而A、B、D错误。
3.【答案】C
【解析】根据甲中铁不与氧气和水接触,不生锈,乙中铁生锈时会使压强减小分析。
A、植物油可以隔绝氧气和水,不符合题意;
B、甲试管中铁片不与水和氧气接触,比乙试管中铁片不易生锈 ,不符合题意;
C、甲试管中铁比乙试管中不易生锈,当乙试管中铁生锈时装置内压强减小,U形管内液面会出现左低右高的现象,符合题意;
D、U形玻璃管两端的液面变为左低右高 ,不符合题意;
4.【答案】 C
【解析】根据酸的性质分析判断。
【解答】AC.铁和稀硫酸反应,生成硫酸亚铁和氢气,故A不合题意,C符合题意;
B.铝和稀硫酸反应,生成硫酸铝和氢气,故B不合题意;
D.锌和稀硫酸反应,生成硫酸锌和氢气,故D不合题意。
5.【答案】 D
【解析】在金属活动性顺序表中,只有排在前面的金属才能将后面的金属从它的盐溶液中置换出来,据此分析判断。
【解答】A.锌和铜都能与硝酸银反应,只能说明它们的活动性比银强,但是不能判断锌和铜活动性的大小,故A错误;
B.银和硫酸锌不反应,则锌的活动性大于银;铜和硝酸银反应,则活动性铜大于银,但是无法比较锌和铜的活动性大小,故B错误;
C.银和铜都不能与硫酸锌反应,不能比较二者的活动性大小,故C错误;
D.锌和硫酸铜反应,则锌的活动性大于铜;铜和硝酸银反应,则铜的活动性大于银,那么三种的金属活动性强弱:锌>铜>银,故D正确。
6.【答案】B
【解析】铜的活动性较弱,与酸不反应,A错
铁与酸反应生成亚铁离子,C错
钠与钾活动性很强,能与水反应生成碱再与酸反应
7.【答案】 D
【解析】根据金属能否与酸或盐溶液反应,从而证明金属活动性强弱分析。
【解答】A、银和铜都不与稀硫酸反应,只有铁能与稀硫酸反应,只能证明铁的活动性最强,不能证明银和铜的活动性强弱,不符合题意;
B、银和铜都不能与硫酸亚铁溶液反应,只能证明铁的活动性最强,不能证明银和铜的活动性强弱,不符合题意;
C、银和铜都不能与硫酸亚铁溶液反应,只能证明铁的活动性最强,不能证明银和铜的活动性强弱,不符合题意;
D、铁能与硫酸铜反应,银不能与硫酸铜反应,可证明铁的活动性大于铜,铜的活动性大于银,可证明三金属活动性强弱,符合题意;
8.【答案】B
【解析】根据铁与铜不能与水、硫酸钠、氢氧化钠反应,不能比较活动性强弱,但能用加稀硫酸来比较分析。
A、铁铜都不能与水反应,无法比较铁、铜的活动性强弱,不符合题意;
B、铁能与稀硫酸反应,铜不能与稀硫酸反应,可以比较铁的活动性大于铜,符合题意;
C、铁和铜都不能与硫酸钠反应,无法比较铁、铜的活动性强弱,不符合题意;
D、铁和铜都不能与氢氧化钠溶液反应,无法比较铁、铜的活动性强弱,不符合题意;
9.【答案】 C
【解析】根据银、铜不与酸反应,而8克锌或铁产生氢气质量均小于0.4克,镁大于0.4克分析。
【解答】银、铜不与酸反应,由方程可知,锌、镁、铁分别取8克时,产生氢气质量如下:
Zn --H2 Mg --H2 Fe --H2
65 2 34 2 56 2
8g 0.25g 8g 0.67g 8g 0.29g
由Ag和另一种金属组成的混合物共8g,将其加入足量的稀硫酸完全反应后,共收集到0.4gH2 , 则一定含有镁;
10.【答案】C
【解析】A、根据氧化物由两种元素组成其中一种为氧元素的化合物分析;
B、根据合金属于混合物分析;
C、根据置换反应反应物和生成物都一种单质和一种化合物分析;
D、根据元素质量比为相对原子质量×原子个数之比分析。
【解答】A、 FeTiO3由三种元素组成,不属于氧化物 ,不符合题意;
B、钛合金是混合物,不符合题意;
C、反应②属于置换反应反应物和生成物都一种单质和一种化合物,属于置换反应,符合题意;
D、TiCl4中钛元素和氯元素的质量比为48:142 ,不符合题意;
11.【答案】 D
【解析】根据金属能否与盐反应是利用活动性较强的金属可把活动性较弱的金属从它的盐溶液中置换出来分析 。
【解答】铝的活动性大于锌和铁,能与氯化锌溶液、氯化亚铁溶液反应,铁的活动性小于锌,不能与氯化锌溶液反应,所以题中设计依据是活动性较强的金属可把活动性较弱的金属从它的盐溶液中置换出来 ;
12.【答案】 A
【解析】根据三种金属的活动性顺序和质量守恒定律分析。
【解答】根据金属活动性顺序表可知,三种金属的活动性顺序:镁>锌>铁,因此与酸反应的快慢为:镁>锌>铁。根据图片可知,曲线X、Y、Z分别表示镁、锌和铁的反应情况,故D错误;
根据图片可知,金属铁生成的氢气质量最多,故C错误;
根据反应的化学方程式可知,生成2份氢气,需要消耗镁24份、铁56份、锌64份,即消耗金属的质量大小:镁<铁<锌。镁和锌生成氢气的质量相等,即反应的稀盐酸的质量相等,那么二者的质量之比为:24:64,因此如果有一种金属剩余,那么就是金属镁,故B错误;
当酸的质量足够时,质量相等的锌和铁,生成氢气的质量铁大于锌,因此反应后可能没有剩余的金属是铁和锌,故A正确。
13.【答案】(1)丙 (2)Cu、Fe和Cu、Fe、Mg
【解析】(1)根据金属能否与盐溶液反应验证金属活动性强弱分析;
(2)根据铜不能与硫酸反应,铁和镁能与硫酸反应,滤渣中固体存在的顺序为先强后强分析。
【解答】(1)甲试管可得出镁的活动性大于铁,乙试管可得出铁的活动性大于铜,甲乙试管即可得出镁、铁、铜的活动性顺序,丙可得出镁的活动性大于铜,该实验多余;
(2) 去掉多余的实验,将另两只试管中反应后的物质倒入同一大烧杯中,一段时间后过滤,向滤渣中加入稀硫酸,有气泡产生,说明滤渣中一定有铁和铜,可能有镁,则组成滤渣的所有可能是 Cu、Fe和Cu、Fe、Mg。
14.【答案】 (1)弱(2)-2(3)中子
【解析】(1)根据金的活动性比铜弱分析;
(2)根据化合物中元素化合价代数和为0分析;
(3)根据同种元素中不同种原子中子数不同分析。
【解答】(1) 出土的黄金面具仍金光灿灿,而青铜纵目面具已锈迹斑斑,说明铜的发生了缓慢氧化,而金没有,即金的活动性比铜弱;
(2) 二硫化亚铁铜 (CuFeS2),其中铁元素和铜元素均为+2价,根据化合物中元素化合价代数和为0可知,硫元素的化合价为-2价;
(3) 碳-12和碳-14是碳元素的两种同位素原子,它们的主要区别是原子核中的中子数不同;
故答案为:(1)弱;(2)-2;(3)中子。
15.【答案】 (1)铁(或Fe)(2)不会
【解析】(1)根据铁能与铜盐反应生成浅绿色亚铁盐溶液和铜分析;
(2)根据铁的活动性小于铝,所以不能置换出铝分析。
【解答】(1)蓝色溶液中加入A单质,得到红色固体和浅绿色溶液,则A为铁;
(2) 若在回收含铜垃圾中发现混有金属铝,则铝与硫酸反应会生成硫酸铝,铁的活动性小于铝,所以不能置换出铝,铝不会出现在最终得到的红色粉末中。
故答案为:(1)铁(或Fe);(2)不会。
16.【答案】(1)乙>丙>甲>丁 (2)表面积
【解析】根据题目中金属与酸反应产生气泡多少决定反应快慢及物质的接触面积影响反应速率分析。
(1)由所给现象可知,金属与酸反应时乙产生气泡最多,其次是丙,其次是甲,丁产生气泡最少,所以四种金属与稀硫酸反应由快到慢的顺序是乙>丙>甲>丁;
(2)对比实验要求变量唯一,该实验除了稀硫酸的体积和溶质质量分数必须相同外,4种金属的表面积也必须相同
17.【答案】 (1)错误的
(2)稀释原盐酸溶液(或减少加入的氧化铜的质量、对实验后的氯化铜溶液加水稀释)
(3)由蓝色变成绿色
【解析】(1)根据锌能与亚铁盐发生反应分析;
(2)根据溶液浓度影响溶液颜色可通过加水稀释来验证分析;
(3)根据氯离子浓度影响溶液颜色可通过增加氯离子来验证分析。
【解答】(1)锌的活动性大于铁,若溶液中有亚铁离子则加入锌后会置换出铁,但现象是锌表面只生成红色固体,说明溶液中没有亚铁离子,猜想一错误;
(2)由资料可知氯化铜溶液的颜色与溶液的浓度有关,则可采取稀释原盐酸溶液观察颜色的变化来证明猜想的正确性;
(3)要证明氯化铜溶液的颜色变化的真正原因是氯离子的浓度不同产生,可向溶液中加入其它含氯离子的物质,通过颜色的转变来实现;
故答案为:(1)错误的;(2)稀释原盐酸溶液(或减少加入的氧化铜的质量、对实验后的氯化铜溶液加水稀释);(3)由蓝色变成绿色 。
18.【答案】(1)13.7
(2)继续加入100g硫酸,所以在13.7的基础上继续减少11.2g剩余2.5g,结果是剩余3g,说明硫酸过量,铁完全反应。
100g硫酸对应锌的减少量为13g,
设100g硫酸中溶质的质量为x.
Zn+H2SO4=ZnSO4+H2↑
65 98
13g x
; 解得:x=19.6g;
则硫酸中溶质的质量分数为。
(3)FeSO4、ZnSO4
【解析】(1)在锌、铁和铜三种金属,锌和铁都能和硫酸反应,只有铜不和硫酸反应,所以不断加入硫酸最后剩余的是铜,也就是铜的质量为3g.由于锌铁的活动性是锌比铁活泼,根据金属反应的优先原则,锌先和硫酸反应,等到锌完全后铁才能和硫酸反应,据此分析计算a的值;
(2)根据第1组数据可知,加入100g稀硫酸,固体质量减少13g,即有13g锌完全反应,根据锌和稀硫酸反应的方程式计算出参加反应的硫酸溶质的质量,最后根据计算它的溶质质量分数。
(3)根据前面的分析,确定第2次时参加反应的物质,从而确定溶质种类。
【解答】(1)在锌、铁和铜三种金属,锌和铁都能和硫酸反应,只有铜不和硫酸反应,所以不断加入硫酸最后剩余的是铜,也就是铜的质量为3g.由于锌铁的活动性是锌比铁活泼,根据金属反应的优先原则,锌先和硫酸反应,等到锌完全后铁才能和硫酸反应。
消耗等质量的硫酸,需要锌和铁的质量为65:56,也就是当加入等质量的酸,如果是同种金属,则引起的固体质量变化相等,而现在加入第一次硫酸,引起的质量变化为:50g-37g=13g,而第二次是:37g-24.9g=12.1g,说明第一次加入酸,只有锌参加了反应,第二次是锌和铁参加的反应。
此时如果100g硫酸消耗的铁的质量为 , 而当加入第三次硫酸的时候只有铁和硫酸反应,所以可知固体在24.9g的基础上减少了11.2g,所以a=24.9g-11.2g=13.7g。
(2)综上所述,继续加入100g硫酸,所以在13.7的基础上继续减少11.2g剩余2.5g,结果是剩余3g,说明硫酸过量,铁完全反应。
100g硫酸对应锌的减少量为13g,
设100g硫酸中溶质的质量为x.
Zn+H2SO4=ZnSO4+H2↑
65 98
13g x
; 解得:x=19.6g;
则硫酸中溶质的质量分数为。
(3)第2次反应结束后,锌已经完全反应,而铁没有完全反应,那么溶质为硫酸锌和硫酸亚铁,即 FeSO4、ZnSO4 。
2.2金属的化学性质(1)
A.红热的铁丝在空气中能燃烧
B.根据金属与氧气反应的难易程度,可以初步比较一些金属的活动性
C.各种金属在常温下都能与氧气反应
D.在较高温度下能与氧气反应的金属,在常温下也能与氧气反应
2.铕(Eu)是非常活泼的金属,能与冷水反应,应保存在氩气中。铕与水反应的化学方程式为:Eu+2H2O═Eu(OH)2↓+H2↑,该反应属于( )
A. 化合反应 B. 分解反应C. 置换反应 D. 复分解反应
3.如图所示,分别向甲,乙两支试管中加入形状和大小完全相同的铁片,再向甲中加入植物油,U形玻璃管内为红墨水(开始时两端液面相平),塞上橡皮塞后,放置一段时间。下列说法错误的是( )。
A.植物油用于隔绝氧气和水
B.甲试管中铁片比乙试管中铁片不易生锈
C.U形玻璃管两端的液面变为右低左高
D.U形玻璃管两端的液面变为左低右高
4.下列物质中不能通过金属与硫酸反应得到的是( )
A. FeSO4 B. Al2(SO4)3 C. Fe2(SO4)3D. ZnSO4
5.小科为验证锌、铜、银三种金属的活动性顺序,设计了下列四种方案,其中合理的是( )
A. B.
C. D.
6.能用金属与同一种酸反应制取的化合物是( )
A.CuCl2、AlCl3 B.ZnCl2、MgCl2
C.Fe2(SO4)3、FeSO4 D.NaCl、K2SO4
7.通过实验可以比较铁、铜、银三种金属的活动性强弱。下列装置能够达到实验目的的是( )
A. B.
C. D.
8.将铁丝、铜丝分别伸入盛有同种试剂的两支试管中,能迅速比较出铁、铜金属活动性强弱的是( )
A.蒸馏水 B.稀硫酸 C.硫酸钠溶液 D.氢氧化钠溶液
9.由Ag和另一种金属组成的混合物共8g,将其加入足量的稀硫酸完全反应后,共收集到0.4gH2 , 则另一种金属可能是( )
A. Cu B. Zn C. Mg D. Fe
10.我国发明的新型钛合金,为“奋斗者”号下潜万米海底、从事科考任务解决了材料难题。工业制取金属钛的主要反应式是: ① 2FeTiO3+6C+7Cl2 2FeCl3+2TiCl4+6CO;②2Mg+TiCl4 2MgCl2+Ti 下列说法合理的是( )
A.FeTiO3属于氧化物 B.钛合金是一种金属单质
C.反应②属于置换反应 D.TiCl4中钛元素和氯元素的质量比为96:71
11.某同学为确认所回收易拉罐的主要成分是铝还是铁,剪取金属片打磨后,设计了如图所示的两种不同方法进行检验。这样设计的依据是( ) 。
A.活泼金属易与氧气反应
B.铁与铝有不同的物理性质
C.排在氢前面的金属可以把酸中的氢置换出来
D.活动性较强的金属可把活动性较弱的金属从它的盐溶液中置换出来
12.用等质量的锌、铁、镁三种金属分别与三份溶质质量分数相同的稀盐酸充分反应。产生氢气的质量与反应时间的关系如图所示。下列说法中正确的是( )
反应后可能没有剩余的金属是锌和铁
B. 反应后不一定有剩余的金属是镁
C. 根据图像分析,金属镁产生氢气最多
D. 曲线X、Y、Z分别表示锌、铁、镁的反应情况
13.为探究镁、铁、铜三种金属的活动性顺序,小涛设计了如图所示的实验方案。请完成下列问题:
(1)同学们经讨论后认为该方案可以优化,________试管的实验是多余的;
(2)去掉多余的实验,同学们将另两只试管中反应后的物质倒入同一大烧杯中,一段时间后过滤,向滤渣中加入稀硫酸,有气泡产生,则组成滤渣的所有可能是 ________。
14.2021年3月,四川三星堆遗址进行了新一轮考古发掘。至今三星堆已出土了黄金面具、青铜纵目面具等一批珍贵文物,如图。
(1)出土的黄金面具仍金光灿灿,而青铜纵目面具已锈迹斑斑,这说明金的活动性比铜________(选填“强”或“弱”)。
(2)古代制作青铜器的铜来源于铜矿,如黄铜矿。黄铜矿的主要成分为二硫化亚铁铜 (CuFeS2),其中铁元素和铜元素均为+2价,硫元素的化合价为 ________。
(3)应用碳-14测出三星堆遗址距今3000年左右,碳-12和碳-14是碳元素的两种同位素原子,它们的主要区别是原子核中________ 数不同。
15.垃圾的分类回收再利用越来越受社会的关注。下图是某工厂处理含铜垃圾的生产流程:
(1)根据相关现象可知加入的A单质可能是________。
(2)若在回收含铜垃圾中发现混有金属铝,它________(填“会”或“不会”)出现在最终得到的红色粉末中。
16.某科学兴趣小组为研究不同金属跟稀硫酸反应的快慢,将甲、乙、丙、丁四种金属片分别与相同体积、相同溶质质量分数的稀硫酸反应,观察30秒内产生的氢气泡的多少,记录在下表中。(“+”越多表示产生的气泡越多)
金属 甲 乙 丙 丁
氢气泡的多少 ++ ++++ +++ +
(1)从实验结果可看出,甲、乙、丙、丁四种金属与稀硫酸反应由快到慢的顺序是________。
(2)要获得令人信服的实验结论,除了稀硫酸的体积和溶质质量分数必须相同外,4种金属的________也必须相同。
17.含铜离子的盐溶液一般呈蓝色,但老师在做氧化铜粉末与新配制的稀盐酸反应实验时,反应后的溶液却是绿色的,这是怎么回事呢 他们对此进行了科学探究:
猜想一:生成物中除铜离子外可能还有其它离子;
猜想二:可能与铜离子浓度偏大有关;
(1)为了验证猜想一,同学们先查阅了常见离子的颜色,知道了亚铁离子的颜色为浅绿色。于是,他们向反应后的溶液中加入金属锌,结果在锌表面只生成红色固体,则证明猜想一是________。
(2)为了验证猜想二,上网进行了查询,发现氯化铜溶液的颜色与溶液的浓度有关,见下表。那么,实验若要得到蓝色的氯化铜溶液,老师可采取的措施是:________。
溶液浓度 溶液很浓 溶液较浓 溶液很稀
溶液颜色 黄色 绿色 蓝色
(3)进一步查阅网上资料可知:氯化铜溶液的颜色变化的真正原因是氯离子的浓度不同产生的。为了验证上述资料是否正确。小宁同学向反应后蓝色的溶液中加入NaCI固体, 溶液出现________,则该资料是正确的。
18.某金属混合物的主要成分是锌、铁和铜,课外兴趣小组将500克稀硫酸溶液不断加到50克金属混合物中得到如下数据:
次数 第1次 第2次 第3次 第4次 第5次
加入稀硫酸溶液的质量/克 100 100 100 100 100
剩余固体的质量/克 37 24.9 a 3 3
(1)表格中“a”的值为________;
(2)其所用稀硫酸溶液的溶质质量分数为多少?
(3)第2次反应结束后,溶液中含有的溶质有________。
答案及解析
1.【答案】B
【解析】A.铁丝在空气中不能燃烧,在氧气中能燃烧,不符合题意;
B.根据金属与氧气反应的难易程度,可以初步比较一些金属的活动性,符合题意;
C.不是所有金属常温下都能与氧气反应,不符合题意;
D.在较高温度下能与氧气反应的金属,在常温下不一定与氧气反应,不符合题意;
2.【答案】 C
【解析】根据反应物和生成物的种类和种数,确定化学反应的基本类型。
【解答】根据方程式 Eu+2H2O═Eu(OH)2↓+H2↑ 可知,反应物和生成物都由单质和化合物组成,则该反应为置换反应,故C正确,而A、B、D错误。
3.【答案】C
【解析】根据甲中铁不与氧气和水接触,不生锈,乙中铁生锈时会使压强减小分析。
A、植物油可以隔绝氧气和水,不符合题意;
B、甲试管中铁片不与水和氧气接触,比乙试管中铁片不易生锈 ,不符合题意;
C、甲试管中铁比乙试管中不易生锈,当乙试管中铁生锈时装置内压强减小,U形管内液面会出现左低右高的现象,符合题意;
D、U形玻璃管两端的液面变为左低右高 ,不符合题意;
4.【答案】 C
【解析】根据酸的性质分析判断。
【解答】AC.铁和稀硫酸反应,生成硫酸亚铁和氢气,故A不合题意,C符合题意;
B.铝和稀硫酸反应,生成硫酸铝和氢气,故B不合题意;
D.锌和稀硫酸反应,生成硫酸锌和氢气,故D不合题意。
5.【答案】 D
【解析】在金属活动性顺序表中,只有排在前面的金属才能将后面的金属从它的盐溶液中置换出来,据此分析判断。
【解答】A.锌和铜都能与硝酸银反应,只能说明它们的活动性比银强,但是不能判断锌和铜活动性的大小,故A错误;
B.银和硫酸锌不反应,则锌的活动性大于银;铜和硝酸银反应,则活动性铜大于银,但是无法比较锌和铜的活动性大小,故B错误;
C.银和铜都不能与硫酸锌反应,不能比较二者的活动性大小,故C错误;
D.锌和硫酸铜反应,则锌的活动性大于铜;铜和硝酸银反应,则铜的活动性大于银,那么三种的金属活动性强弱:锌>铜>银,故D正确。
6.【答案】B
【解析】铜的活动性较弱,与酸不反应,A错
铁与酸反应生成亚铁离子,C错
钠与钾活动性很强,能与水反应生成碱再与酸反应
7.【答案】 D
【解析】根据金属能否与酸或盐溶液反应,从而证明金属活动性强弱分析。
【解答】A、银和铜都不与稀硫酸反应,只有铁能与稀硫酸反应,只能证明铁的活动性最强,不能证明银和铜的活动性强弱,不符合题意;
B、银和铜都不能与硫酸亚铁溶液反应,只能证明铁的活动性最强,不能证明银和铜的活动性强弱,不符合题意;
C、银和铜都不能与硫酸亚铁溶液反应,只能证明铁的活动性最强,不能证明银和铜的活动性强弱,不符合题意;
D、铁能与硫酸铜反应,银不能与硫酸铜反应,可证明铁的活动性大于铜,铜的活动性大于银,可证明三金属活动性强弱,符合题意;
8.【答案】B
【解析】根据铁与铜不能与水、硫酸钠、氢氧化钠反应,不能比较活动性强弱,但能用加稀硫酸来比较分析。
A、铁铜都不能与水反应,无法比较铁、铜的活动性强弱,不符合题意;
B、铁能与稀硫酸反应,铜不能与稀硫酸反应,可以比较铁的活动性大于铜,符合题意;
C、铁和铜都不能与硫酸钠反应,无法比较铁、铜的活动性强弱,不符合题意;
D、铁和铜都不能与氢氧化钠溶液反应,无法比较铁、铜的活动性强弱,不符合题意;
9.【答案】 C
【解析】根据银、铜不与酸反应,而8克锌或铁产生氢气质量均小于0.4克,镁大于0.4克分析。
【解答】银、铜不与酸反应,由方程可知,锌、镁、铁分别取8克时,产生氢气质量如下:
Zn --H2 Mg --H2 Fe --H2
65 2 34 2 56 2
8g 0.25g 8g 0.67g 8g 0.29g
由Ag和另一种金属组成的混合物共8g,将其加入足量的稀硫酸完全反应后,共收集到0.4gH2 , 则一定含有镁;
10.【答案】C
【解析】A、根据氧化物由两种元素组成其中一种为氧元素的化合物分析;
B、根据合金属于混合物分析;
C、根据置换反应反应物和生成物都一种单质和一种化合物分析;
D、根据元素质量比为相对原子质量×原子个数之比分析。
【解答】A、 FeTiO3由三种元素组成,不属于氧化物 ,不符合题意;
B、钛合金是混合物,不符合题意;
C、反应②属于置换反应反应物和生成物都一种单质和一种化合物,属于置换反应,符合题意;
D、TiCl4中钛元素和氯元素的质量比为48:142 ,不符合题意;
11.【答案】 D
【解析】根据金属能否与盐反应是利用活动性较强的金属可把活动性较弱的金属从它的盐溶液中置换出来分析 。
【解答】铝的活动性大于锌和铁,能与氯化锌溶液、氯化亚铁溶液反应,铁的活动性小于锌,不能与氯化锌溶液反应,所以题中设计依据是活动性较强的金属可把活动性较弱的金属从它的盐溶液中置换出来 ;
12.【答案】 A
【解析】根据三种金属的活动性顺序和质量守恒定律分析。
【解答】根据金属活动性顺序表可知,三种金属的活动性顺序:镁>锌>铁,因此与酸反应的快慢为:镁>锌>铁。根据图片可知,曲线X、Y、Z分别表示镁、锌和铁的反应情况,故D错误;
根据图片可知,金属铁生成的氢气质量最多,故C错误;
根据反应的化学方程式可知,生成2份氢气,需要消耗镁24份、铁56份、锌64份,即消耗金属的质量大小:镁<铁<锌。镁和锌生成氢气的质量相等,即反应的稀盐酸的质量相等,那么二者的质量之比为:24:64,因此如果有一种金属剩余,那么就是金属镁,故B错误;
当酸的质量足够时,质量相等的锌和铁,生成氢气的质量铁大于锌,因此反应后可能没有剩余的金属是铁和锌,故A正确。
13.【答案】(1)丙 (2)Cu、Fe和Cu、Fe、Mg
【解析】(1)根据金属能否与盐溶液反应验证金属活动性强弱分析;
(2)根据铜不能与硫酸反应,铁和镁能与硫酸反应,滤渣中固体存在的顺序为先强后强分析。
【解答】(1)甲试管可得出镁的活动性大于铁,乙试管可得出铁的活动性大于铜,甲乙试管即可得出镁、铁、铜的活动性顺序,丙可得出镁的活动性大于铜,该实验多余;
(2) 去掉多余的实验,将另两只试管中反应后的物质倒入同一大烧杯中,一段时间后过滤,向滤渣中加入稀硫酸,有气泡产生,说明滤渣中一定有铁和铜,可能有镁,则组成滤渣的所有可能是 Cu、Fe和Cu、Fe、Mg。
14.【答案】 (1)弱(2)-2(3)中子
【解析】(1)根据金的活动性比铜弱分析;
(2)根据化合物中元素化合价代数和为0分析;
(3)根据同种元素中不同种原子中子数不同分析。
【解答】(1) 出土的黄金面具仍金光灿灿,而青铜纵目面具已锈迹斑斑,说明铜的发生了缓慢氧化,而金没有,即金的活动性比铜弱;
(2) 二硫化亚铁铜 (CuFeS2),其中铁元素和铜元素均为+2价,根据化合物中元素化合价代数和为0可知,硫元素的化合价为-2价;
(3) 碳-12和碳-14是碳元素的两种同位素原子,它们的主要区别是原子核中的中子数不同;
故答案为:(1)弱;(2)-2;(3)中子。
15.【答案】 (1)铁(或Fe)(2)不会
【解析】(1)根据铁能与铜盐反应生成浅绿色亚铁盐溶液和铜分析;
(2)根据铁的活动性小于铝,所以不能置换出铝分析。
【解答】(1)蓝色溶液中加入A单质,得到红色固体和浅绿色溶液,则A为铁;
(2) 若在回收含铜垃圾中发现混有金属铝,则铝与硫酸反应会生成硫酸铝,铁的活动性小于铝,所以不能置换出铝,铝不会出现在最终得到的红色粉末中。
故答案为:(1)铁(或Fe);(2)不会。
16.【答案】(1)乙>丙>甲>丁 (2)表面积
【解析】根据题目中金属与酸反应产生气泡多少决定反应快慢及物质的接触面积影响反应速率分析。
(1)由所给现象可知,金属与酸反应时乙产生气泡最多,其次是丙,其次是甲,丁产生气泡最少,所以四种金属与稀硫酸反应由快到慢的顺序是乙>丙>甲>丁;
(2)对比实验要求变量唯一,该实验除了稀硫酸的体积和溶质质量分数必须相同外,4种金属的表面积也必须相同
17.【答案】 (1)错误的
(2)稀释原盐酸溶液(或减少加入的氧化铜的质量、对实验后的氯化铜溶液加水稀释)
(3)由蓝色变成绿色
【解析】(1)根据锌能与亚铁盐发生反应分析;
(2)根据溶液浓度影响溶液颜色可通过加水稀释来验证分析;
(3)根据氯离子浓度影响溶液颜色可通过增加氯离子来验证分析。
【解答】(1)锌的活动性大于铁,若溶液中有亚铁离子则加入锌后会置换出铁,但现象是锌表面只生成红色固体,说明溶液中没有亚铁离子,猜想一错误;
(2)由资料可知氯化铜溶液的颜色与溶液的浓度有关,则可采取稀释原盐酸溶液观察颜色的变化来证明猜想的正确性;
(3)要证明氯化铜溶液的颜色变化的真正原因是氯离子的浓度不同产生,可向溶液中加入其它含氯离子的物质,通过颜色的转变来实现;
故答案为:(1)错误的;(2)稀释原盐酸溶液(或减少加入的氧化铜的质量、对实验后的氯化铜溶液加水稀释);(3)由蓝色变成绿色 。
18.【答案】(1)13.7
(2)继续加入100g硫酸,所以在13.7的基础上继续减少11.2g剩余2.5g,结果是剩余3g,说明硫酸过量,铁完全反应。
100g硫酸对应锌的减少量为13g,
设100g硫酸中溶质的质量为x.
Zn+H2SO4=ZnSO4+H2↑
65 98
13g x
; 解得:x=19.6g;
则硫酸中溶质的质量分数为。
(3)FeSO4、ZnSO4
【解析】(1)在锌、铁和铜三种金属,锌和铁都能和硫酸反应,只有铜不和硫酸反应,所以不断加入硫酸最后剩余的是铜,也就是铜的质量为3g.由于锌铁的活动性是锌比铁活泼,根据金属反应的优先原则,锌先和硫酸反应,等到锌完全后铁才能和硫酸反应,据此分析计算a的值;
(2)根据第1组数据可知,加入100g稀硫酸,固体质量减少13g,即有13g锌完全反应,根据锌和稀硫酸反应的方程式计算出参加反应的硫酸溶质的质量,最后根据计算它的溶质质量分数。
(3)根据前面的分析,确定第2次时参加反应的物质,从而确定溶质种类。
【解答】(1)在锌、铁和铜三种金属,锌和铁都能和硫酸反应,只有铜不和硫酸反应,所以不断加入硫酸最后剩余的是铜,也就是铜的质量为3g.由于锌铁的活动性是锌比铁活泼,根据金属反应的优先原则,锌先和硫酸反应,等到锌完全后铁才能和硫酸反应。
消耗等质量的硫酸,需要锌和铁的质量为65:56,也就是当加入等质量的酸,如果是同种金属,则引起的固体质量变化相等,而现在加入第一次硫酸,引起的质量变化为:50g-37g=13g,而第二次是:37g-24.9g=12.1g,说明第一次加入酸,只有锌参加了反应,第二次是锌和铁参加的反应。
此时如果100g硫酸消耗的铁的质量为 , 而当加入第三次硫酸的时候只有铁和硫酸反应,所以可知固体在24.9g的基础上减少了11.2g,所以a=24.9g-11.2g=13.7g。
(2)综上所述,继续加入100g硫酸,所以在13.7的基础上继续减少11.2g剩余2.5g,结果是剩余3g,说明硫酸过量,铁完全反应。
100g硫酸对应锌的减少量为13g,
设100g硫酸中溶质的质量为x.
Zn+H2SO4=ZnSO4+H2↑
65 98
13g x
; 解得:x=19.6g;
则硫酸中溶质的质量分数为。
(3)第2次反应结束后,锌已经完全反应,而铁没有完全反应,那么溶质为硫酸锌和硫酸亚铁,即 FeSO4、ZnSO4 。
2.2金属的化学性质(1)
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
