高中化学人教版(2019)必修第一册4.2.2 元素周期律(共19张ppt)
文档属性
| 名称 | 高中化学人教版(2019)必修第一册4.2.2 元素周期律(共19张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-06 21:11:05 | ||
图片预览

文档简介
(共19张PPT)
元素周期律
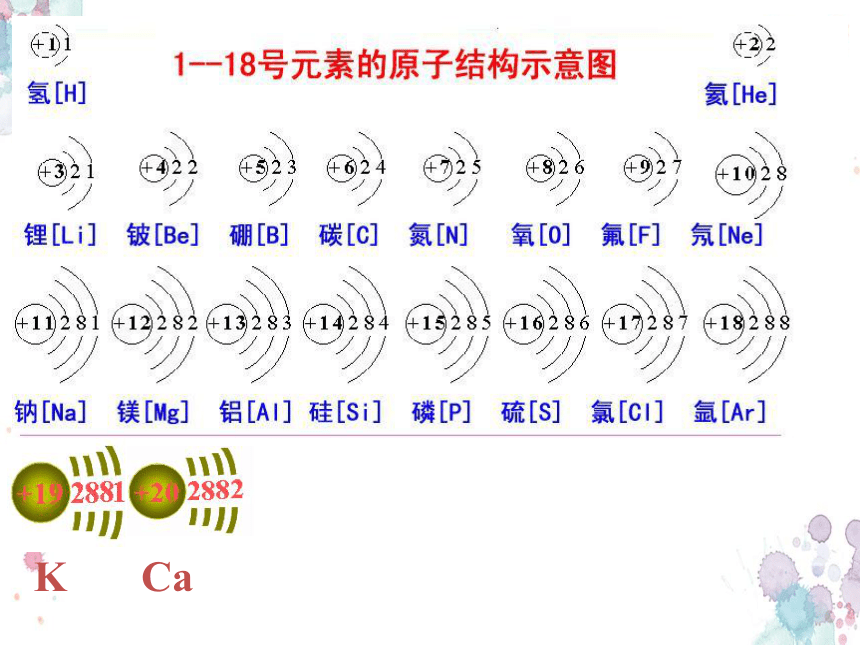
Ca
K
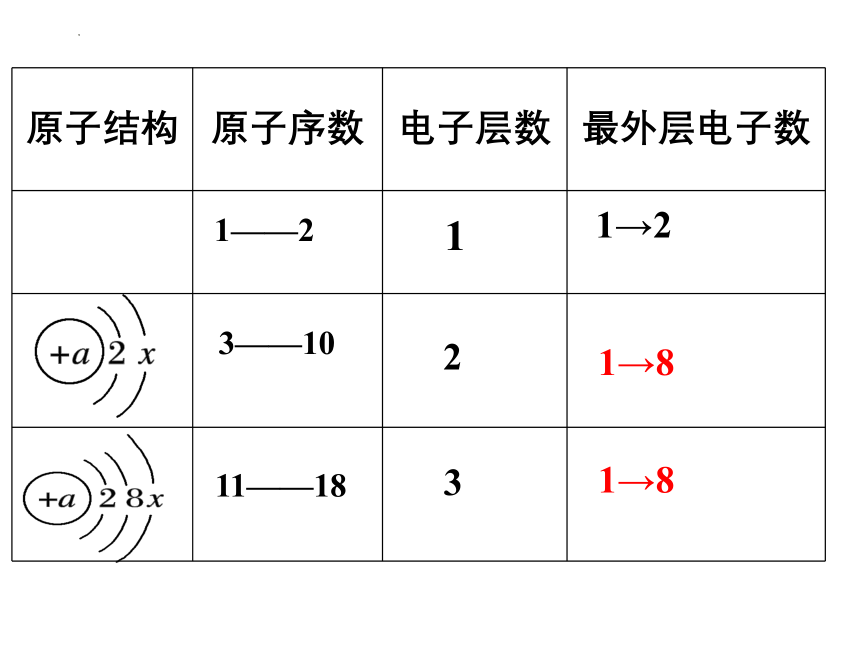
原子结构 原子序数 电子层数 最外层电子数
1——2
3——10
11——18
1
2
3
1→2
1→8
1→8
5
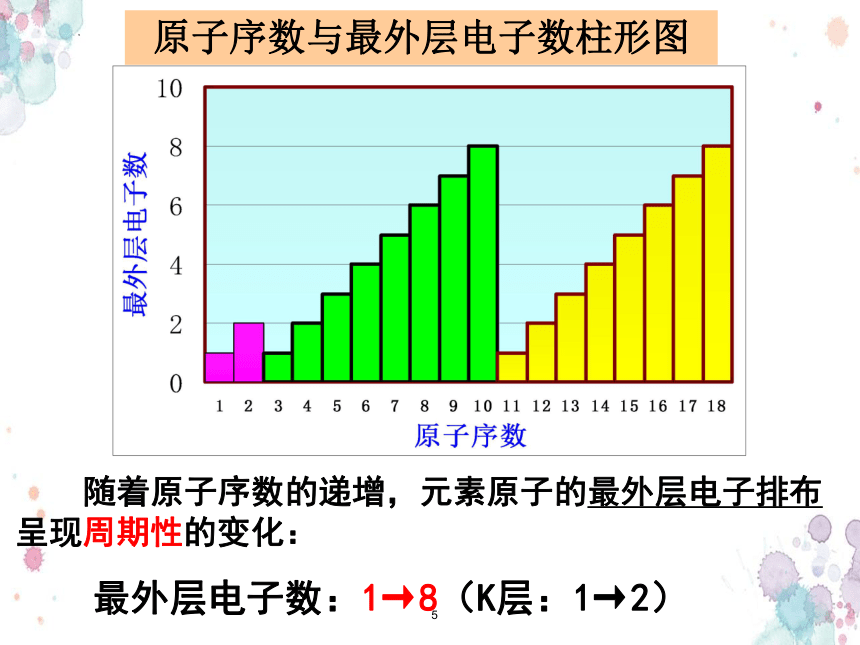
随着原子序数的递增,元素原子的最外层电子排布呈现周期性的变化:
最外层电子数:1→8(K层:1→2)
原子序数与最外层电子数柱形图
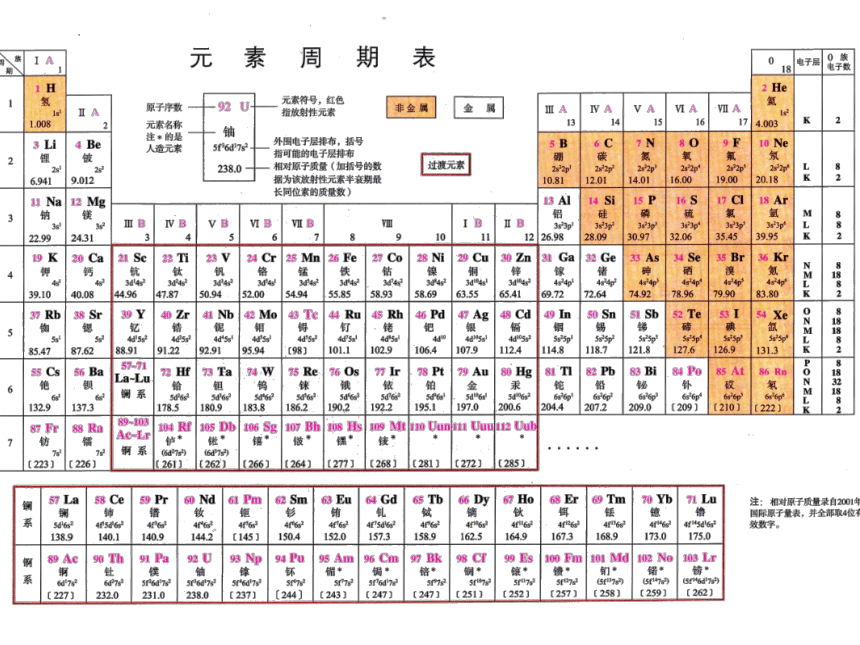
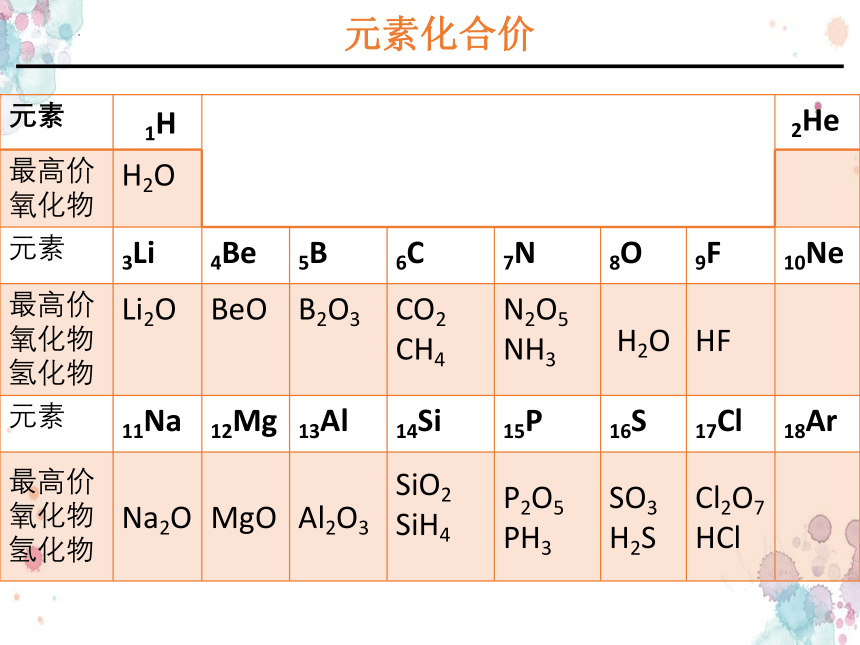
元素化合价
元素 1H 2He
最高价氧化物 H2O
元素 3Li 4Be 5B 6C 7N 8O 9F 10Ne
最高价氧化物氢化物 Li2O BeO B2O3 CO2 CH4 N2O5 NH3 H2O HF
元素 11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar
最高价氧化物 氢化物 Na2O MgO Al2O3 SiO2 SiH4 P2O5 PH3 SO3 H2S Cl2O7 HCl
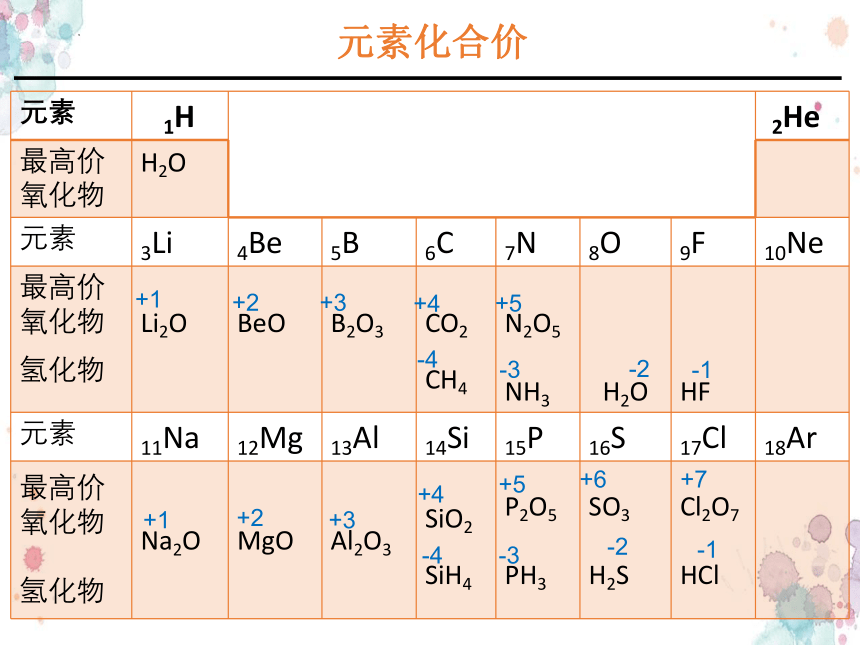
元素化合价
元素 1H 2He
最高价氧化物 H2O
元素 3Li 4Be 5B 6C 7N 8O 9F 10Ne
最高价氧化物 氢化物 Li2O BeO B2O3 CO2 CH4 N2O5 NH3 H2O HF
元素 11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar
最高价氧化物 氢化物 Na2O MgO Al2O3 SiO2 SiH4 P2O5 PH3 SO3 H2S Cl2O7 HCl
+1
+2
+3
+4
-4
+5
-3
-2
-1
+1
+2
+3
+4
-4
+5
-3
+6
-2
+7
-1
元素主要化合价的周期性变化
最高正价=最外层电子数(主族元素)
最高正价+|最低负价|=8
注意:金属只有正价,O无最高正价、F无正价。
主要化合价
随着原子序数的递增,元素化合价呈现周期性的变化。
第一行: +1→0
第二行: 最高正价:+1→+5;
最低负价:-4→-1
第三行: 最高正价:+1→+7;
最低负价:-4→-1
9
原子序数与原子半径
随着原子序数的递增,元素原子半径呈现周期性的变化。
同行,从左到右递减;(稀有气体除外)
同竖,从上到下递增。
随着原子序数核电荷数递增:
①原子最外层电子排布呈周期性变化
②原子半径呈周期性变化
③元素主要化合价呈周期性变化
元素的性质随着元素原子序数的递增而呈周期性的变化,这个规律叫做元素周期律。
元素性质的周期性变化的实质是:元素原子的核外电子排布的周期性变化。
小 结
元素周期律的实质是什么?
比较微粒半径大小
一看电子层数
电子层数越多,半径越大(最外层电子数相同时)。
如:r(F) r(Cl) r(Br) r(I)
r(F-) r(Cl-) r(Br-) r(I-)
电子层数相同时,原子序数越大,半径越小。
如r(Na) r(Mg) r(Al) r(S) r(Cl)
r(S2-) r(Cl-) r(K+) r(Ca2+)
如r(Na+) r(Na),r(Cl) r(Cl-)
< < <
< < <
> > > >
> > >
<
<
① 层多径大
② 层同时,序大径小
③同种元素,价高径小
考点一
12
小组讨论
比较下列微粒半径的大小,从大到小排列。
1、P S O F
2、Li H K Na
3、Na+ Mg2+ O2- Al3+
4、S2- Cl- Na+ Al3+
P>S>O>F
K>Na>Li>H
O2- >Na+ > Mg2+ >Al3+
S2- > Cl- > Na+ > Al3+
考点二 元素化合价规律
3、对于主族元素:
最高正化合价 = 最外层电子数(O、F除外)
最低负化合价 = 最外层电子数-8
最高正化合价 + 最低负化合价 = 8
1、金属只有正价,非金属有正价和负价
(O无最高正价、F无正价);
2、稀有气体化学性质不活泼,看作0价
练习:
某主族元素R原子最外层有6个电子,则其最高价含氧酸的钠盐的通式是( )
A. Na2RO3 B.Na3RO3
C.NaRO3 D.Na2RO4
D
1、原子半径由小到大,且最高正价依次降低的是 A. Al、Mg、Na B. N、O、F
C. Ar、Cl、S D. Al、P、Si
2、元素性质随着原子序数的递增呈周期性变化的原因是( )
A.元素原子的核外电子排布呈周期性变化
B.元素原子的原子半径呈周期性变化
C.元素的化合价呈周期性变化
D.元素原子的电子层数呈周期性变化
A
A
当堂训练
3、填空题
(1)在元素周期表中,除稀有气体外,原子
半径从左到右依次________;从上到下依
次_______(填增大或者减小)
(2)比较下列粒子半径大小关系。
Si_____C S2-______Cl-
(3)Cl-的核外电子数为_____ , 核电荷数为
_____ , 电子层数为_______,离子结构示
意图为_______
减小
增大
>
>
18
17
3
4.试比较下列微粒半径大小(填“>”或“<”)
(1)r(Na) r(Al) r(P) r(Cl)
(2)r(F) r(Cl) r(Br) r(I),
r(Li) r(Na) r(K),
<
<
<
<
<
>
>
>
;
(3) r(Na) r(O), r(Al) r(F)
(4) r(N3-) r(O2-) r(F-)
r(Na+)___r(Mg2+)__ r(Al3+)
r(S2-) r(Cl-) r(K+) r(Ca2+)
>
>
>
>
>
>
>
>
>
(5) r(F-) r(Cl-) r(Br-) r(I-),
r(Li+) r(Na+) r(K+)
(6) r(Na) r(Na+),r(Cl) r(Cl-)
(7) r(Fe) r(Fe2+) r(Fe3+)
<
>
<
<
<
<
<
>
>
元素周期律
Ca
K
原子结构 原子序数 电子层数 最外层电子数
1——2
3——10
11——18
1
2
3
1→2
1→8
1→8
5
随着原子序数的递增,元素原子的最外层电子排布呈现周期性的变化:
最外层电子数:1→8(K层:1→2)
原子序数与最外层电子数柱形图
元素化合价
元素 1H 2He
最高价氧化物 H2O
元素 3Li 4Be 5B 6C 7N 8O 9F 10Ne
最高价氧化物氢化物 Li2O BeO B2O3 CO2 CH4 N2O5 NH3 H2O HF
元素 11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar
最高价氧化物 氢化物 Na2O MgO Al2O3 SiO2 SiH4 P2O5 PH3 SO3 H2S Cl2O7 HCl
元素化合价
元素 1H 2He
最高价氧化物 H2O
元素 3Li 4Be 5B 6C 7N 8O 9F 10Ne
最高价氧化物 氢化物 Li2O BeO B2O3 CO2 CH4 N2O5 NH3 H2O HF
元素 11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar
最高价氧化物 氢化物 Na2O MgO Al2O3 SiO2 SiH4 P2O5 PH3 SO3 H2S Cl2O7 HCl
+1
+2
+3
+4
-4
+5
-3
-2
-1
+1
+2
+3
+4
-4
+5
-3
+6
-2
+7
-1
元素主要化合价的周期性变化
最高正价=最外层电子数(主族元素)
最高正价+|最低负价|=8
注意:金属只有正价,O无最高正价、F无正价。
主要化合价
随着原子序数的递增,元素化合价呈现周期性的变化。
第一行: +1→0
第二行: 最高正价:+1→+5;
最低负价:-4→-1
第三行: 最高正价:+1→+7;
最低负价:-4→-1
9
原子序数与原子半径
随着原子序数的递增,元素原子半径呈现周期性的变化。
同行,从左到右递减;(稀有气体除外)
同竖,从上到下递增。
随着原子序数核电荷数递增:
①原子最外层电子排布呈周期性变化
②原子半径呈周期性变化
③元素主要化合价呈周期性变化
元素的性质随着元素原子序数的递增而呈周期性的变化,这个规律叫做元素周期律。
元素性质的周期性变化的实质是:元素原子的核外电子排布的周期性变化。
小 结
元素周期律的实质是什么?
比较微粒半径大小
一看电子层数
电子层数越多,半径越大(最外层电子数相同时)。
如:r(F) r(Cl) r(Br) r(I)
r(F-) r(Cl-) r(Br-) r(I-)
电子层数相同时,原子序数越大,半径越小。
如r(Na) r(Mg) r(Al) r(S) r(Cl)
r(S2-) r(Cl-) r(K+) r(Ca2+)
如r(Na+) r(Na),r(Cl) r(Cl-)
< < <
< < <
> > > >
> > >
<
<
① 层多径大
② 层同时,序大径小
③同种元素,价高径小
考点一
12
小组讨论
比较下列微粒半径的大小,从大到小排列。
1、P S O F
2、Li H K Na
3、Na+ Mg2+ O2- Al3+
4、S2- Cl- Na+ Al3+
P>S>O>F
K>Na>Li>H
O2- >Na+ > Mg2+ >Al3+
S2- > Cl- > Na+ > Al3+
考点二 元素化合价规律
3、对于主族元素:
最高正化合价 = 最外层电子数(O、F除外)
最低负化合价 = 最外层电子数-8
最高正化合价 + 最低负化合价 = 8
1、金属只有正价,非金属有正价和负价
(O无最高正价、F无正价);
2、稀有气体化学性质不活泼,看作0价
练习:
某主族元素R原子最外层有6个电子,则其最高价含氧酸的钠盐的通式是( )
A. Na2RO3 B.Na3RO3
C.NaRO3 D.Na2RO4
D
1、原子半径由小到大,且最高正价依次降低的是 A. Al、Mg、Na B. N、O、F
C. Ar、Cl、S D. Al、P、Si
2、元素性质随着原子序数的递增呈周期性变化的原因是( )
A.元素原子的核外电子排布呈周期性变化
B.元素原子的原子半径呈周期性变化
C.元素的化合价呈周期性变化
D.元素原子的电子层数呈周期性变化
A
A
当堂训练
3、填空题
(1)在元素周期表中,除稀有气体外,原子
半径从左到右依次________;从上到下依
次_______(填增大或者减小)
(2)比较下列粒子半径大小关系。
Si_____C S2-______Cl-
(3)Cl-的核外电子数为_____ , 核电荷数为
_____ , 电子层数为_______,离子结构示
意图为_______
减小
增大
>
>
18
17
3
4.试比较下列微粒半径大小(填“>”或“<”)
(1)r(Na) r(Al) r(P) r(Cl)
(2)r(F) r(Cl) r(Br) r(I),
r(Li) r(Na) r(K),
<
<
<
<
<
>
>
>
;
(3) r(Na) r(O), r(Al) r(F)
(4) r(N3-) r(O2-) r(F-)
r(Na+)___r(Mg2+)__ r(Al3+)
r(S2-) r(Cl-) r(K+) r(Ca2+)
>
>
>
>
>
>
>
>
>
(5) r(F-) r(Cl-) r(Br-) r(I-),
r(Li+) r(Na+) r(K+)
(6) r(Na) r(Na+),r(Cl) r(Cl-)
(7) r(Fe) r(Fe2+) r(Fe3+)
<
>
<
<
<
<
<
>
>
