鲁科版(2019)高中化学必修第一册 第一章微项目探秘膨松剂课件(65张ppt)
文档属性
| 名称 | 鲁科版(2019)高中化学必修第一册 第一章微项目探秘膨松剂课件(65张ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-06 21:37:53 | ||
图片预览










文档简介
(共67张PPT)
微项目
探秘膨松剂——体会研究物质性质的
方法和程序的实用价值
1.膨松剂
膨松剂是在食品加工过程中加入的,能使面胚发起形成多孔组织,从而使食品具有柔软或酥脆特点的一类物质。
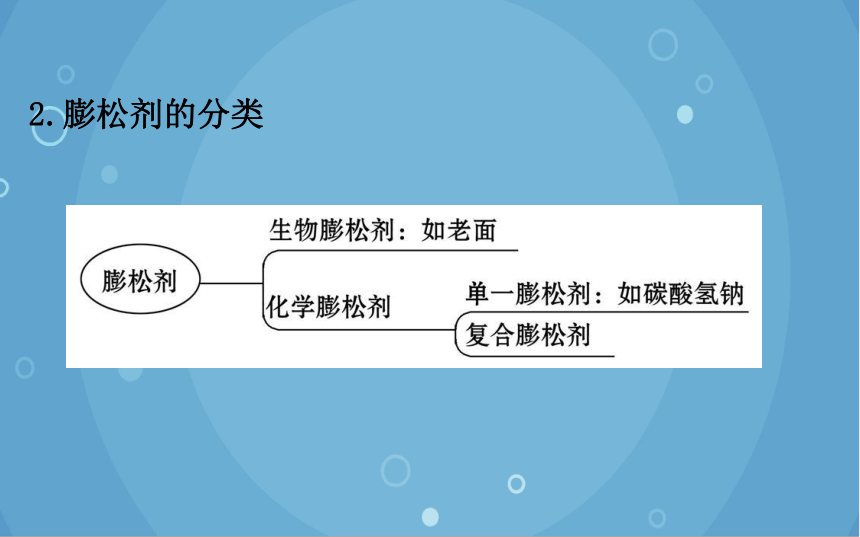
2.膨松剂的分类
【情境·思考】
老面是指发面的面种子,北方叫面引子,也有的地方叫
面头(酵头)。就是发面蒸馒头时剩下一小团面,由于里
面有很多酵母菌,下次发面的时候作为菌种用。这种用
上次发酵的面做菌种发面蒸的馒头就叫老面馒头。老
面在保存过程中往往会同时有乳酸菌存在,发的时间稍
长就会有独特的酸味出现,故用老面发面蒸馒头时需要加食用碱来中和其酸味。
老面能使馒头变得松软多孔,其原理是什么
提示:面团在酵母菌以及其他一定数量和种类的微生物的共同作用下发生反应,生成二氧化碳、乳酸、醋酸、乙醇等物质,其中二氧化碳能使面团呈海绵状。
项目活动1 探究碳酸氢钠的蓬松原理
上面两种蒸馒头的方法,均用到了碳酸氢钠,为什么效果不同
【活动探究】
1.碳酸氢钠在发面中的作用原理推测
(1)碳酸氢钠受热分解,生成气体。
(2)碳酸氢钠与酸反应,生成气体。
2.实验用品
碳酸氢钠、盐酸、澄清石灰水;
试管、酒精灯、铁架台(带铁夹)或试管夹,带导管的橡胶塞、药匙,胶头滴管,火柴。
3.实验方案
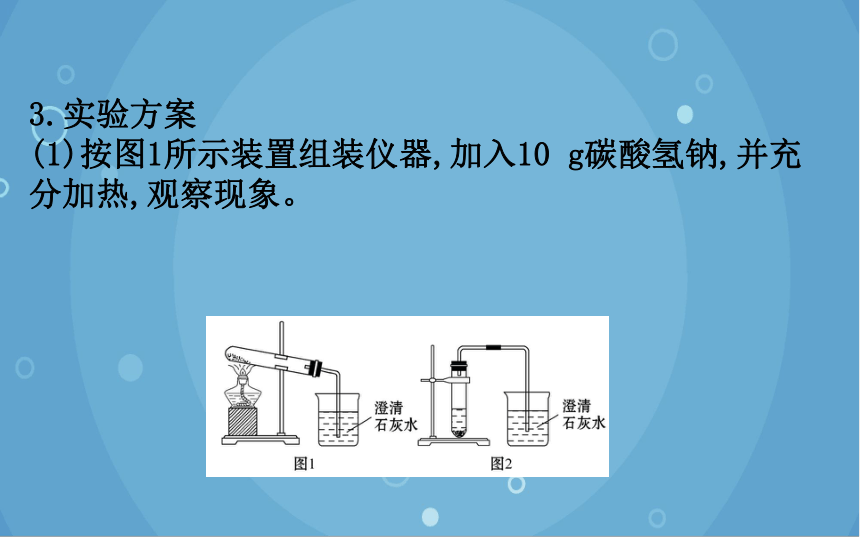
(1)按图1所示装置组装仪器,加入10 g碳酸氢钠,并充分加热,观察现象。
(2)将充分加热后的物质取下,冷却至室温,更换带有导气管的橡胶塞,如图2所示,向试管中加入足量盐酸,观察现象。
(3)若向图2中加入10 g碳酸氢钠,再加入足量盐酸,观察现象。
4.记录实验现象
实验 现象
实验(1) 加热一段时间后,澄清石灰水变浑浊
实验(2) 澄清石灰水变浑浊
实验(3) 加入盐酸后,澄清石灰水迅速变浑浊,且浑浊程度比实验(1)、实验(2)大
【思考讨论】
(1)在发面时,只加入碳酸氢钠效果好还是加入碳酸氢钠和食醋效果好 说明理由。
提示:加入碳酸氢钠和食醋效果好。由实验(3)可知碳酸氢钠能与酸反应,产生CO2较迅速且多。
(2)实验(1)中碳酸氢钠分解后产生的产物中有Na2CO3,只用碳酸钠能达到发面的效果吗
提示:不能。根据实验(1),充分加热后,再进行实验(2)仍有CO2生成,说明Na2CO3无法在加热的条件下分解,产生CO2。
【探究总结】
1.Na2CO3与NaHCO3的物理性质
名称 碳酸钠 碳酸氢钠
化学式 Na2CO3 NaHCO3
俗名 纯碱或苏打 小苏打
颜色、状态 白色粉末 细小白色晶体
水溶性 易溶于水 水中易溶,比Na2CO3的溶解度小
2.Na2CO3与NaHCO3的化学性质
(1)热稳定性。
①Na2CO3性质稳定,受热难分解。
②NaHCO3性质不稳定,受热易分解,化学方程式
2NaHCO3 Na2CO3+CO2↑+H2O。
△
====
(2)与酸(足量盐酸)反应。
①Na2CO3:Na2CO3+2HCl====2NaCl+CO2↑+H2O。
②NaHCO3:NaHCO3+HCl====NaCl+CO2↑+H2O。
(3)碱性:Na2CO3与NaHCO3溶液均显碱性,且相同情况下前者碱性大。
(4)与碱反应。
①与NaOH溶液
②与石灰水(足量)
3.Na2CO3与NaHCO3的相互转化
Na2CO3 NaHCO3
【迁移应用】
1.(2019·冀州高一检测)为使以面粉为原料的面包松软可口,通常用碳酸氢钠作膨松剂,其原因是 ( )
①热稳定性差 ②增加甜味 ③产生二氧化碳
④提供钠离子
A.②③ B.①③ C.①④ D.③④
【解析】选B。为使以面粉为原料的面包松软可口,通常用碳酸氢钠作膨松剂,这是由于碳酸氢钠不稳定,加热会发生分解反应,方程式是2NaHCO3 Na2CO3
+CO2↑+H2O,分解产生CO2气体从面团中逸出,从而导致面包松软可口,故正确的说法是①③。
△
====
2.胃酸过多又称作胃酸过高,是胃肠疾病的常见症状之一。适度的胃酸可以帮助消化,但如果胃酸过多就会伤及胃、十二指肠黏膜,造成胃溃疡或十二指肠溃疡等疾病,治疗胃酸过多可以用碳酸氢钠。
请用化学方程式解释碳酸氢钠可以治疗胃酸过多的原因。
提示:胃酸的主要成分是盐酸。NaHCO3+HCl==== NaCl+CO2↑+H2O。
【补偿训练】
纯碱和小苏打都是白色晶体,在日常生活中很常见。若要在家中将它们区分开来,下面的方法中可行的是
( )
A.分别放在炒锅中加热,观察是否有残留物
B.分别用干净铁丝蘸取样品在煤气炉的火焰上灼烧,观察火焰颜色
C.将样品溶解,分别加入足量的澄清石灰水,观察是否有白色沉淀
D.在水杯中各盛相同质量的样品,分别加入等体积的白醋,观察反应的剧烈程度
【解析】选D。NaHCO3不稳定,受热易分解:2NaHCO3
Na2CO3+CO2↑+H2O,但分解后仍有固体剩余;Na2CO3稳定
性好,不分解,A错误。纯碱和小苏打都含有钠元素,灼
烧时均为黄色,B错误。澄清石灰水与二者反应均能够
产生白色沉淀,无法区分。足量的澄清石灰水与Na2CO3
反应的离子方程式为Ca2++ ====CaCO3↓,与NaHCO3
△
====
反应的离子方程式为Ca2++OH-+ ====CaCO3↓+H2O,
C错误。相同质量的NaHCO3与Na2CO3分别与白醋反应,反
应较剧烈的是NaHCO3,D正确。
项目活动2 设计并运用复合膨松剂
用碳酸氢钠蒸的馒头呈淡黄色,碳酸氢钠作为单一膨松剂,可能造成食品口味不纯,颜色加深等问题。
如何才能使馒头变得又白又松软,甚至口味更佳
【活动探究】
1.实验用品
白醋或柠檬酸、食用碳酸氢钠,蒸馒头用的器具。
2.实验步骤
(1)制作馒头:
①和面时只加入食用碳酸氢钠;
②和面时加入食用碳酸氢钠和白醋;
③和面时加入食用碳酸氢钠和柠檬酸。
(2)观察馒头的色泽,并趁热闻一下气味,品尝一下馒头的味道,并记录下来。
馒头 色泽 气味 味道 膨松程度
① 略显淡
黄色 无明显
气味 口感不
佳(碱味) 程度较小
② 白色 无明显
气味 口感较好,
无特殊味道 程度较大
③ 白色 柠檬味 柠檬味 程度较大
【思考讨论】
(1)如果用碳酸氢钠制作复合膨松剂的主材料,另一种主材料用白醋和柠檬酸哪一个更合适 并说出你的理由。
提示:柠檬酸。常温下柠檬酸是固体,白醋是液体,白醋和碳酸氢钠混合会直接反应,故柠檬酸更合适。
(2)如果用碳酸氢钠制作复合膨松剂的主材料,另一种主材料需具有什么性质
提示:酸性。所选材料必须能与碳酸氢钠反应产生二氧化碳。
【探究总结】
复合膨松剂的组成
复合膨松剂的组成
碳酸盐类 如碳酸氢钠通常用量30%~50% 作用是反应产生二氧化碳
酸性物质 如柠檬酸通常用量30%~40% 作用是与碳酸盐反应,控制反应速率和提升膨松剂的作用效果,调节产品酸碱度
复合膨松剂的组成
助剂 指的是淀粉、脂肪酸等,通常用量10%~30% 作用是防止膨松剂吸潮结块而失效,调节气体产生速率或使气体均匀产生
【迁移应用】
兴趣小组获得两包制作“跳跳糖”的添加剂,一包是柠檬酸晶体,另一包是标注为钠盐的白色粉末。将少量柠檬酸和这种白色粉末溶于水,混合后产生了使澄清石灰水变浑浊的气体。于是对白色粉末的化学成分进行了以下探究: 世纪金榜导学号
(1)【提出猜想】
猜想1.碳酸钠;
猜想2.碳酸氢钠;
猜想3.碳酸钠和碳酸氢钠。
(2)【查阅资料】碳酸钠溶液、碳酸氢钠溶液均呈碱性。
(3)【实验探究】小明、小磊分别对有关猜想设计方案并进行实验:
实验操作 实验现象 实验结论
小
明 将白色粉末溶于水后用pH试纸测定其酸碱度 pH________(选填“>”“<”或“=”)7 溶液呈碱性,猜想1成立
实验操作 实验现象 实验结论
小
磊 用如图所示的装置进行实验 试管A中有水珠产生,试管B中液体变浑浊 猜想2成立,试管A中反应的化学方程式为
__________
__________
(4)【交流反思】大家一致认为小明和小磊的结论不
准确:
①小明实验结论不准确的原因是_______________
_________________________________________;
②小磊的实验方案不能排除白色粉末是否含有____。
(5)【结论分析】探究后他们得出添加剂的成分是柠檬酸和碳酸氢钠,分析后认为白色粉末中的碳酸钠是由碳酸氢钠分解产生的。
(6)【拓展应用】下列物质常温下放置一段时间也会分解的是________(填序号)。
A.浓硫酸 B.氢氧化钠 C.碳酸氢铵 D.氯化钠
【解析】(3)小明:根据碳酸钠溶液呈碱性,所以溶液的pH>7;小磊:由实验的现象可知,碳酸氢钠受热分解生成了碳酸钠、水和二氧化碳,反应的化学方程式是2NaHCO3 Na2CO3+CO2↑+H2O
(4)①由于碳酸钠溶液、碳酸氢钠溶液均呈碱性,溶液的pH>7,所以小明实验结论不准确;
△
====
②由于碳酸钠和碳酸氢钠的混合物受热也会生成水和
二氧化碳,所以不能排除白色粉末中混有碳酸钠。
答案:(3)> 2NaHCO3 Na2CO3+CO2↑+H2O
(4)①碳酸钠溶液、碳酸氢钠溶液均呈碱性 ②碳酸钠
(6)C
△
====
课题任务:重现“侯氏制碱法”过程 体验研究物质性
质的基本程序
【情境创设】
侯氏制碱法又称联合制碱法,是我国化学工程专家
侯德榜于1943年创立的。是将氨碱法和合成氨法两种
工艺联合起来,同时生产纯碱和氯化铵两种产品的方
法。原料是食盐水、氨气和二氧化碳——合成氨厂用
水煤气制取氢气时的废气。此方法提高了食盐利用率,
缩短了生产流程,减少了对环境的污染,降低了纯碱的成
本,克服了氨碱法的不足,曾在全球享有盛誉,得到普遍
采用。联碱工艺,是我国独创,具有显著的节能效果。
【素养探究】
【探究一】原料的加入顺序
1.预测物质性质
二氧化碳微溶于水,用pH试纸检验,pH<7,溶液显酸性;氨气极易溶于水,用pH试纸检验,pH>7,溶液显碱性;根据物质分类来看酸碱之间发生反应。
2.实验验证
(1)二氧化碳、氨气在水中的溶解度比较
按图示装置组装仪器,完成实验,请描述实验现象,并得出结论。
提示:氨气溶于水形成喷泉,二氧化碳无明显现象。氨气极易溶于水,二氧化碳溶解很少。
(2)侯氏制碱法的原料是饱和食盐水、二氧化碳(合成氨废气的主要成分)、氨气。请根据下列提示完成实验,确定原料加入顺序(结合“侯氏制碱法过程”图回答)。
①向饱和食盐水中先通入足量二氧化碳气体,再通入足量氨气,观察溶液中有什么现象发生
提示:无明显现象。
②向饱和食盐水中先通入足量氨气,再通入足量二氧化碳气体,观察溶液中有什么现象发生
提示:产生沉淀。
③结合①②,阐述上述现象的原因。
提示:CO2在NaCl中的溶解度很小,先通入CO2无法产生高
浓度的 ,无法析出NaHCO3晶体,先通入NH3使食盐水
显碱性(用无色酚酞溶液检验),能够吸收大量CO2气体,
产生高浓度的 ,才能析出NaHCO3晶体。
【探究二】探究NaCl对NaHCO3溶解度的影响
3.预测性质
碳酸氢钠、NH4Cl均易溶于水,但通过【探究一】的实验可知,在饱和氯化钠溶液中能析出NaHCO3固体,氯化钠的存在可能影响NaHCO3溶解度。
4.实验验证
请设计一个实验,证明氯化钠对NaHCO3在水中的溶解度有影响。
提示:取一定量蒸馏水,加入NaHCO3固体至恰好饱和,记录加入的NaHCO3的质量;另取一个烧杯,加入相同体积的蒸馏水,然后加入氯化钠至恰好饱和,再加入NaHCO3固体至恰好饱和,记录加入的NaHCO3的质量,比较两次加入的NaHCO3的质量即可得出结论。
【素养解读】
1.核心素养
科学探究与创新意识:能发现和提出有探究价值的问题;能从问题和假设出发,依据探究目的,设计探究方案。
2.素养目标
通过该探究课题的学习,认识探究物质性质的基本程序,激发学生的科学探究精神,认识化学对创造物质世界的巨大贡献,增强社会责任感。
【素养评价】
1.宏观辨识与微观探析——水平1:能从物质的类别入手,预测物质的性质。
2.科学探究与创新意识——水平2:能根据所给问题设计简单实验,客观记录实验现象,并作出解释。
3.科学探究与创新意识——水平3:能根据假设提出实验方案,独立完成实验,基于现象和数据进行分析得出结论,并交流。
4.科学探究与创新意识——水平4:能对实验中异常现象提出质疑和新的实验设想,并进一步付诸实施。
微项目
探秘膨松剂——体会研究物质性质的
方法和程序的实用价值
1.膨松剂
膨松剂是在食品加工过程中加入的,能使面胚发起形成多孔组织,从而使食品具有柔软或酥脆特点的一类物质。
2.膨松剂的分类
【情境·思考】
老面是指发面的面种子,北方叫面引子,也有的地方叫
面头(酵头)。就是发面蒸馒头时剩下一小团面,由于里
面有很多酵母菌,下次发面的时候作为菌种用。这种用
上次发酵的面做菌种发面蒸的馒头就叫老面馒头。老
面在保存过程中往往会同时有乳酸菌存在,发的时间稍
长就会有独特的酸味出现,故用老面发面蒸馒头时需要加食用碱来中和其酸味。
老面能使馒头变得松软多孔,其原理是什么
提示:面团在酵母菌以及其他一定数量和种类的微生物的共同作用下发生反应,生成二氧化碳、乳酸、醋酸、乙醇等物质,其中二氧化碳能使面团呈海绵状。
项目活动1 探究碳酸氢钠的蓬松原理
上面两种蒸馒头的方法,均用到了碳酸氢钠,为什么效果不同
【活动探究】
1.碳酸氢钠在发面中的作用原理推测
(1)碳酸氢钠受热分解,生成气体。
(2)碳酸氢钠与酸反应,生成气体。
2.实验用品
碳酸氢钠、盐酸、澄清石灰水;
试管、酒精灯、铁架台(带铁夹)或试管夹,带导管的橡胶塞、药匙,胶头滴管,火柴。
3.实验方案
(1)按图1所示装置组装仪器,加入10 g碳酸氢钠,并充分加热,观察现象。
(2)将充分加热后的物质取下,冷却至室温,更换带有导气管的橡胶塞,如图2所示,向试管中加入足量盐酸,观察现象。
(3)若向图2中加入10 g碳酸氢钠,再加入足量盐酸,观察现象。
4.记录实验现象
实验 现象
实验(1) 加热一段时间后,澄清石灰水变浑浊
实验(2) 澄清石灰水变浑浊
实验(3) 加入盐酸后,澄清石灰水迅速变浑浊,且浑浊程度比实验(1)、实验(2)大
【思考讨论】
(1)在发面时,只加入碳酸氢钠效果好还是加入碳酸氢钠和食醋效果好 说明理由。
提示:加入碳酸氢钠和食醋效果好。由实验(3)可知碳酸氢钠能与酸反应,产生CO2较迅速且多。
(2)实验(1)中碳酸氢钠分解后产生的产物中有Na2CO3,只用碳酸钠能达到发面的效果吗
提示:不能。根据实验(1),充分加热后,再进行实验(2)仍有CO2生成,说明Na2CO3无法在加热的条件下分解,产生CO2。
【探究总结】
1.Na2CO3与NaHCO3的物理性质
名称 碳酸钠 碳酸氢钠
化学式 Na2CO3 NaHCO3
俗名 纯碱或苏打 小苏打
颜色、状态 白色粉末 细小白色晶体
水溶性 易溶于水 水中易溶,比Na2CO3的溶解度小
2.Na2CO3与NaHCO3的化学性质
(1)热稳定性。
①Na2CO3性质稳定,受热难分解。
②NaHCO3性质不稳定,受热易分解,化学方程式
2NaHCO3 Na2CO3+CO2↑+H2O。
△
====
(2)与酸(足量盐酸)反应。
①Na2CO3:Na2CO3+2HCl====2NaCl+CO2↑+H2O。
②NaHCO3:NaHCO3+HCl====NaCl+CO2↑+H2O。
(3)碱性:Na2CO3与NaHCO3溶液均显碱性,且相同情况下前者碱性大。
(4)与碱反应。
①与NaOH溶液
②与石灰水(足量)
3.Na2CO3与NaHCO3的相互转化
Na2CO3 NaHCO3
【迁移应用】
1.(2019·冀州高一检测)为使以面粉为原料的面包松软可口,通常用碳酸氢钠作膨松剂,其原因是 ( )
①热稳定性差 ②增加甜味 ③产生二氧化碳
④提供钠离子
A.②③ B.①③ C.①④ D.③④
【解析】选B。为使以面粉为原料的面包松软可口,通常用碳酸氢钠作膨松剂,这是由于碳酸氢钠不稳定,加热会发生分解反应,方程式是2NaHCO3 Na2CO3
+CO2↑+H2O,分解产生CO2气体从面团中逸出,从而导致面包松软可口,故正确的说法是①③。
△
====
2.胃酸过多又称作胃酸过高,是胃肠疾病的常见症状之一。适度的胃酸可以帮助消化,但如果胃酸过多就会伤及胃、十二指肠黏膜,造成胃溃疡或十二指肠溃疡等疾病,治疗胃酸过多可以用碳酸氢钠。
请用化学方程式解释碳酸氢钠可以治疗胃酸过多的原因。
提示:胃酸的主要成分是盐酸。NaHCO3+HCl==== NaCl+CO2↑+H2O。
【补偿训练】
纯碱和小苏打都是白色晶体,在日常生活中很常见。若要在家中将它们区分开来,下面的方法中可行的是
( )
A.分别放在炒锅中加热,观察是否有残留物
B.分别用干净铁丝蘸取样品在煤气炉的火焰上灼烧,观察火焰颜色
C.将样品溶解,分别加入足量的澄清石灰水,观察是否有白色沉淀
D.在水杯中各盛相同质量的样品,分别加入等体积的白醋,观察反应的剧烈程度
【解析】选D。NaHCO3不稳定,受热易分解:2NaHCO3
Na2CO3+CO2↑+H2O,但分解后仍有固体剩余;Na2CO3稳定
性好,不分解,A错误。纯碱和小苏打都含有钠元素,灼
烧时均为黄色,B错误。澄清石灰水与二者反应均能够
产生白色沉淀,无法区分。足量的澄清石灰水与Na2CO3
反应的离子方程式为Ca2++ ====CaCO3↓,与NaHCO3
△
====
反应的离子方程式为Ca2++OH-+ ====CaCO3↓+H2O,
C错误。相同质量的NaHCO3与Na2CO3分别与白醋反应,反
应较剧烈的是NaHCO3,D正确。
项目活动2 设计并运用复合膨松剂
用碳酸氢钠蒸的馒头呈淡黄色,碳酸氢钠作为单一膨松剂,可能造成食品口味不纯,颜色加深等问题。
如何才能使馒头变得又白又松软,甚至口味更佳
【活动探究】
1.实验用品
白醋或柠檬酸、食用碳酸氢钠,蒸馒头用的器具。
2.实验步骤
(1)制作馒头:
①和面时只加入食用碳酸氢钠;
②和面时加入食用碳酸氢钠和白醋;
③和面时加入食用碳酸氢钠和柠檬酸。
(2)观察馒头的色泽,并趁热闻一下气味,品尝一下馒头的味道,并记录下来。
馒头 色泽 气味 味道 膨松程度
① 略显淡
黄色 无明显
气味 口感不
佳(碱味) 程度较小
② 白色 无明显
气味 口感较好,
无特殊味道 程度较大
③ 白色 柠檬味 柠檬味 程度较大
【思考讨论】
(1)如果用碳酸氢钠制作复合膨松剂的主材料,另一种主材料用白醋和柠檬酸哪一个更合适 并说出你的理由。
提示:柠檬酸。常温下柠檬酸是固体,白醋是液体,白醋和碳酸氢钠混合会直接反应,故柠檬酸更合适。
(2)如果用碳酸氢钠制作复合膨松剂的主材料,另一种主材料需具有什么性质
提示:酸性。所选材料必须能与碳酸氢钠反应产生二氧化碳。
【探究总结】
复合膨松剂的组成
复合膨松剂的组成
碳酸盐类 如碳酸氢钠通常用量30%~50% 作用是反应产生二氧化碳
酸性物质 如柠檬酸通常用量30%~40% 作用是与碳酸盐反应,控制反应速率和提升膨松剂的作用效果,调节产品酸碱度
复合膨松剂的组成
助剂 指的是淀粉、脂肪酸等,通常用量10%~30% 作用是防止膨松剂吸潮结块而失效,调节气体产生速率或使气体均匀产生
【迁移应用】
兴趣小组获得两包制作“跳跳糖”的添加剂,一包是柠檬酸晶体,另一包是标注为钠盐的白色粉末。将少量柠檬酸和这种白色粉末溶于水,混合后产生了使澄清石灰水变浑浊的气体。于是对白色粉末的化学成分进行了以下探究: 世纪金榜导学号
(1)【提出猜想】
猜想1.碳酸钠;
猜想2.碳酸氢钠;
猜想3.碳酸钠和碳酸氢钠。
(2)【查阅资料】碳酸钠溶液、碳酸氢钠溶液均呈碱性。
(3)【实验探究】小明、小磊分别对有关猜想设计方案并进行实验:
实验操作 实验现象 实验结论
小
明 将白色粉末溶于水后用pH试纸测定其酸碱度 pH________(选填“>”“<”或“=”)7 溶液呈碱性,猜想1成立
实验操作 实验现象 实验结论
小
磊 用如图所示的装置进行实验 试管A中有水珠产生,试管B中液体变浑浊 猜想2成立,试管A中反应的化学方程式为
__________
__________
(4)【交流反思】大家一致认为小明和小磊的结论不
准确:
①小明实验结论不准确的原因是_______________
_________________________________________;
②小磊的实验方案不能排除白色粉末是否含有____。
(5)【结论分析】探究后他们得出添加剂的成分是柠檬酸和碳酸氢钠,分析后认为白色粉末中的碳酸钠是由碳酸氢钠分解产生的。
(6)【拓展应用】下列物质常温下放置一段时间也会分解的是________(填序号)。
A.浓硫酸 B.氢氧化钠 C.碳酸氢铵 D.氯化钠
【解析】(3)小明:根据碳酸钠溶液呈碱性,所以溶液的pH>7;小磊:由实验的现象可知,碳酸氢钠受热分解生成了碳酸钠、水和二氧化碳,反应的化学方程式是2NaHCO3 Na2CO3+CO2↑+H2O
(4)①由于碳酸钠溶液、碳酸氢钠溶液均呈碱性,溶液的pH>7,所以小明实验结论不准确;
△
====
②由于碳酸钠和碳酸氢钠的混合物受热也会生成水和
二氧化碳,所以不能排除白色粉末中混有碳酸钠。
答案:(3)> 2NaHCO3 Na2CO3+CO2↑+H2O
(4)①碳酸钠溶液、碳酸氢钠溶液均呈碱性 ②碳酸钠
(6)C
△
====
课题任务:重现“侯氏制碱法”过程 体验研究物质性
质的基本程序
【情境创设】
侯氏制碱法又称联合制碱法,是我国化学工程专家
侯德榜于1943年创立的。是将氨碱法和合成氨法两种
工艺联合起来,同时生产纯碱和氯化铵两种产品的方
法。原料是食盐水、氨气和二氧化碳——合成氨厂用
水煤气制取氢气时的废气。此方法提高了食盐利用率,
缩短了生产流程,减少了对环境的污染,降低了纯碱的成
本,克服了氨碱法的不足,曾在全球享有盛誉,得到普遍
采用。联碱工艺,是我国独创,具有显著的节能效果。
【素养探究】
【探究一】原料的加入顺序
1.预测物质性质
二氧化碳微溶于水,用pH试纸检验,pH<7,溶液显酸性;氨气极易溶于水,用pH试纸检验,pH>7,溶液显碱性;根据物质分类来看酸碱之间发生反应。
2.实验验证
(1)二氧化碳、氨气在水中的溶解度比较
按图示装置组装仪器,完成实验,请描述实验现象,并得出结论。
提示:氨气溶于水形成喷泉,二氧化碳无明显现象。氨气极易溶于水,二氧化碳溶解很少。
(2)侯氏制碱法的原料是饱和食盐水、二氧化碳(合成氨废气的主要成分)、氨气。请根据下列提示完成实验,确定原料加入顺序(结合“侯氏制碱法过程”图回答)。
①向饱和食盐水中先通入足量二氧化碳气体,再通入足量氨气,观察溶液中有什么现象发生
提示:无明显现象。
②向饱和食盐水中先通入足量氨气,再通入足量二氧化碳气体,观察溶液中有什么现象发生
提示:产生沉淀。
③结合①②,阐述上述现象的原因。
提示:CO2在NaCl中的溶解度很小,先通入CO2无法产生高
浓度的 ,无法析出NaHCO3晶体,先通入NH3使食盐水
显碱性(用无色酚酞溶液检验),能够吸收大量CO2气体,
产生高浓度的 ,才能析出NaHCO3晶体。
【探究二】探究NaCl对NaHCO3溶解度的影响
3.预测性质
碳酸氢钠、NH4Cl均易溶于水,但通过【探究一】的实验可知,在饱和氯化钠溶液中能析出NaHCO3固体,氯化钠的存在可能影响NaHCO3溶解度。
4.实验验证
请设计一个实验,证明氯化钠对NaHCO3在水中的溶解度有影响。
提示:取一定量蒸馏水,加入NaHCO3固体至恰好饱和,记录加入的NaHCO3的质量;另取一个烧杯,加入相同体积的蒸馏水,然后加入氯化钠至恰好饱和,再加入NaHCO3固体至恰好饱和,记录加入的NaHCO3的质量,比较两次加入的NaHCO3的质量即可得出结论。
【素养解读】
1.核心素养
科学探究与创新意识:能发现和提出有探究价值的问题;能从问题和假设出发,依据探究目的,设计探究方案。
2.素养目标
通过该探究课题的学习,认识探究物质性质的基本程序,激发学生的科学探究精神,认识化学对创造物质世界的巨大贡献,增强社会责任感。
【素养评价】
1.宏观辨识与微观探析——水平1:能从物质的类别入手,预测物质的性质。
2.科学探究与创新意识——水平2:能根据所给问题设计简单实验,客观记录实验现象,并作出解释。
3.科学探究与创新意识——水平3:能根据假设提出实验方案,独立完成实验,基于现象和数据进行分析得出结论,并交流。
4.科学探究与创新意识——水平4:能对实验中异常现象提出质疑和新的实验设想,并进一步付诸实施。
