化学人教版2019必修第一册2.3.3 物质的量浓度(共30张ppt)
文档属性
| 名称 | 化学人教版2019必修第一册2.3.3 物质的量浓度(共30张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-06 22:30:51 | ||
图片预览











文档简介
(共30张PPT)
第三节 物质的量
第三课时 物质的量浓度
第二章 海水中的重要元素——钠和氯
【考纲要求】
了解物质的量浓度的含义和应用,体会定量研究对化学科学的重要作用。
能基于物质的量认识物质的组成及其化学变化,并运用物质的量、摩尔质量、气体摩尔体积、物质的量浓度之间的相互关系进行简单计算。
能配制一定物质的量浓度的溶液。
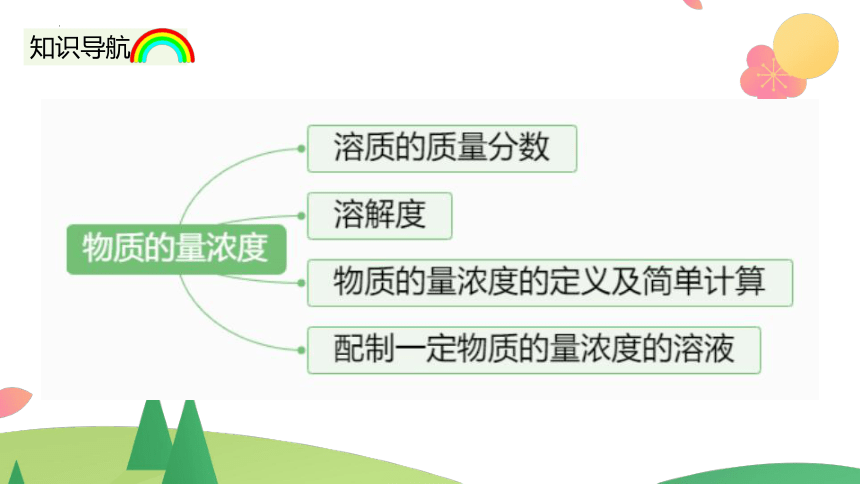
知识导航
课堂导入
物质的量浓度
一.溶质的质量分数
1.概念:
用溶质的质量与溶液质量的比值来表示溶液组成的物理量,一般用百分数表示。
2.表达式:
二.饱和溶液和溶解度
1.饱和溶液和不饱和溶液:
在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做这种溶质的饱和溶液;
还能继续溶解的溶液,叫做该溶质的不饱和溶液。
2.溶解度:
一定温度下,100g溶剂达到饱和时所溶解溶质的最大质量。
符号: S 单位: g
3.饱和溶液中,溶质质量分数和溶解度之间关系:
三.物质的量浓度
1.概念:
用单位体积溶液里所含溶质B的物质的量表示溶液组成的物理量。
2.符号为 cB ,单位: mol/L或mol·L-1 。
3.表达式: cB=
意义:如1 L溶液中含有1 mol溶质,溶质的物质的量浓度就是1 mol/L。
【注意】(1)V是溶液的体积而非溶剂的体积。
(2)溶质可以是分子,也可以是阴阳离子、
化合物或者特定的组合(如:CuSO4·5H2O)。
(3) 与水反应生成新物质的溶质,一般指新物质(如:Na2O溶于水所得溶液,溶质为NaOH)。
(4)结晶水合物溶于水,溶质指失去结晶水的物质。
(如:CuSO4·5H2O溶于水是CuSO4溶液)
(5)浓度一定的溶液中,取出任何体积的溶液其浓度不变。
1L水不等于1L溶液
【例题1】从200 mL 2 mol/L的NaOH溶液中取100 mL 溶液,此100 mL溶液的物质的量浓度为多少?含有NaOH的物质的量为多少?
取出100 mL溶液的物质的量浓度仍为 2 mol/L ,
含有0.2 mol NaOH。
四.配制一定物质的量浓度的溶液
【实验1--5】用NaCl固体和蒸馏水为原料配制
100mL1.00mol/LNaCl溶液
1.容量瓶
2.容量瓶使用注意事项
①不能将固体或浓溶液直接在容量瓶中溶解或稀释;也不能用作反应容器或用来长期贮存溶液。
②不能将过冷或过热的溶液转移到容量瓶中,因为容量瓶的容积是在瓶身所标温度下确定的。
③不能配制任意体积的溶液,只能配制容量瓶上规定容积的溶液。
④向容量瓶中注入液体时,一定要用玻璃棒引流。
检查是否漏液操作
3.一定物质的量浓度溶液的配制过程
(1)主要仪器: 托盘天平、药匙、量筒、烧杯、
容量瓶、玻璃棒、胶头滴管。
用NaCl固体和蒸馏水为原料配100mL1.00mol/LNaCl溶液
0.1 mol
5.85 g
5.9 g
【思考】定容时,凹液面超过刻度线,如何处理?
配制失败,重新配制。
【例题2】误差分析
下列哪些操作会产生误差?对配制溶液浓度产生怎样的影响?(填“偏大”、“偏小”、“无影响”。)
1.引流时有少许液体溅出容量瓶外
2.定容后摇匀,液面低于刻度线,不施加措施
3.定容时加水高于刻度线,将多余液体吸出
4.用于溶解的小烧杯未洗涤
5.定容时俯视
【答案】偏小 无影响 偏小 偏小 偏大
五.物质的量浓度、质量分数的关系及计算
1.有关物质的量浓度的计算
(1)计算的基本公式:
(2)计算的基本类型和方法
①已知溶质的质量
②已知溶液中某种粒子的数目
③标准状况下,气体溶质的物质的量浓度的计算
2.物质的量浓度与溶质的质量分数的换算设溶液体积为1 L,则
3.溶液的稀释与混合 溶质守恒
(1)稀释规律
c(浓)·V(浓)=c(稀)·V(稀)
w(浓)·m(浓)=w(稀)·m(稀)
(2)混合规律
c1V1+c2V2=c(混)·V(混)
V(混)=
4.溶液中电荷守恒定律——溶液呈电性
阳离子带的正电荷数=阴离子带的负电荷数。
如:Na2SO4与NaOH的混合液中
c(Na+)+c(H+)=2c(SO42-)+c(OH-)
【例题3】如图是某市售盐酸试剂瓶标签上的部分数据。
盐酸化学式:HCl
相对分子质量:36.5
外观:合格
密度:1.18 g·cm-3
HCl的质量分数:36.5%
符合 GB622—89
则该盐酸的物质的量浓度是( )
A.3 mol·L-1 B.8.4 mol·L-1
C.11.8 mol·L-1 D.0.5 mol·L-1
【答案】C
【例题4】将5 mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度为( )
A. mol/L B. mol/L
C. mol/L D. mol/L
【答案】B
【例题5】下列配制的溶液浓度偏高的是( )
A.配制盐酸用量筒量取盐酸时俯视读数
B.配制盐酸定容时,仰视容量瓶刻度线
C.称量4.0 g NaOH配制 1 000 mL 0.1 mol·L-1 NaOH溶液时,砝码错放在左盘
D.NaOH溶解后未经冷却即注入容量瓶,再加水至刻度线
【答案】D
效果检测
1.(2022·天津市第二南开中学高一阶段练习)钙元素在人体血液中以钙离子的形式存在,正常指标参考值为2.13×10-3~2.70 ×10-3 mol·L-1。表示该指标的物理量是
A.溶解度 B.体积分数
C.物质的量浓度 D.质量分数
【答案】C
2.(2021·上海师范大学附属中学闵行分校高一期中)下列溶液中Na+浓度最小的是
A.400mL0.02mol·L-1NaCl溶液
B.300mL0.02mol·L-1Na2SO4溶液
C.100mL0.03mol·L-1NaNO3溶液
D.200mL0.01mol·L-1Na3PO4溶液
【答案】A
3.(2022·河南·虞城县高级中学高一期末)NaCl是我们生活中必不可少的物质。将NaCl溶于水配成1mol/L的溶液,溶解过程如图所示,下列说法正确的是
A.a离子为Na+
B.溶液中含有NA个
C.水合b离子的图示不科学Na+
D.将58.5gNaCl溶解在1L水中即得到1mol/L溶液
【答案】C
4.(2022·辽宁·高一期末)用氢氧化钠固体配制的溶液,现需要220mL,下列说法正确的是
A.需先称取氢氧化钠固体8.8g
B.氢氧化钠在烧杯中溶解后,要立即转移至容量瓶
C.NaOH试剂含有杂质不一定会导致所配溶液浓度偏小
D.定容后将溶液振荡摇匀,静置时发现液面低于刻度线,需继续加水至刻度线
【答案】C
5.(2021·上海市新中高级中学高一阶段练习)下列关于0.1mol·L-1Na2CO3溶液的叙述错误的是
A.0.5L该溶液的钠离子的物质的量浓度为0.2mol·L-1
B.1L该溶液中含有Na2CO3的物质的量为0.1mol
C.从1L该溶液中取出100mL,则取出溶液中Na2CO3的物质的量浓度为0.01mol·L-1
D.取出该溶液10mL,加水稀释至100mL后,Na2CO3的物质的量浓度为0.01mol·L-1
【答案】C
6.实验室配制浓度为1.0mol·L-1NaOH溶液100mL,下面有关操作及说法正确的是
A.称量NaOH固体时,应在托盘天平两盘上各放一张大小相同的纸片
B.若所称量NaOH固体中有少量Na2O杂质,则造成所配溶液浓度偏低
C.若用10mol·L-1NaOH溶液来配制,用量筒量取10mLNaOH浓溶液倒入烧杯后,应该用同一量筒取一定量蒸馏水倒入烧杯中
D.定容后将容量瓶反复上下颠倒摇匀,静置发现液面低于刻度线,无需再滴加蒸馏水至刻线
【答案】D
本课结束
第三节 物质的量
第三课时 物质的量浓度
第二章 海水中的重要元素——钠和氯
【考纲要求】
了解物质的量浓度的含义和应用,体会定量研究对化学科学的重要作用。
能基于物质的量认识物质的组成及其化学变化,并运用物质的量、摩尔质量、气体摩尔体积、物质的量浓度之间的相互关系进行简单计算。
能配制一定物质的量浓度的溶液。
知识导航
课堂导入
物质的量浓度
一.溶质的质量分数
1.概念:
用溶质的质量与溶液质量的比值来表示溶液组成的物理量,一般用百分数表示。
2.表达式:
二.饱和溶液和溶解度
1.饱和溶液和不饱和溶液:
在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做这种溶质的饱和溶液;
还能继续溶解的溶液,叫做该溶质的不饱和溶液。
2.溶解度:
一定温度下,100g溶剂达到饱和时所溶解溶质的最大质量。
符号: S 单位: g
3.饱和溶液中,溶质质量分数和溶解度之间关系:
三.物质的量浓度
1.概念:
用单位体积溶液里所含溶质B的物质的量表示溶液组成的物理量。
2.符号为 cB ,单位: mol/L或mol·L-1 。
3.表达式: cB=
意义:如1 L溶液中含有1 mol溶质,溶质的物质的量浓度就是1 mol/L。
【注意】(1)V是溶液的体积而非溶剂的体积。
(2)溶质可以是分子,也可以是阴阳离子、
化合物或者特定的组合(如:CuSO4·5H2O)。
(3) 与水反应生成新物质的溶质,一般指新物质(如:Na2O溶于水所得溶液,溶质为NaOH)。
(4)结晶水合物溶于水,溶质指失去结晶水的物质。
(如:CuSO4·5H2O溶于水是CuSO4溶液)
(5)浓度一定的溶液中,取出任何体积的溶液其浓度不变。
1L水不等于1L溶液
【例题1】从200 mL 2 mol/L的NaOH溶液中取100 mL 溶液,此100 mL溶液的物质的量浓度为多少?含有NaOH的物质的量为多少?
取出100 mL溶液的物质的量浓度仍为 2 mol/L ,
含有0.2 mol NaOH。
四.配制一定物质的量浓度的溶液
【实验1--5】用NaCl固体和蒸馏水为原料配制
100mL1.00mol/LNaCl溶液
1.容量瓶
2.容量瓶使用注意事项
①不能将固体或浓溶液直接在容量瓶中溶解或稀释;也不能用作反应容器或用来长期贮存溶液。
②不能将过冷或过热的溶液转移到容量瓶中,因为容量瓶的容积是在瓶身所标温度下确定的。
③不能配制任意体积的溶液,只能配制容量瓶上规定容积的溶液。
④向容量瓶中注入液体时,一定要用玻璃棒引流。
检查是否漏液操作
3.一定物质的量浓度溶液的配制过程
(1)主要仪器: 托盘天平、药匙、量筒、烧杯、
容量瓶、玻璃棒、胶头滴管。
用NaCl固体和蒸馏水为原料配100mL1.00mol/LNaCl溶液
0.1 mol
5.85 g
5.9 g
【思考】定容时,凹液面超过刻度线,如何处理?
配制失败,重新配制。
【例题2】误差分析
下列哪些操作会产生误差?对配制溶液浓度产生怎样的影响?(填“偏大”、“偏小”、“无影响”。)
1.引流时有少许液体溅出容量瓶外
2.定容后摇匀,液面低于刻度线,不施加措施
3.定容时加水高于刻度线,将多余液体吸出
4.用于溶解的小烧杯未洗涤
5.定容时俯视
【答案】偏小 无影响 偏小 偏小 偏大
五.物质的量浓度、质量分数的关系及计算
1.有关物质的量浓度的计算
(1)计算的基本公式:
(2)计算的基本类型和方法
①已知溶质的质量
②已知溶液中某种粒子的数目
③标准状况下,气体溶质的物质的量浓度的计算
2.物质的量浓度与溶质的质量分数的换算设溶液体积为1 L,则
3.溶液的稀释与混合 溶质守恒
(1)稀释规律
c(浓)·V(浓)=c(稀)·V(稀)
w(浓)·m(浓)=w(稀)·m(稀)
(2)混合规律
c1V1+c2V2=c(混)·V(混)
V(混)=
4.溶液中电荷守恒定律——溶液呈电性
阳离子带的正电荷数=阴离子带的负电荷数。
如:Na2SO4与NaOH的混合液中
c(Na+)+c(H+)=2c(SO42-)+c(OH-)
【例题3】如图是某市售盐酸试剂瓶标签上的部分数据。
盐酸化学式:HCl
相对分子质量:36.5
外观:合格
密度:1.18 g·cm-3
HCl的质量分数:36.5%
符合 GB622—89
则该盐酸的物质的量浓度是( )
A.3 mol·L-1 B.8.4 mol·L-1
C.11.8 mol·L-1 D.0.5 mol·L-1
【答案】C
【例题4】将5 mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度为( )
A. mol/L B. mol/L
C. mol/L D. mol/L
【答案】B
【例题5】下列配制的溶液浓度偏高的是( )
A.配制盐酸用量筒量取盐酸时俯视读数
B.配制盐酸定容时,仰视容量瓶刻度线
C.称量4.0 g NaOH配制 1 000 mL 0.1 mol·L-1 NaOH溶液时,砝码错放在左盘
D.NaOH溶解后未经冷却即注入容量瓶,再加水至刻度线
【答案】D
效果检测
1.(2022·天津市第二南开中学高一阶段练习)钙元素在人体血液中以钙离子的形式存在,正常指标参考值为2.13×10-3~2.70 ×10-3 mol·L-1。表示该指标的物理量是
A.溶解度 B.体积分数
C.物质的量浓度 D.质量分数
【答案】C
2.(2021·上海师范大学附属中学闵行分校高一期中)下列溶液中Na+浓度最小的是
A.400mL0.02mol·L-1NaCl溶液
B.300mL0.02mol·L-1Na2SO4溶液
C.100mL0.03mol·L-1NaNO3溶液
D.200mL0.01mol·L-1Na3PO4溶液
【答案】A
3.(2022·河南·虞城县高级中学高一期末)NaCl是我们生活中必不可少的物质。将NaCl溶于水配成1mol/L的溶液,溶解过程如图所示,下列说法正确的是
A.a离子为Na+
B.溶液中含有NA个
C.水合b离子的图示不科学Na+
D.将58.5gNaCl溶解在1L水中即得到1mol/L溶液
【答案】C
4.(2022·辽宁·高一期末)用氢氧化钠固体配制的溶液,现需要220mL,下列说法正确的是
A.需先称取氢氧化钠固体8.8g
B.氢氧化钠在烧杯中溶解后,要立即转移至容量瓶
C.NaOH试剂含有杂质不一定会导致所配溶液浓度偏小
D.定容后将溶液振荡摇匀,静置时发现液面低于刻度线,需继续加水至刻度线
【答案】C
5.(2021·上海市新中高级中学高一阶段练习)下列关于0.1mol·L-1Na2CO3溶液的叙述错误的是
A.0.5L该溶液的钠离子的物质的量浓度为0.2mol·L-1
B.1L该溶液中含有Na2CO3的物质的量为0.1mol
C.从1L该溶液中取出100mL,则取出溶液中Na2CO3的物质的量浓度为0.01mol·L-1
D.取出该溶液10mL,加水稀释至100mL后,Na2CO3的物质的量浓度为0.01mol·L-1
【答案】C
6.实验室配制浓度为1.0mol·L-1NaOH溶液100mL,下面有关操作及说法正确的是
A.称量NaOH固体时,应在托盘天平两盘上各放一张大小相同的纸片
B.若所称量NaOH固体中有少量Na2O杂质,则造成所配溶液浓度偏低
C.若用10mol·L-1NaOH溶液来配制,用量筒量取10mLNaOH浓溶液倒入烧杯后,应该用同一量筒取一定量蒸馏水倒入烧杯中
D.定容后将容量瓶反复上下颠倒摇匀,静置发现液面低于刻度线,无需再滴加蒸馏水至刻线
【答案】D
本课结束
