鲁教版(五四制)八年级化学 4.2.1氧气(共31张PPT内嵌视频)
文档属性
| 名称 | 鲁教版(五四制)八年级化学 4.2.1氧气(共31张PPT内嵌视频) |

|
|
| 格式 | zip | ||
| 文件大小 | 21.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-06 22:55:06 | ||
图片预览



文档简介
(共31张PPT)
第二节 氧气
(一)氧气的实验室制法
第四单元
我们周围
的空气
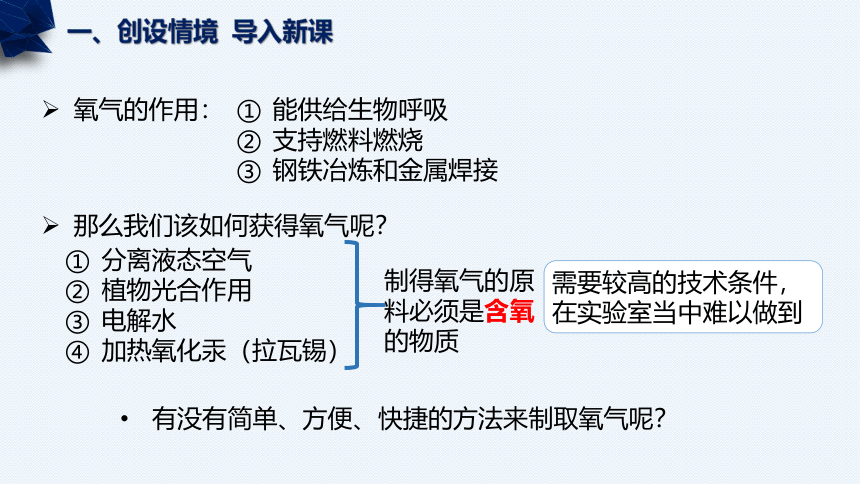
氧气的作用:
一、创设情境 导入新课
能供给生物呼吸
支持燃料燃烧
钢铁冶炼和金属焊接
那么我们该如何获得氧气呢?
分离液态空气
植物光合作用
电解水
加热氧化汞(拉瓦锡)
需要较高的技术条件,在实验室当中难以做到
有没有简单、方便、快捷的方法来制取氧气呢?
制得氧气的原料必须是含氧的物质
渔民为了缓解鱼塘缺氧问题,向鱼塘中加入增氧剂“氧来乐”,其有效成分为过氧化氢,过氧化氢在水中会产生少量的微小氧气泡
一、创设情境 导入新课
知识
窗口
过氧化氢能产生氧气,实验室能否用过氧化氢制氧气?
反应条件简单
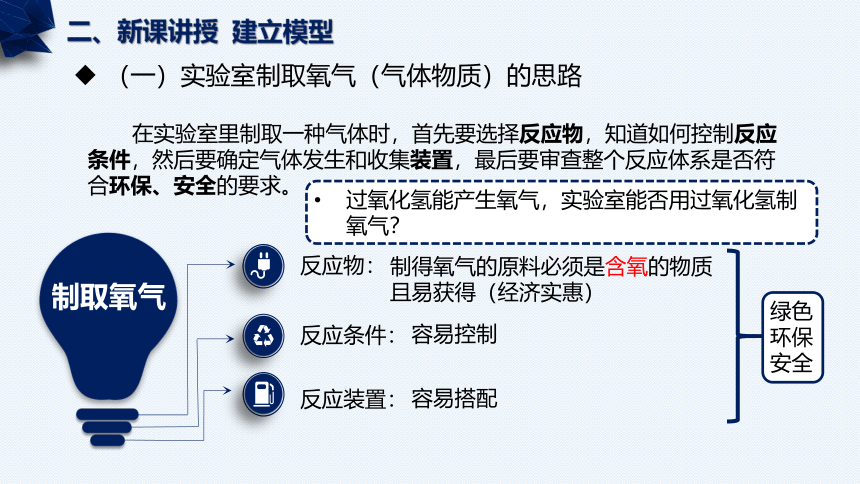
二、新课讲授 建立模型
在实验室里制取一种气体时,首先要选择反应物,知道如何控制反应条件,然后要确定气体发生和收集装置,最后要审查整个反应体系是否符合环保、安全的要求。
(一)实验室制取氧气(气体物质)的思路
反应物:
制得氧气的原料必须是含氧的物质
且易获得(经济实惠)
反应条件:
容易控制
制取氧气
反应装置:
容易搭配
绿色
环保
安全
过氧化氢能产生氧气,实验室能否用过氧化氢制氧气?
二、新课讲授 建立模型
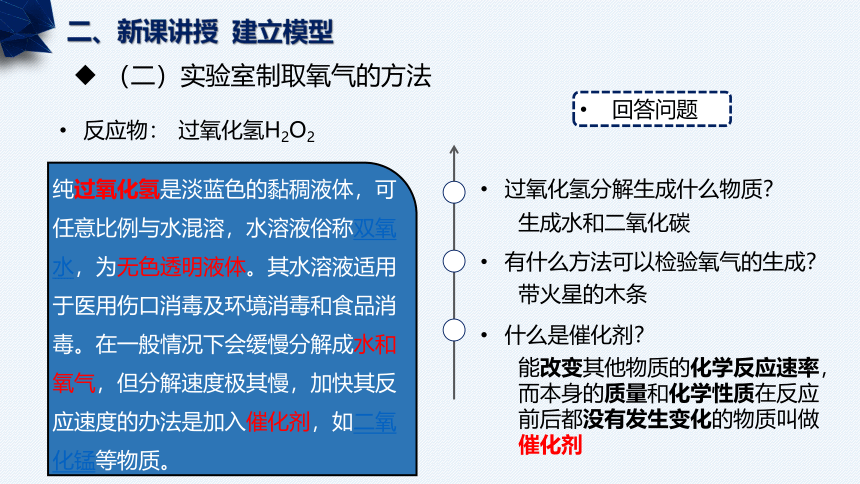
(二)实验室制取氧气的方法
反应物:
过氧化氢H2O2
纯过氧化氢是淡蓝色的黏稠液体,可任意比例与水混溶,水溶液俗称双氧水,为无色透明液体。其水溶液适用于医用伤口消毒及环境消毒和食品消毒。在一般情况下会缓慢分解成水和氧气,但分解速度极其慢,加快其反应速度的办法是加入催化剂,如二氧化锰等物质。
回答问题
过氧化氢分解生成什么物质?
有什么方法可以检验氧气的生成?
什么是催化剂?
生成水和二氧化碳
带火星的木条
能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质叫做催化剂
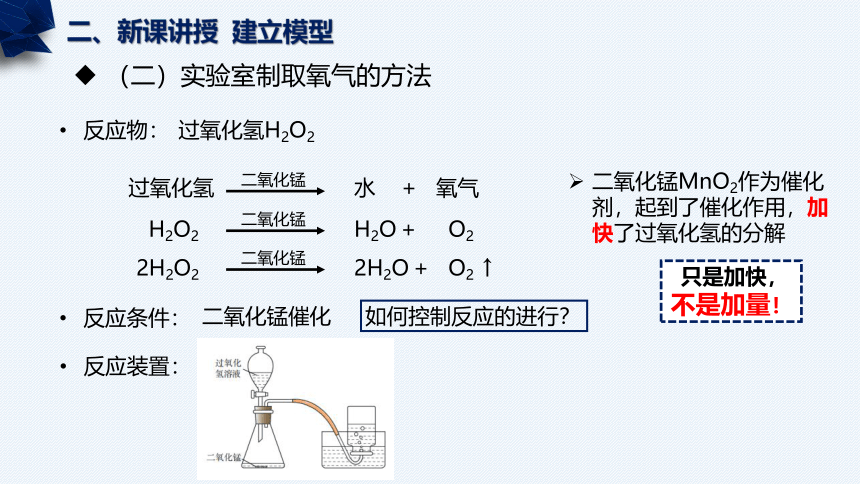
二、新课讲授 建立模型
(二)实验室制取氧气的方法
反应物:
过氧化氢H2O2
过氧化氢
水 + 氧气
二氧化锰
H2O2
二氧化锰
H2O + O2
二氧化锰MnO2作为催化剂,起到了催化作用,加快了过氧化氢的分解
只是加快,不是加量!
2H2O2
二氧化锰
2H2O + O2 ↑
反应条件:
二氧化锰催化
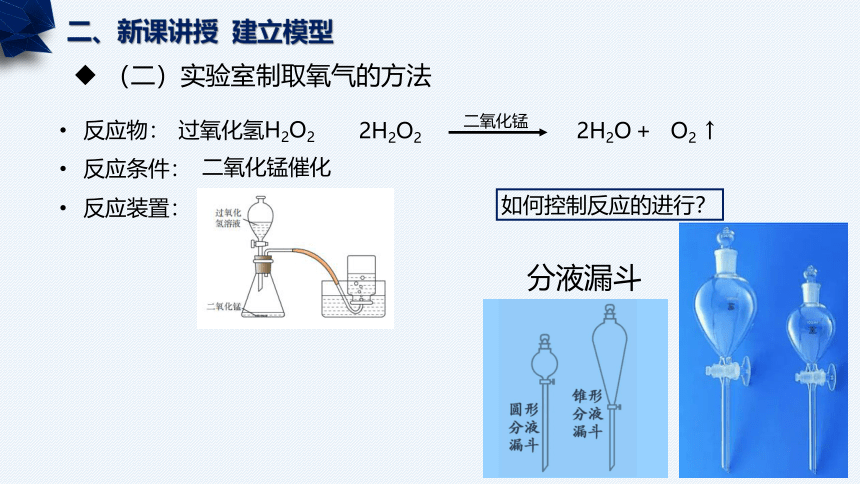
反应装置:
如何控制反应的进行?
二、新课讲授 建立模型
(二)实验室制取氧气的方法
反应物:
过氧化氢H2O2
2H2O2
二氧化锰
2H2O + O2 ↑
反应条件:
二氧化锰催化
反应装置:
如何控制反应的进行?
分液漏斗
二、新课讲授 建立模型
(二)实验室制取氧气的方法
反应物:
过氧化氢H2O2
2H2O2
二氧化锰
2H2O + O2 ↑
反应条件:
二氧化锰催化
反应装置:
如何收集氧气?
二、新课讲授 建立模型
(二)实验室制取氧气的方法
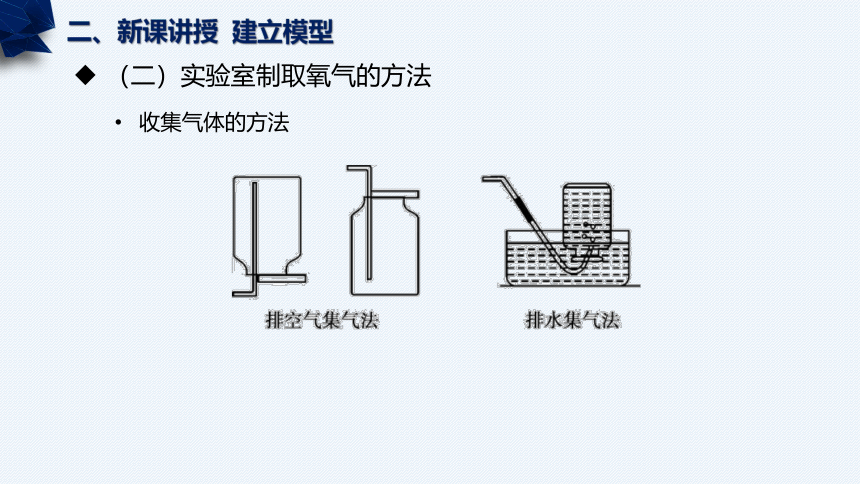
收集气体的方法
二、新课讲授 建立模型
(二)实验室制取氧气的方法
收集气体的方法
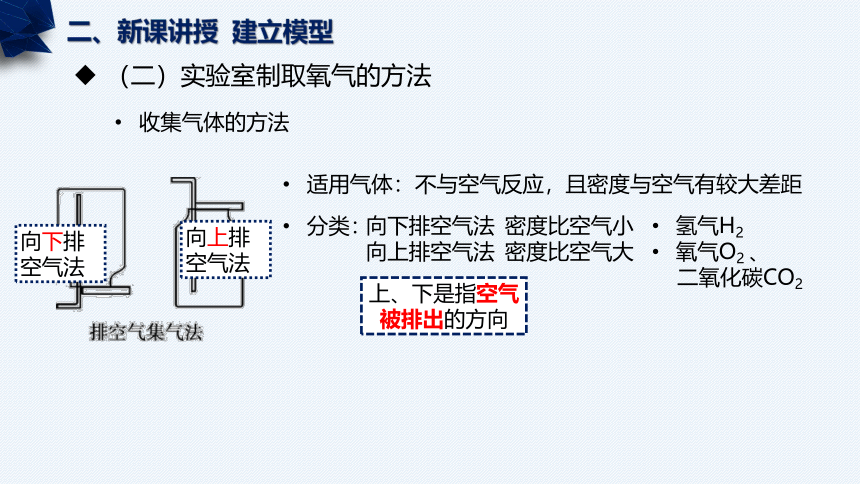
适用气体:
不与空气反应,且密度与空气有较大差距
向下排空气法
向上排空气法
分类:
向下排空气法
向上排空气法
密度比空气小
密度比空气大
上、下是指空气被排出的方向
氢气H2
氧气O2 、
二氧化碳CO2
二、新课讲授 建立模型
(二)实验室制取氧气的方法
收集气体的方法
适用气体:
不与水反应且溶解度小
氢气H2 、氧气O2 、氮气N2
先将集气瓶中盛满水, 用玻璃片盖住瓶口,然后倒立在水槽中。
当导管口有气泡连续、均匀地产生时,再把管口伸入盛满水的集气瓶里,等瓶里的水排完以后,在水里用玻璃片盖住瓶 口,将集气瓶移出水槽,放在桌面上。
密度比空气小:倒放在桌面上
密度比空气大:正放在桌面上
二、新课讲授 建立模型
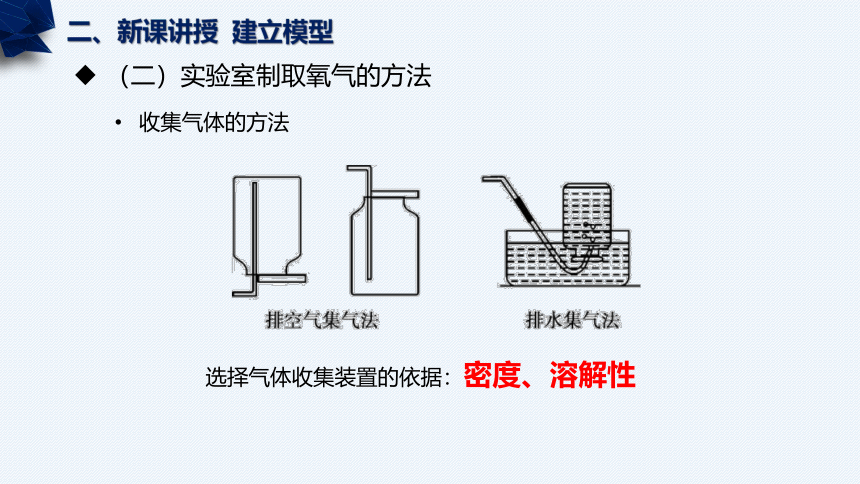
(二)实验室制取氧气的方法
收集气体的方法
选择气体收集装置的依据:密度、溶解性
二、新课讲授 建立模型
(二)实验室制取氧气的方法
反应物:
过氧化氢H2O2
2H2O2
二氧化锰
2H2O + O2 ↑
反应条件:
二氧化锰催化
反应装置:
分液漏斗
排水法
二、新课讲授 建立模型
(二)实验室制取氧气的方法
实验原理:
2H2O2
二氧化锰
2H2O + O2 ↑
实验步骤:
检验装置气密性
二、新课讲授 建立模型
(二)实验室制取氧气的方法
二、新课讲授 建立模型
(二)实验室制取氧气的方法
二、新课讲授 建立模型
(二)实验室制取氧气的方法
实验原理:
2H2O2
二氧化锰
2H2O + O2 ↑
实验步骤:
1、检验装置气密性
法1:关闭分液漏斗活塞,用手握住锥形瓶,导管口有气泡冒出,移开双手后,导管内液面逐渐上升,并能形成一段稳定的水柱,说明气密性良好
法2:关闭止水夹和分液漏斗活塞,向分液漏斗内加水,水不向下流动,打开分液漏斗活塞,水不流入锥形瓶中,说明气密性良好
二、新课讲授 建立模型
(二)实验室制取氧气的方法
二、新课讲授 建立模型
(二)实验室制取氧气的方法
实验原理:
2H2O2
二氧化锰
2H2O + O2 ↑
实验步骤:
检验装置气密性
在锥形瓶中加入二氧化锰,分液漏斗中加入过氧化氢溶液,向集气瓶中注满水并倒放在水槽中
打开分液漏斗活塞,待导管口处有稳定气泡冒出时开始收集气体
瓶口有气泡冒出时,取出导管,用玻璃片盖好瓶口取出,将集气瓶正立在桌面上
排出锥形瓶及导管中的空气
二、新课讲授 建立模型
(二)实验室制取氧气的方法
实验原理:
2H2O2
二氧化锰
2H2O + O2 ↑
实验步骤:
检验装置气密性
在锥形瓶中加入二氧化锰,分液漏斗中加入过氧化氢溶液,向集气瓶中注满水并倒放在水槽中
打开分液漏斗活塞,待导管口处有稳定气泡冒出时开始收集气体
瓶口有气泡冒出时,取出导管,用玻璃片盖好瓶口取出,将集气瓶正立在桌面上
验满:将带火星的木条放在集气瓶口处,如果木条复燃,则氧气已收集满
二、新课讲授 建立模型
(二)实验室制取氧气的方法
二氧化锰MnO2作为催化剂,起到了催化作用,加快了过氧化氢的分解
关于催化剂:
能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质叫做催化剂
加快或降低
不管是加快还是减慢反应速率,催化剂不改变反应产物的量,只是改变反应时间
问题:1.如何证明二氧化锰反应前后没有变化?
2.如何证明二氧化锰加快了反应速率?
3.如果证明二氧化锰只改变反应时间不改变反应产物的多少?
二、新课讲授 建立模型
(二)实验室制取氧气的方法
关于催化剂:
问题:1.如何证明二氧化锰反应前后没有变化?
质量
化学性质
反应前后分别称取二氧化锰的质量,质量前后不变
用二氧化锰催化一次实验过后,洗净,再次进行催化过氧化氢分解的实验,二氧化锰仍能加快反应速率
二、新课讲授 建立模型
(二)实验室制取氧气的方法
关于催化剂:
问题:2.如何证明二氧化锰加快了反应速率?
设计对照实验:在有二氧化锰催化和无二氧化锰催化两种情况下,记录过氧化氢溶液产生相同体积氧气所需的时间
问题:3.如果证明二氧化锰只改变反应时间不改变反应产物的多少?
设计对照实验:量取两份相同体积的过氧化氢溶液,一份加入二氧化锰,一份不加,记录两份溶液反应完毕后产生的氧气体积
二、新课讲授 建立模型
(二)实验室制取氧气的方法
利用其他含有氧元素的物质,例如加热高锰酸钾 (KMnO4)、氯酸钾(KClO3)等也可以制得氧气。
2H2O2
二氧化锰
2H2O + O2 ↑
2KMnO4 K2MnO4+MnO2+O2↑
2KClO3 2KCl+3O2 ↑
MnO2
△
不够经济实惠
三、课堂总结 巩固练习
2H2O2
二氧化锰
2H2O + O2 ↑
三、课堂总结 巩固练习
课堂练习
1、人类的生产和生活都离不开氧气,有关氧气的认识错误的是:
A.木炭在氧气中燃烧比在空气中燃烧更旺
B.工业上可以通过分离液态空气制取氧气
C.氧气易溶于水,不能用排水法收集
D.实验室中可用过氧化氢溶液和二氧化锰制取氧气
解析:氧气不易溶于水,可以用排水法收集
三、课堂总结 巩固练习
课堂练习
2、在实验室中利用如图装置,可以进行的实验是:
①过氧化氢溶液与MnO2制取氧气
②用高锰酸钾固体制取氧气
③用KClO3与MnO2的混合物制取氧气。
长颈漏斗
为防止气体通过漏斗溢出,长颈漏斗下端需浸没在液体中
三、课堂总结 巩固练习
课堂练习
3、下列关于催化剂的叙述中,正确的是:
A.一种物质只能催化一个反应
B.一个反应只能有一种催化剂
C.一定可以提高生成物的产量
D.一定可以改变反应速度速率
解析:
A.不一定,一种物质可能能催化多个反应
B.不一定
C.不改变产量,只改变速率
三、课堂总结 巩固练习
课堂练习
4、推理是学习化学的一种重要方法,但推理必须科学、严谨。下列推理正确的是:
A.化合物含有不同种元素,所以含不同种元素的物质一定是化合物B. 氧气是由氧元素组成的,所以制取氧气的反应物中一定含有氧元素
C.催化剂在反应前后质量不变,因此反应前后质量不变的物质一定是催化剂
解析:
A.不一定,含不同种元素的物质还可能是混合物
C.催化剂需要满足反应前后质量和化学性质均不变
三、课堂总结 巩固练习
课堂练习
5、下列关于产生氧气方法的叙述中,错误的是
A.空气中的氧气主要来自于植物的光合作用
B.工业上用分离液态空气的方法制取氧气是化学变化
C.用含有氧元素的物质反应才有可能产生氧气
D.实验室常用加热高锰酸钾的方法制取氧气
解析:B.分离液态空气是物理变化
谢谢观看
第二节 氧气
(一)氧气的实验室制法
第四单元
我们周围
的空气
氧气的作用:
一、创设情境 导入新课
能供给生物呼吸
支持燃料燃烧
钢铁冶炼和金属焊接
那么我们该如何获得氧气呢?
分离液态空气
植物光合作用
电解水
加热氧化汞(拉瓦锡)
需要较高的技术条件,在实验室当中难以做到
有没有简单、方便、快捷的方法来制取氧气呢?
制得氧气的原料必须是含氧的物质
渔民为了缓解鱼塘缺氧问题,向鱼塘中加入增氧剂“氧来乐”,其有效成分为过氧化氢,过氧化氢在水中会产生少量的微小氧气泡
一、创设情境 导入新课
知识
窗口
过氧化氢能产生氧气,实验室能否用过氧化氢制氧气?
反应条件简单
二、新课讲授 建立模型
在实验室里制取一种气体时,首先要选择反应物,知道如何控制反应条件,然后要确定气体发生和收集装置,最后要审查整个反应体系是否符合环保、安全的要求。
(一)实验室制取氧气(气体物质)的思路
反应物:
制得氧气的原料必须是含氧的物质
且易获得(经济实惠)
反应条件:
容易控制
制取氧气
反应装置:
容易搭配
绿色
环保
安全
过氧化氢能产生氧气,实验室能否用过氧化氢制氧气?
二、新课讲授 建立模型
(二)实验室制取氧气的方法
反应物:
过氧化氢H2O2
纯过氧化氢是淡蓝色的黏稠液体,可任意比例与水混溶,水溶液俗称双氧水,为无色透明液体。其水溶液适用于医用伤口消毒及环境消毒和食品消毒。在一般情况下会缓慢分解成水和氧气,但分解速度极其慢,加快其反应速度的办法是加入催化剂,如二氧化锰等物质。
回答问题
过氧化氢分解生成什么物质?
有什么方法可以检验氧气的生成?
什么是催化剂?
生成水和二氧化碳
带火星的木条
能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质叫做催化剂
二、新课讲授 建立模型
(二)实验室制取氧气的方法
反应物:
过氧化氢H2O2
过氧化氢
水 + 氧气
二氧化锰
H2O2
二氧化锰
H2O + O2
二氧化锰MnO2作为催化剂,起到了催化作用,加快了过氧化氢的分解
只是加快,不是加量!
2H2O2
二氧化锰
2H2O + O2 ↑
反应条件:
二氧化锰催化
反应装置:
如何控制反应的进行?
二、新课讲授 建立模型
(二)实验室制取氧气的方法
反应物:
过氧化氢H2O2
2H2O2
二氧化锰
2H2O + O2 ↑
反应条件:
二氧化锰催化
反应装置:
如何控制反应的进行?
分液漏斗
二、新课讲授 建立模型
(二)实验室制取氧气的方法
反应物:
过氧化氢H2O2
2H2O2
二氧化锰
2H2O + O2 ↑
反应条件:
二氧化锰催化
反应装置:
如何收集氧气?
二、新课讲授 建立模型
(二)实验室制取氧气的方法
收集气体的方法
二、新课讲授 建立模型
(二)实验室制取氧气的方法
收集气体的方法
适用气体:
不与空气反应,且密度与空气有较大差距
向下排空气法
向上排空气法
分类:
向下排空气法
向上排空气法
密度比空气小
密度比空气大
上、下是指空气被排出的方向
氢气H2
氧气O2 、
二氧化碳CO2
二、新课讲授 建立模型
(二)实验室制取氧气的方法
收集气体的方法
适用气体:
不与水反应且溶解度小
氢气H2 、氧气O2 、氮气N2
先将集气瓶中盛满水, 用玻璃片盖住瓶口,然后倒立在水槽中。
当导管口有气泡连续、均匀地产生时,再把管口伸入盛满水的集气瓶里,等瓶里的水排完以后,在水里用玻璃片盖住瓶 口,将集气瓶移出水槽,放在桌面上。
密度比空气小:倒放在桌面上
密度比空气大:正放在桌面上
二、新课讲授 建立模型
(二)实验室制取氧气的方法
收集气体的方法
选择气体收集装置的依据:密度、溶解性
二、新课讲授 建立模型
(二)实验室制取氧气的方法
反应物:
过氧化氢H2O2
2H2O2
二氧化锰
2H2O + O2 ↑
反应条件:
二氧化锰催化
反应装置:
分液漏斗
排水法
二、新课讲授 建立模型
(二)实验室制取氧气的方法
实验原理:
2H2O2
二氧化锰
2H2O + O2 ↑
实验步骤:
检验装置气密性
二、新课讲授 建立模型
(二)实验室制取氧气的方法
二、新课讲授 建立模型
(二)实验室制取氧气的方法
二、新课讲授 建立模型
(二)实验室制取氧气的方法
实验原理:
2H2O2
二氧化锰
2H2O + O2 ↑
实验步骤:
1、检验装置气密性
法1:关闭分液漏斗活塞,用手握住锥形瓶,导管口有气泡冒出,移开双手后,导管内液面逐渐上升,并能形成一段稳定的水柱,说明气密性良好
法2:关闭止水夹和分液漏斗活塞,向分液漏斗内加水,水不向下流动,打开分液漏斗活塞,水不流入锥形瓶中,说明气密性良好
二、新课讲授 建立模型
(二)实验室制取氧气的方法
二、新课讲授 建立模型
(二)实验室制取氧气的方法
实验原理:
2H2O2
二氧化锰
2H2O + O2 ↑
实验步骤:
检验装置气密性
在锥形瓶中加入二氧化锰,分液漏斗中加入过氧化氢溶液,向集气瓶中注满水并倒放在水槽中
打开分液漏斗活塞,待导管口处有稳定气泡冒出时开始收集气体
瓶口有气泡冒出时,取出导管,用玻璃片盖好瓶口取出,将集气瓶正立在桌面上
排出锥形瓶及导管中的空气
二、新课讲授 建立模型
(二)实验室制取氧气的方法
实验原理:
2H2O2
二氧化锰
2H2O + O2 ↑
实验步骤:
检验装置气密性
在锥形瓶中加入二氧化锰,分液漏斗中加入过氧化氢溶液,向集气瓶中注满水并倒放在水槽中
打开分液漏斗活塞,待导管口处有稳定气泡冒出时开始收集气体
瓶口有气泡冒出时,取出导管,用玻璃片盖好瓶口取出,将集气瓶正立在桌面上
验满:将带火星的木条放在集气瓶口处,如果木条复燃,则氧气已收集满
二、新课讲授 建立模型
(二)实验室制取氧气的方法
二氧化锰MnO2作为催化剂,起到了催化作用,加快了过氧化氢的分解
关于催化剂:
能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质叫做催化剂
加快或降低
不管是加快还是减慢反应速率,催化剂不改变反应产物的量,只是改变反应时间
问题:1.如何证明二氧化锰反应前后没有变化?
2.如何证明二氧化锰加快了反应速率?
3.如果证明二氧化锰只改变反应时间不改变反应产物的多少?
二、新课讲授 建立模型
(二)实验室制取氧气的方法
关于催化剂:
问题:1.如何证明二氧化锰反应前后没有变化?
质量
化学性质
反应前后分别称取二氧化锰的质量,质量前后不变
用二氧化锰催化一次实验过后,洗净,再次进行催化过氧化氢分解的实验,二氧化锰仍能加快反应速率
二、新课讲授 建立模型
(二)实验室制取氧气的方法
关于催化剂:
问题:2.如何证明二氧化锰加快了反应速率?
设计对照实验:在有二氧化锰催化和无二氧化锰催化两种情况下,记录过氧化氢溶液产生相同体积氧气所需的时间
问题:3.如果证明二氧化锰只改变反应时间不改变反应产物的多少?
设计对照实验:量取两份相同体积的过氧化氢溶液,一份加入二氧化锰,一份不加,记录两份溶液反应完毕后产生的氧气体积
二、新课讲授 建立模型
(二)实验室制取氧气的方法
利用其他含有氧元素的物质,例如加热高锰酸钾 (KMnO4)、氯酸钾(KClO3)等也可以制得氧气。
2H2O2
二氧化锰
2H2O + O2 ↑
2KMnO4 K2MnO4+MnO2+O2↑
2KClO3 2KCl+3O2 ↑
MnO2
△
不够经济实惠
三、课堂总结 巩固练习
2H2O2
二氧化锰
2H2O + O2 ↑
三、课堂总结 巩固练习
课堂练习
1、人类的生产和生活都离不开氧气,有关氧气的认识错误的是:
A.木炭在氧气中燃烧比在空气中燃烧更旺
B.工业上可以通过分离液态空气制取氧气
C.氧气易溶于水,不能用排水法收集
D.实验室中可用过氧化氢溶液和二氧化锰制取氧气
解析:氧气不易溶于水,可以用排水法收集
三、课堂总结 巩固练习
课堂练习
2、在实验室中利用如图装置,可以进行的实验是:
①过氧化氢溶液与MnO2制取氧气
②用高锰酸钾固体制取氧气
③用KClO3与MnO2的混合物制取氧气。
长颈漏斗
为防止气体通过漏斗溢出,长颈漏斗下端需浸没在液体中
三、课堂总结 巩固练习
课堂练习
3、下列关于催化剂的叙述中,正确的是:
A.一种物质只能催化一个反应
B.一个反应只能有一种催化剂
C.一定可以提高生成物的产量
D.一定可以改变反应速度速率
解析:
A.不一定,一种物质可能能催化多个反应
B.不一定
C.不改变产量,只改变速率
三、课堂总结 巩固练习
课堂练习
4、推理是学习化学的一种重要方法,但推理必须科学、严谨。下列推理正确的是:
A.化合物含有不同种元素,所以含不同种元素的物质一定是化合物B. 氧气是由氧元素组成的,所以制取氧气的反应物中一定含有氧元素
C.催化剂在反应前后质量不变,因此反应前后质量不变的物质一定是催化剂
解析:
A.不一定,含不同种元素的物质还可能是混合物
C.催化剂需要满足反应前后质量和化学性质均不变
三、课堂总结 巩固练习
课堂练习
5、下列关于产生氧气方法的叙述中,错误的是
A.空气中的氧气主要来自于植物的光合作用
B.工业上用分离液态空气的方法制取氧气是化学变化
C.用含有氧元素的物质反应才有可能产生氧气
D.实验室常用加热高锰酸钾的方法制取氧气
解析:B.分离液态空气是物理变化
谢谢观看
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
