2.3 原子的结构(第一课时)(课件22页)2022-2023学年九年级化学上册同步精品课堂(鲁教版)
文档属性
| 名称 | 2.3 原子的结构(第一课时)(课件22页)2022-2023学年九年级化学上册同步精品课堂(鲁教版) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-08 08:52:06 | ||
图片预览








文档简介
(共22张PPT)
第三节 原子的结构
(第一课时)
第二单元 探秘水世界
PART
01
PART
02
知道原子是由原子核和核外电子构成的,记住核电荷数、质子数和核外电子数的关系。
知道原子是构成物质的一种基本微粒,知道原子的性质。
学习目标
从微观角度来看,化学反应的实质是分子破裂为原子,原子重新组成新的分子。化学变化前后分子的种类一定改变,而原子的种类、数目不变。
原子是化学变化中的最小粒子
原子能不能再分呢?原子是由什么构成的呢?
1.原子结构发展史
(1)公元前5世纪,希腊哲学家德谟克利特等人认为 :万物是由大量的不可分割的微粒构成的,即由原子构成的。
(2)19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。
一、原子的结构
(3)1897年,英国科学家汤姆森发现了电子。 他提出原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子。
汤姆森原子模型
英国物理学家汤姆森
英国科学家卢瑟福
(1871~1937)
(4)α粒子散射实验(1909年)
卢瑟福和他的助手做了著名α粒子散射实验。根据实验,卢瑟福在1911年提出原子有核模型。
卢瑟福的原子结构模型
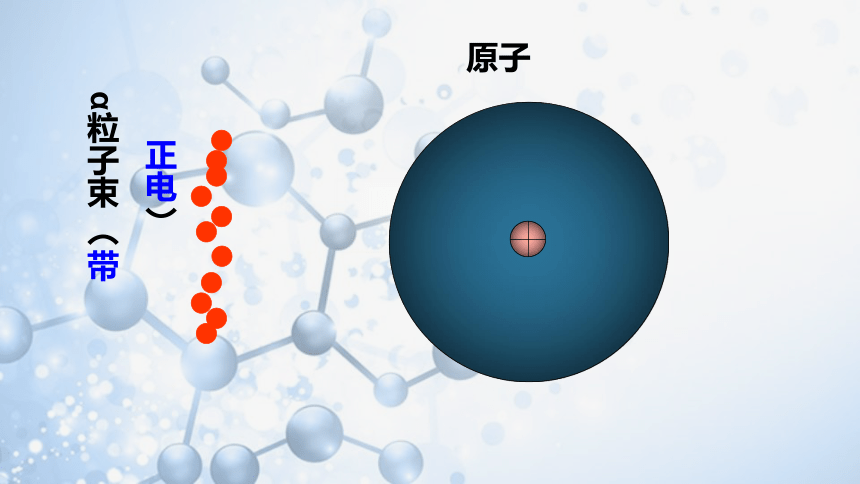
1911年,英国科学家卢瑟福用一束平行高速运动的α粒子(α粒子是带两个单位正电荷的氦原子)轰击金箔。
α粒子散射实验
原子
正电)
α粒子束 (带
原子
α粒子束
α粒子是带正电、质量比电子大的多的微粒
大多数α粒子未发生偏转
少数α粒子发生偏转
α粒子束
极少数α粒子被反弹
为什么绝大多数的α粒子能够顺利穿过金箔,而只有少数被反弹回来?
如果你当时在场,发现了这一出乎意料的现象后,你会怎么想呢?
绝大部分α粒子没有或遇到极小的阻力,而少数α粒子遇到了较大的阻力。这种阻力来自质量较大的原子核。
【交流共享】
原子
原子核
核外电子
质子(每个质子带一个单位正电荷)
中子(不带电)
(每个电子带一个单位的负电荷)
注:质子和中子的质量差不多,都比电子的质量大得多,约为电子质量的1836倍。
(带正电)
(不显电性)
2.原子的构成
你知道原子核
到底有多大吗?
万人体育场如同:
原子
蚂蚁 2 mm
原子核
名称 符号 原子核 核外电子数
质子数 中子数 氢 H 1 0 1
碳 C 6 6 6
氧 O 8 8 8
钠 Na 11 12 11
氯 Cl 17 18 17
碳-12 C-12 6 6 6
碳-13 C-13 6 7 6
碳-14 C-14 6 8 6
分析表中信息,看看能得出哪些结论?
【活动天地】
1.在原子里,核电荷数= = 。
2.质子数 中子数
3.原子中 含有中子
4.不同的原子其 不同。
5.不同的原子其核内所含的 不同
……
核内质子数
核外电子数
不一定等于
不一定
核内质子数(即核电荷数)
质子数和中子数
分析上表数据得出结论
(1)构成物质的一种基本微粒
(2)由原子直接构成的三类物质
①金属(金、汞等)
②稀有气体(氦气、氖气、氩气等)
③固态非金属单质(金刚石、硅等)
3.原子
(2)原子的性质
①原子体积和质量很小;
②原子总在不断运动;
③原子间有间隔。
用事实说话:
金属原子都在做无规则振动,当你把两块金属压紧的时候,界面的原子甚至可以互相渗透。
当你加热金属的时候,金属原子的运动会加快,甚至脱离力的束缚,变成液体和气体,这和冰变成水和水蒸气同理。
典型例题
知识点:原子的构成
【典例】(2022江西)原子中质子数一定等于_____
A.中子数 B.核电荷数 C.相对原子质量 D._____________
B
电子数(或原子序数)
课堂达标
1.(2022泰安改编)下列物质是由原子构成的是( )
A. 氯化钠 B. 水 C. 金刚石 D. 甲烷
C
2.下列关于原子的叙述中,错误的是( )
A.原子呈电中性 B.原子是实心球体
C.原子由原子核与核外电子构成
D.原子可以构成分子
B
3.(2022临沂)构建化学基本观念是学好化学的基础。下列对化学基本观念的认识,不正确的是( )
A. 结构观:H2O和H2O2化学性质不同,因为它们分子的构成不同
B. 分类观:根据组成元素的异同,可将纯净物分为单质和化合物
C. 变化观:在一定条件下,CO2和CO可以相互转化
D. 微粒观:所有原子的原子核都是由质子和中子构成的
D
4.(2022烟台)下列有关化学史的叙述错误的是( )
A.汤姆森发现电子
B.卢瑟福发现原子核
C.门捷列夫编制了元素周期表
D.拉瓦锡发现酸碱指示剂
D
课堂小结
1. 原子
原子核
核外电子
质子
(每个质子带一个单位正电荷)
(不带电)
(每个电子带一个单位负电荷)
原子的构成
2.在原子里,核电荷数=核内质子数=核外电子数
中子
第三节 原子的结构
(第一课时)
第二单元 探秘水世界
PART
01
PART
02
知道原子是由原子核和核外电子构成的,记住核电荷数、质子数和核外电子数的关系。
知道原子是构成物质的一种基本微粒,知道原子的性质。
学习目标
从微观角度来看,化学反应的实质是分子破裂为原子,原子重新组成新的分子。化学变化前后分子的种类一定改变,而原子的种类、数目不变。
原子是化学变化中的最小粒子
原子能不能再分呢?原子是由什么构成的呢?
1.原子结构发展史
(1)公元前5世纪,希腊哲学家德谟克利特等人认为 :万物是由大量的不可分割的微粒构成的,即由原子构成的。
(2)19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。
一、原子的结构
(3)1897年,英国科学家汤姆森发现了电子。 他提出原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子。
汤姆森原子模型
英国物理学家汤姆森
英国科学家卢瑟福
(1871~1937)
(4)α粒子散射实验(1909年)
卢瑟福和他的助手做了著名α粒子散射实验。根据实验,卢瑟福在1911年提出原子有核模型。
卢瑟福的原子结构模型
1911年,英国科学家卢瑟福用一束平行高速运动的α粒子(α粒子是带两个单位正电荷的氦原子)轰击金箔。
α粒子散射实验
原子
正电)
α粒子束 (带
原子
α粒子束
α粒子是带正电、质量比电子大的多的微粒
大多数α粒子未发生偏转
少数α粒子发生偏转
α粒子束
极少数α粒子被反弹
为什么绝大多数的α粒子能够顺利穿过金箔,而只有少数被反弹回来?
如果你当时在场,发现了这一出乎意料的现象后,你会怎么想呢?
绝大部分α粒子没有或遇到极小的阻力,而少数α粒子遇到了较大的阻力。这种阻力来自质量较大的原子核。
【交流共享】
原子
原子核
核外电子
质子(每个质子带一个单位正电荷)
中子(不带电)
(每个电子带一个单位的负电荷)
注:质子和中子的质量差不多,都比电子的质量大得多,约为电子质量的1836倍。
(带正电)
(不显电性)
2.原子的构成
你知道原子核
到底有多大吗?
万人体育场如同:
原子
蚂蚁 2 mm
原子核
名称 符号 原子核 核外电子数
质子数 中子数 氢 H 1 0 1
碳 C 6 6 6
氧 O 8 8 8
钠 Na 11 12 11
氯 Cl 17 18 17
碳-12 C-12 6 6 6
碳-13 C-13 6 7 6
碳-14 C-14 6 8 6
分析表中信息,看看能得出哪些结论?
【活动天地】
1.在原子里,核电荷数= = 。
2.质子数 中子数
3.原子中 含有中子
4.不同的原子其 不同。
5.不同的原子其核内所含的 不同
……
核内质子数
核外电子数
不一定等于
不一定
核内质子数(即核电荷数)
质子数和中子数
分析上表数据得出结论
(1)构成物质的一种基本微粒
(2)由原子直接构成的三类物质
①金属(金、汞等)
②稀有气体(氦气、氖气、氩气等)
③固态非金属单质(金刚石、硅等)
3.原子
(2)原子的性质
①原子体积和质量很小;
②原子总在不断运动;
③原子间有间隔。
用事实说话:
金属原子都在做无规则振动,当你把两块金属压紧的时候,界面的原子甚至可以互相渗透。
当你加热金属的时候,金属原子的运动会加快,甚至脱离力的束缚,变成液体和气体,这和冰变成水和水蒸气同理。
典型例题
知识点:原子的构成
【典例】(2022江西)原子中质子数一定等于_____
A.中子数 B.核电荷数 C.相对原子质量 D._____________
B
电子数(或原子序数)
课堂达标
1.(2022泰安改编)下列物质是由原子构成的是( )
A. 氯化钠 B. 水 C. 金刚石 D. 甲烷
C
2.下列关于原子的叙述中,错误的是( )
A.原子呈电中性 B.原子是实心球体
C.原子由原子核与核外电子构成
D.原子可以构成分子
B
3.(2022临沂)构建化学基本观念是学好化学的基础。下列对化学基本观念的认识,不正确的是( )
A. 结构观:H2O和H2O2化学性质不同,因为它们分子的构成不同
B. 分类观:根据组成元素的异同,可将纯净物分为单质和化合物
C. 变化观:在一定条件下,CO2和CO可以相互转化
D. 微粒观:所有原子的原子核都是由质子和中子构成的
D
4.(2022烟台)下列有关化学史的叙述错误的是( )
A.汤姆森发现电子
B.卢瑟福发现原子核
C.门捷列夫编制了元素周期表
D.拉瓦锡发现酸碱指示剂
D
课堂小结
1. 原子
原子核
核外电子
质子
(每个质子带一个单位正电荷)
(不带电)
(每个电子带一个单位负电荷)
原子的构成
2.在原子里,核电荷数=核内质子数=核外电子数
中子
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
