化学人教版(2019)选择性必修1 1.2.1盖斯定律(共26张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 1.2.1盖斯定律(共26张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-07 15:50:26 | ||
图片预览








文档简介
(共26张PPT)
2、299 K时, N2 (g) + 3H2 (g) 2NH3 ( g ) △H = -92.0 kJ/mol,将此温度下的1 molN2 和3mol H2 放在一密闭隔热容器中,在催化剂下进行反应,测得反应放出的热量为( )
A.一定大于92.0 kJ B. 一定等于92.0 kJ
C. 一定小于92.0 kJ D. 不能确定
C
第2节 反应热的计算
盖斯定律
反应热的计算
第一章
盖斯定律
01
利用盖斯定律进行计算
02
许多反应热可以通过实验直接测定测量。但是
有些反应热是无法直接测定的。如:
但这个反应热是冶金工业中非常有用的数据,应该如何获得呢?
C(s) + O2(g) = CO(g)
盖斯定律
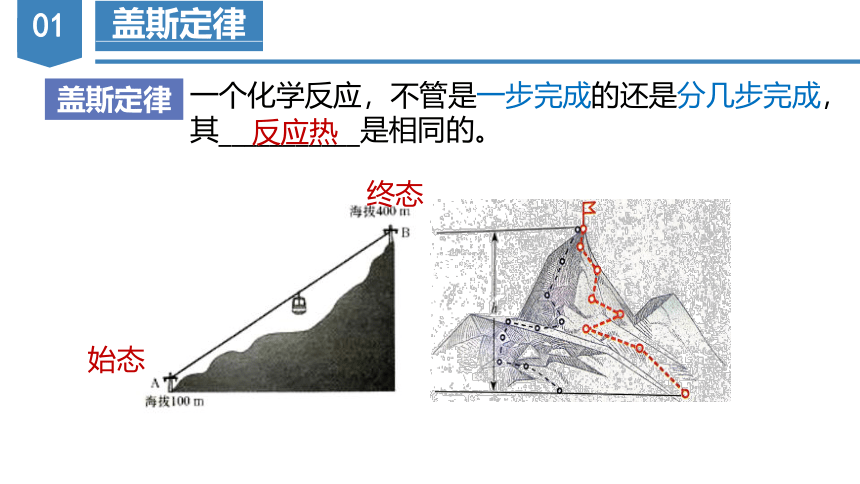
盖斯定律
一个化学反应,不管是一步完成的还是分几步完成,其___________是相同的。
反应热
盖斯定律
始态
终态
在一定条件下,化学反应的__________只与反应体系的_______和________有关,而与反应的______无关
盖斯定律
反应热
始态
终态
途径
ΔH
ΔH1 + ΔH2
=
ΔH3 + ΔH4 + ΔH5
=
途径一
途径三
途径二
盖斯定律
盖斯定律的意义
有些反应的反应热难以直接测定,如:
(1)有些反应进行得很慢
(2)有些反应不容易直接发生
(3)有些反应的产品不纯(有副反应发生)
利用盖斯定律可以间接计算出来。
利用盖斯定律进行计算
反应热的计算
ΔH1 = ΔH2 + ΔH3
C(s) + O2(g) = CO(g)
该反应的反应热无法直接测定,
但下列两个反应的反应热却可以直接测定:
C(s) + O2(g) = CO2(g) ΔH1 =﹣393.5 kJ/mol
CO(g) + O2(g) = CO2(g) ΔH2 =﹣283.0 kJ/mol
ΔH3
根据盖斯定律
= -393.5 kJ/mol-( -283.0 kJ/mol )
= -110.5 kJ/mol
ΔH3 = ΔH1 – ΔH2
“虚拟路径法”
反应热的计算
1、目标方程中找唯一
3、同加异减
【方法步骤】
2、化系数
目标方程式中的物质:在给出的各个已知方程式中只出现一次
目标方程式中的物质:
与已知方程式中物质在方程式的同侧,则相加;
与已知方程式中物质在方程式的异侧,则相减;
把已知方程式中的系数化成与目标方程式中物质的系数一致。
加合法
反应热的计算
加合法
火箭发射时可以用肼(N2H4,液态)作燃料,NO2作氧化剂。
已知:① N2(g) + 2O2(g) = 2NO2(g) △H1= +66.4 kJ/mol
② N2H4(l) + O2(g) = N2(g) + 2H2O(g) △H2= -534 kJ/mol
试计算 2N2H4(l) + 2NO2(g) = 3N2(g) + 4H2O(g) 的△H。
②×2-①
△H= - 1134.4kJ/mol
反应热的计算
【易错总结】
加合法
(1)热化学方程式颠倒, ΔH 的符号也要改变。
(2)计量数加倍,ΔH 也要加倍。
(3)热化学方程式加减时,ΔH 加减要带“+”“-”运算。
(4)热化学方程式加减时,同种物质可相加减。
反应热的计算
加合法
反应热的计算
加合法
反应热的计算
加合法
反应热的计算
加合法
反应热的计算
反应热的计算
反应热的计算
反应热的计算
反应热的计算
盖斯定律
盖斯定理的应用
含义:一个化学反应,不管是一步完成的
还是分几步完成,其反应热是相同的
一定条件下,化学反应的反应热只与反应体系的始态和终态有关,与反应的途径无关
1、目标方程中找唯一
2、同加异减
3、化系数
第3课 盖斯定律
反应热 的计算
反应热的计算
3. 已知下列热化学方程式:
① CH3COOH(l)+ 2O2(g) ═2CO2(g)+2H2O(l) ΔH1=﹣870.3 kJ/mol
② C (s) + O2(g)═CO2(g) ΔH2=﹣393.5 kJ/mol
③ H2(g) + O2(g)═H2O(l) ΔH3=﹣285.8 kJ/mol
则反应 2C(s) +2H2(g)+O2(g)=CH3COOH(l)的焓变ΔH为( )
A.244.15kJ mol﹣1 B.﹣224.15kJ mol﹣1
C.488.3kJ mol﹣1 D.﹣488.3kJ mol﹣1
在方程式中只出现一次
同加异减,化系数
D
1. 已知: ① C(s)+O2(g)═CO2(g) ΔH1
② 2CO(g)+O2(g)═2CO2(g) ΔH2
③ TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g) ΔH3
则反应 TiO2(s)+2Cl2(g)+2C(s)═TiCl4(s)+2CO(g)
的 ΔH为( )
A.ΔH3+2ΔH1+2ΔH2 B.ΔH3+2ΔH1+ΔH2
C.ΔH3+2ΔH1﹣2ΔH2 D.ΔH3+2ΔH1﹣ΔH2
D
2、氧化亚铜常用于制船底防污漆,用CuO与Cu高温烧结可制取Cu2O.
已知反应:
2Cu(s)+O2(g)═2CuO(s) ΔH=﹣314kJ/mol
2Cu2O(s)+O2(g)═4CuO(s) ΔH=﹣292kJ/mol
则 CuO(s)+Cu(s)═ Cu2O(s)的 ΔH 等于( )
A.﹣11kJ/mol B.+11kJ/mol
C.+22kJ/mol D.﹣22kJ/mol
A
2、299 K时, N2 (g) + 3H2 (g) 2NH3 ( g ) △H = -92.0 kJ/mol,将此温度下的1 molN2 和3mol H2 放在一密闭隔热容器中,在催化剂下进行反应,测得反应放出的热量为( )
A.一定大于92.0 kJ B. 一定等于92.0 kJ
C. 一定小于92.0 kJ D. 不能确定
C
第2节 反应热的计算
盖斯定律
反应热的计算
第一章
盖斯定律
01
利用盖斯定律进行计算
02
许多反应热可以通过实验直接测定测量。但是
有些反应热是无法直接测定的。如:
但这个反应热是冶金工业中非常有用的数据,应该如何获得呢?
C(s) + O2(g) = CO(g)
盖斯定律
盖斯定律
一个化学反应,不管是一步完成的还是分几步完成,其___________是相同的。
反应热
盖斯定律
始态
终态
在一定条件下,化学反应的__________只与反应体系的_______和________有关,而与反应的______无关
盖斯定律
反应热
始态
终态
途径
ΔH
ΔH1 + ΔH2
=
ΔH3 + ΔH4 + ΔH5
=
途径一
途径三
途径二
盖斯定律
盖斯定律的意义
有些反应的反应热难以直接测定,如:
(1)有些反应进行得很慢
(2)有些反应不容易直接发生
(3)有些反应的产品不纯(有副反应发生)
利用盖斯定律可以间接计算出来。
利用盖斯定律进行计算
反应热的计算
ΔH1 = ΔH2 + ΔH3
C(s) + O2(g) = CO(g)
该反应的反应热无法直接测定,
但下列两个反应的反应热却可以直接测定:
C(s) + O2(g) = CO2(g) ΔH1 =﹣393.5 kJ/mol
CO(g) + O2(g) = CO2(g) ΔH2 =﹣283.0 kJ/mol
ΔH3
根据盖斯定律
= -393.5 kJ/mol-( -283.0 kJ/mol )
= -110.5 kJ/mol
ΔH3 = ΔH1 – ΔH2
“虚拟路径法”
反应热的计算
1、目标方程中找唯一
3、同加异减
【方法步骤】
2、化系数
目标方程式中的物质:在给出的各个已知方程式中只出现一次
目标方程式中的物质:
与已知方程式中物质在方程式的同侧,则相加;
与已知方程式中物质在方程式的异侧,则相减;
把已知方程式中的系数化成与目标方程式中物质的系数一致。
加合法
反应热的计算
加合法
火箭发射时可以用肼(N2H4,液态)作燃料,NO2作氧化剂。
已知:① N2(g) + 2O2(g) = 2NO2(g) △H1= +66.4 kJ/mol
② N2H4(l) + O2(g) = N2(g) + 2H2O(g) △H2= -534 kJ/mol
试计算 2N2H4(l) + 2NO2(g) = 3N2(g) + 4H2O(g) 的△H。
②×2-①
△H= - 1134.4kJ/mol
反应热的计算
【易错总结】
加合法
(1)热化学方程式颠倒, ΔH 的符号也要改变。
(2)计量数加倍,ΔH 也要加倍。
(3)热化学方程式加减时,ΔH 加减要带“+”“-”运算。
(4)热化学方程式加减时,同种物质可相加减。
反应热的计算
加合法
反应热的计算
加合法
反应热的计算
加合法
反应热的计算
加合法
反应热的计算
反应热的计算
反应热的计算
反应热的计算
反应热的计算
盖斯定律
盖斯定理的应用
含义:一个化学反应,不管是一步完成的
还是分几步完成,其反应热是相同的
一定条件下,化学反应的反应热只与反应体系的始态和终态有关,与反应的途径无关
1、目标方程中找唯一
2、同加异减
3、化系数
第3课 盖斯定律
反应热 的计算
反应热的计算
3. 已知下列热化学方程式:
① CH3COOH(l)+ 2O2(g) ═2CO2(g)+2H2O(l) ΔH1=﹣870.3 kJ/mol
② C (s) + O2(g)═CO2(g) ΔH2=﹣393.5 kJ/mol
③ H2(g) + O2(g)═H2O(l) ΔH3=﹣285.8 kJ/mol
则反应 2C(s) +2H2(g)+O2(g)=CH3COOH(l)的焓变ΔH为( )
A.244.15kJ mol﹣1 B.﹣224.15kJ mol﹣1
C.488.3kJ mol﹣1 D.﹣488.3kJ mol﹣1
在方程式中只出现一次
同加异减,化系数
D
1. 已知: ① C(s)+O2(g)═CO2(g) ΔH1
② 2CO(g)+O2(g)═2CO2(g) ΔH2
③ TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g) ΔH3
则反应 TiO2(s)+2Cl2(g)+2C(s)═TiCl4(s)+2CO(g)
的 ΔH为( )
A.ΔH3+2ΔH1+2ΔH2 B.ΔH3+2ΔH1+ΔH2
C.ΔH3+2ΔH1﹣2ΔH2 D.ΔH3+2ΔH1﹣ΔH2
D
2、氧化亚铜常用于制船底防污漆,用CuO与Cu高温烧结可制取Cu2O.
已知反应:
2Cu(s)+O2(g)═2CuO(s) ΔH=﹣314kJ/mol
2Cu2O(s)+O2(g)═4CuO(s) ΔH=﹣292kJ/mol
则 CuO(s)+Cu(s)═ Cu2O(s)的 ΔH 等于( )
A.﹣11kJ/mol B.+11kJ/mol
C.+22kJ/mol D.﹣22kJ/mol
A
