河南省通许县2022-2023学年高二上学期9月开学联考化学试卷(Word版含答案)
文档属性
| 名称 | 河南省通许县2022-2023学年高二上学期9月开学联考化学试卷(Word版含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 249.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-07 00:00:00 | ||
图片预览




文档简介
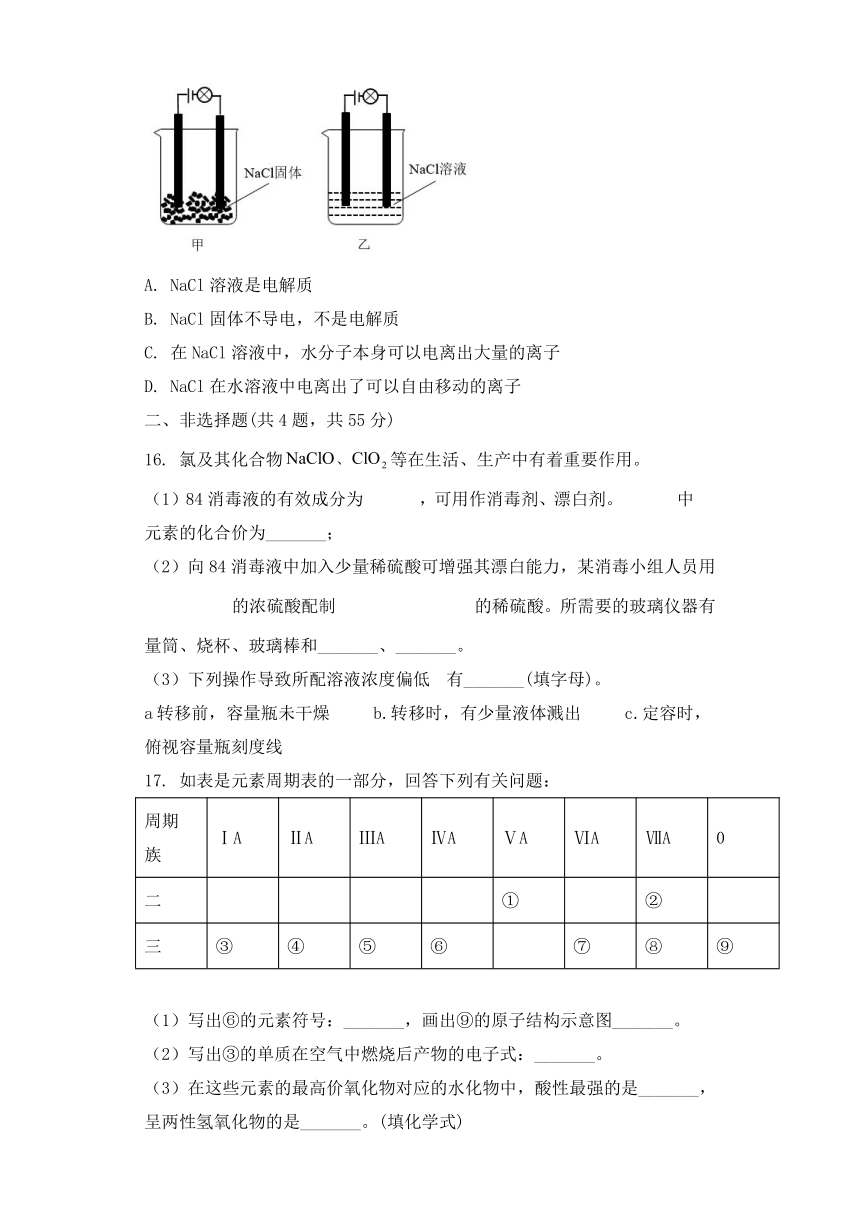
通许县2022-2023学年高二上学期9月开学联考
化学试卷
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Si-28 S-32 Cl-35.5 Fe-56 Cu-64
一、选择题(共15题,每题只有一个选项符合题意,每题3分,共45分)
1. 合金的应用极大地促进了人类社会的发展。下列不属于合金的是
A B C D
狗头兽首铜像 精美的青花瓷 流通硬币 地铁列车的车体
A. A B. B C. C D. D
2. 溶液、胶体和浊液这三种分散系根本区别是
A. 是否透明 B. 分散质粒子的大小
C. 能否透过滤纸 D. 是否具有丁达尔效应
3下列仪器中,配制一定物质的量浓度的溶液时不需要的是( )
A. 烧杯 B. 容量瓶
C. 胶头滴管 D. 分液漏斗
4.分类法在化学发展中起到非常重要的作用,下列分类标准合理的是( )
A. 根据化合物在水溶液中能否导电,将化合物分为电解质和非电解质
B. 根据分散系是否具有丁达尔效应,将分散系分为溶液、胶体和浊液
C. 根据化学式中所含氢原子的个数,将酸分为一元酸、二元酸和多元酸
D. 根据反应中是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应
5.下列说法不正确的是( )
A. “抗坏血酸”维生素具有还原性
B. 杨万里戏笔中写道“野菊荒苔各铸钱,金黄铜绿两争妍”,铜绿的主要成分为碱式碳酸铜,属于碱式盐
C. 向碳酸钠溶液中滴加稀盐酸,先不冒气泡,后冒气泡
D. 食物腐败、胶体的制备、植物光合作用都与氧化还原反应有关
6.下列无色溶液在强酸性条件下能大量共存的是( )
A. 、、、 B. 、、、
C. 、、、 D. 、、、
7.下列物质长期露置于空气中会变质,但不涉及氧化还原反应的是( )
A. B. C. D. 氯水
8. 铁粉具有平肝镇心,消痈解毒之功效,主治惊痛、癫狂、脚气冲心、贫血等。某兴趣小组探究利用反应:H2+FeCO3Fe+CO2↑+H2O↑制取铁粉并检验气体产物实验装置如图。下列说法不正确的是
A. 通过调节分液漏斗的活塞可以控制①中气泡产生快慢
B. 装置①中的试剂是浓硫酸,目的是干燥氢气
C. 装置②中的试剂是无水硫酸铜,目的是检验水蒸气
D. 为防止④中挥发的气体进入②中干扰检验,③中应盛放碱石灰
9. 实验室制备Cl2的反应为MnO2+4HCl(浓)Mn2++Cl2↑+2H2O。下列说法错误的是( )
A. 该反应中HCl作还原剂,MnO2作氧化剂
B. 每生成1molCl2,转移2mol电子
C. 每消耗1molMnO2,有4molHCl被氧化
D. 利用该反应制备的Cl2粗产品中,除含有水蒸气外,还含有HCl气体
10. 下列化合物能通过相应单质直接化合而成的是
A. FeCl2 B. NO2 C. Na2O2 D. SO3
11. NA表示阿伏加德罗常数。下列叙述中正确的是
A. 标准状况下,22.4 L水中含有的水分子数为NA
B. 4.0 g NaOH固体溶于100 mL水中,得到1 mol·L 1的NaOH溶液
C. 常温、常压下,22 g CO2中含有的氧原子数为NA
D. 1 L 0.5 mol·L 1 Na2SO4溶液中,含有的氧原子总数为2NA
12. 下列有关物质分类的叙述正确的是
A. CaCl2、NaOH、HCl、O2四种物质都属于化合物
B. 溶液、浊液、胶体都属于混合物
C. 硫酸、纯碱、硝酸钠和生石灰分别属于酸、碱、盐和碱性氧化物
D. CO2、CO等非金属氧化物均属于酸性氧化物
13. NA表示阿佛加德罗常数,下列说法正确的是
A. 36gH2O的物质的量为1mol
B. 常温常压下,1molCl2的体积是22.4L
C. 0.5mol·L-1NaCl溶液中含有0.5molNa+
D. 1molCO2中含有的分子数为NA
14. 化学科学需要借助化学专用语言描述,下列化学用语表达正确的是
A. CO2的电子式 B. Cl﹣的结构示意图为
C. 氮气的结构式为N-N D. 质量数为37的氯原子为Cl
15. 某化学兴趣小组在实验室进行化学实验,按照甲图连接好线路发现灯泡不亮,按照乙图连接好线路发现灯泡亮,由此得出的结论正确的是
A. NaCl溶液是电解质
B. NaCl固体不导电,不是电解质
C. 在NaCl溶液中,水分子本身可以电离出大量的离子
D. NaCl在水溶液中电离出了可以自由移动的离子
二、非选择题(共4题,共55分)
16. 氯及其化合物等在生活、生产中有着重要作用。
(1)84消毒液的有效成分为,可用作消毒剂、漂白剂。中元素的化合价为_______;
(2)向84消毒液中加入少量稀硫酸可增强其漂白能力,某消毒小组人员用的浓硫酸配制的稀硫酸。所需要的玻璃仪器有量筒、烧杯、玻璃棒和_______、_______。
(3)下列操作导致所配溶液浓度偏低有_______(填字母)。
a转移前,容量瓶未干燥 b.转移时,有少量液体溅出 c.定容时,俯视容量瓶刻度线
17. 如表是元素周期表的一部分,回答下列有关问题:
周期 族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
二 ① ②
三 ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨
(1)写出⑥的元素符号:_______,画出⑨的原子结构示意图_______。
(2)写出③的单质在空气中燃烧后产物的电子式:_______。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的是_______,呈两性氢氧化物的是_______。(填化学式)
(4)用电子式表示出④的氯化物的形成过程:_______。
(5)写出实验室制取⑧的单质的化学方程式:_______。
18. 日常生活及化学实验中,许多反应都发生在溶液之间,溶液的浓度大小对于某一化学反应能否发生、反应产物以及反应快慢等因素有着十分重要的影响。准确配制一定物质的量浓度的溶液,对于化学学习至关重要。
I.实验室要配制500mL0.1mol/LNaOH溶液,请回答下列问题:
(1)配制过程中需要使用的化学仪器有_______(填字母)。
A.烧杯 B.500mL容量瓶 C.胶头滴管 D.漏斗 E.玻璃棒
(2)用托盘天平称取NaOH,其质量为_______g。
(3)下列主要操作步骤的正确顺序是_______(填序号)。
①称取一定质量的NaOH,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶瓶颈刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切;
③待冷却至室温后,将溶液转移到500mL容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)如果实验过程中缺少步骤⑤,会使配制出的NaOH溶液浓度_______(填“偏高、偏低”或“不变”)。
II.实验室某浓盐酸试剂瓶标签如图所示,试根据标签上的有关数据回答下列问题:
(5)该浓盐酸中HCl的物质的量浓度为_______mol/L。
(6)取用该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_______。
A. 溶液中HCl的物质的量 B. 溶液的浓度
C. 溶液的密度 D. 溶液中Cl-的数目
(7)某学生欲用上述浓盐酸和蒸馏水配制250mL0.40mol/L的稀盐酸。该学生需要量取_______mL上述浓盐酸进行配制。
19.过氧化钙微溶于水,可作医用防腐剂、消毒剂,如图是制备的一种方法。
回答下列问题:
步骤Ⅰ中反应的离子方程式是 ______ 。
步骤Ⅱ中反应的化学方程式是: ______ 反应在冰水浴中进行,是为了防止挥发、 ______ 。答条即可
待结晶析出后通过 ______ 填操作分离。
与水缓慢反应,常用作鱼塘的供氧剂,其反应的化学方程式是 ______ 。还可用于长途运输鱼苗,这体现了的 ______ 填字母性质。
可缓慢供氧
能吸收鱼苗呼出的
能潮解
可抑菌
久置于空气中会生成为测定某样品的纯度,取样品加入足量稀盐酸,测得生成的质量为,则样品中的质量分数为 ______ 。
BBDDD ABDCC CBDBD
16【答案】(1)+1 (2) ①. 500mL容量瓶 ②. 胶头滴管
(3)b
【解析】
【小问1详解】
NaClO中Na为+1价,O为-2价, Cl元素的化合价为+1;
【小问2详解】
配制溶液还需要500mL容量瓶、胶头滴管;
【小问3详解】
a.转移前,容量瓶中含有少量蒸馏水,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度无影响,故a错误;
b.转移时,有少量溶液溅出,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故b正确;
c.定容时,俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故c错误;
故答案选b。
17【答案】(1) ①. Si ②.
(2) (3) ①. HClO4 ②. Al(OH)3
(4) (5)MnO2+4HCl(浓) MnCl2+Cl2↑ +2H2O
【解析】
【分析】根据元素周期表的结构可知,①为N;②为F;③为Na;④为Mg;⑤为Al;⑥为Si;⑦为S;⑧为Cl;⑨为Ar。
【小问1详解】
⑥为Si;⑨为Ar,原子结构示意图为:;
【小问2详解】
③为Na,在空气中燃烧生成过氧化钠,电子式为:;
【小问3详解】
这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4;两性氢氧化物为:Al(OH)3;
【小问4详解】
④的氯化物为MgCl2,电子式表示形成过程为:;
【小问5详解】
实验室制取氯气的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑ +2H2O。
18【答案】(1)ABCE
(2)2.0 (3)①③⑤②④
(4)偏低 (5)11.9 (6)BC
(7)8.4
【解析】
【小问1详解】
溶液配制过程中需要烧杯溶解固体,需要500mL容量瓶和胶头滴管定容,且需要玻璃棒搅拌和引流,不需要漏斗,故选ABCE;
【小问2详解】
需要NaOH的质量m=cVM=0.1mol/L×0.5L×40g/mol=2.0g;
【小问3详解】
实验操作的步骤:计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作进行排序,所以其排列顺序为①③⑤②④;
【小问4详解】
步骤⑤是洗涤烧杯和玻璃棒,如果缺少,则容量瓶中NaOH的质量减少,导致配制出的NaOH溶液浓度偏低;
【小问5详解】
浓盐酸中HCl的物质的量浓度:c=mol/L=11.9mol/L;
【小问6详解】
根据n=cV、N=cVNA知,溶质的物质的量、溶液中微粒数与体积有关,溶液是均一稳定的,溶液物质的量浓度、密度与溶液体积无关,故选BC;
【小问7详解】
浓盐酸稀释时HCl的物质的量不变,则配制500mL物质的量浓度为0.400mol L-1的稀盐酸,设需要浓盐酸体积为V,依据溶液稀释过程中溶质的物质的量不变:V×11.9mol/L=0.4mol/L×0.25L,解得V=8.4mL,所以需要用量筒量取8.4mL的浓盐酸。
19
防止过氧化氢分解或降低温度以降低产物的溶解度而析出
过滤
第20页,共21页
化学试卷
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Si-28 S-32 Cl-35.5 Fe-56 Cu-64
一、选择题(共15题,每题只有一个选项符合题意,每题3分,共45分)
1. 合金的应用极大地促进了人类社会的发展。下列不属于合金的是
A B C D
狗头兽首铜像 精美的青花瓷 流通硬币 地铁列车的车体
A. A B. B C. C D. D
2. 溶液、胶体和浊液这三种分散系根本区别是
A. 是否透明 B. 分散质粒子的大小
C. 能否透过滤纸 D. 是否具有丁达尔效应
3下列仪器中,配制一定物质的量浓度的溶液时不需要的是( )
A. 烧杯 B. 容量瓶
C. 胶头滴管 D. 分液漏斗
4.分类法在化学发展中起到非常重要的作用,下列分类标准合理的是( )
A. 根据化合物在水溶液中能否导电,将化合物分为电解质和非电解质
B. 根据分散系是否具有丁达尔效应,将分散系分为溶液、胶体和浊液
C. 根据化学式中所含氢原子的个数,将酸分为一元酸、二元酸和多元酸
D. 根据反应中是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应
5.下列说法不正确的是( )
A. “抗坏血酸”维生素具有还原性
B. 杨万里戏笔中写道“野菊荒苔各铸钱,金黄铜绿两争妍”,铜绿的主要成分为碱式碳酸铜,属于碱式盐
C. 向碳酸钠溶液中滴加稀盐酸,先不冒气泡,后冒气泡
D. 食物腐败、胶体的制备、植物光合作用都与氧化还原反应有关
6.下列无色溶液在强酸性条件下能大量共存的是( )
A. 、、、 B. 、、、
C. 、、、 D. 、、、
7.下列物质长期露置于空气中会变质,但不涉及氧化还原反应的是( )
A. B. C. D. 氯水
8. 铁粉具有平肝镇心,消痈解毒之功效,主治惊痛、癫狂、脚气冲心、贫血等。某兴趣小组探究利用反应:H2+FeCO3Fe+CO2↑+H2O↑制取铁粉并检验气体产物实验装置如图。下列说法不正确的是
A. 通过调节分液漏斗的活塞可以控制①中气泡产生快慢
B. 装置①中的试剂是浓硫酸,目的是干燥氢气
C. 装置②中的试剂是无水硫酸铜,目的是检验水蒸气
D. 为防止④中挥发的气体进入②中干扰检验,③中应盛放碱石灰
9. 实验室制备Cl2的反应为MnO2+4HCl(浓)Mn2++Cl2↑+2H2O。下列说法错误的是( )
A. 该反应中HCl作还原剂,MnO2作氧化剂
B. 每生成1molCl2,转移2mol电子
C. 每消耗1molMnO2,有4molHCl被氧化
D. 利用该反应制备的Cl2粗产品中,除含有水蒸气外,还含有HCl气体
10. 下列化合物能通过相应单质直接化合而成的是
A. FeCl2 B. NO2 C. Na2O2 D. SO3
11. NA表示阿伏加德罗常数。下列叙述中正确的是
A. 标准状况下,22.4 L水中含有的水分子数为NA
B. 4.0 g NaOH固体溶于100 mL水中,得到1 mol·L 1的NaOH溶液
C. 常温、常压下,22 g CO2中含有的氧原子数为NA
D. 1 L 0.5 mol·L 1 Na2SO4溶液中,含有的氧原子总数为2NA
12. 下列有关物质分类的叙述正确的是
A. CaCl2、NaOH、HCl、O2四种物质都属于化合物
B. 溶液、浊液、胶体都属于混合物
C. 硫酸、纯碱、硝酸钠和生石灰分别属于酸、碱、盐和碱性氧化物
D. CO2、CO等非金属氧化物均属于酸性氧化物
13. NA表示阿佛加德罗常数,下列说法正确的是
A. 36gH2O的物质的量为1mol
B. 常温常压下,1molCl2的体积是22.4L
C. 0.5mol·L-1NaCl溶液中含有0.5molNa+
D. 1molCO2中含有的分子数为NA
14. 化学科学需要借助化学专用语言描述,下列化学用语表达正确的是
A. CO2的电子式 B. Cl﹣的结构示意图为
C. 氮气的结构式为N-N D. 质量数为37的氯原子为Cl
15. 某化学兴趣小组在实验室进行化学实验,按照甲图连接好线路发现灯泡不亮,按照乙图连接好线路发现灯泡亮,由此得出的结论正确的是
A. NaCl溶液是电解质
B. NaCl固体不导电,不是电解质
C. 在NaCl溶液中,水分子本身可以电离出大量的离子
D. NaCl在水溶液中电离出了可以自由移动的离子
二、非选择题(共4题,共55分)
16. 氯及其化合物等在生活、生产中有着重要作用。
(1)84消毒液的有效成分为,可用作消毒剂、漂白剂。中元素的化合价为_______;
(2)向84消毒液中加入少量稀硫酸可增强其漂白能力,某消毒小组人员用的浓硫酸配制的稀硫酸。所需要的玻璃仪器有量筒、烧杯、玻璃棒和_______、_______。
(3)下列操作导致所配溶液浓度偏低有_______(填字母)。
a转移前,容量瓶未干燥 b.转移时,有少量液体溅出 c.定容时,俯视容量瓶刻度线
17. 如表是元素周期表的一部分,回答下列有关问题:
周期 族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
二 ① ②
三 ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨
(1)写出⑥的元素符号:_______,画出⑨的原子结构示意图_______。
(2)写出③的单质在空气中燃烧后产物的电子式:_______。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的是_______,呈两性氢氧化物的是_______。(填化学式)
(4)用电子式表示出④的氯化物的形成过程:_______。
(5)写出实验室制取⑧的单质的化学方程式:_______。
18. 日常生活及化学实验中,许多反应都发生在溶液之间,溶液的浓度大小对于某一化学反应能否发生、反应产物以及反应快慢等因素有着十分重要的影响。准确配制一定物质的量浓度的溶液,对于化学学习至关重要。
I.实验室要配制500mL0.1mol/LNaOH溶液,请回答下列问题:
(1)配制过程中需要使用的化学仪器有_______(填字母)。
A.烧杯 B.500mL容量瓶 C.胶头滴管 D.漏斗 E.玻璃棒
(2)用托盘天平称取NaOH,其质量为_______g。
(3)下列主要操作步骤的正确顺序是_______(填序号)。
①称取一定质量的NaOH,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶瓶颈刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切;
③待冷却至室温后,将溶液转移到500mL容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)如果实验过程中缺少步骤⑤,会使配制出的NaOH溶液浓度_______(填“偏高、偏低”或“不变”)。
II.实验室某浓盐酸试剂瓶标签如图所示,试根据标签上的有关数据回答下列问题:
(5)该浓盐酸中HCl的物质的量浓度为_______mol/L。
(6)取用该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_______。
A. 溶液中HCl的物质的量 B. 溶液的浓度
C. 溶液的密度 D. 溶液中Cl-的数目
(7)某学生欲用上述浓盐酸和蒸馏水配制250mL0.40mol/L的稀盐酸。该学生需要量取_______mL上述浓盐酸进行配制。
19.过氧化钙微溶于水,可作医用防腐剂、消毒剂,如图是制备的一种方法。
回答下列问题:
步骤Ⅰ中反应的离子方程式是 ______ 。
步骤Ⅱ中反应的化学方程式是: ______ 反应在冰水浴中进行,是为了防止挥发、 ______ 。答条即可
待结晶析出后通过 ______ 填操作分离。
与水缓慢反应,常用作鱼塘的供氧剂,其反应的化学方程式是 ______ 。还可用于长途运输鱼苗,这体现了的 ______ 填字母性质。
可缓慢供氧
能吸收鱼苗呼出的
能潮解
可抑菌
久置于空气中会生成为测定某样品的纯度,取样品加入足量稀盐酸,测得生成的质量为,则样品中的质量分数为 ______ 。
BBDDD ABDCC CBDBD
16【答案】(1)+1 (2) ①. 500mL容量瓶 ②. 胶头滴管
(3)b
【解析】
【小问1详解】
NaClO中Na为+1价,O为-2价, Cl元素的化合价为+1;
【小问2详解】
配制溶液还需要500mL容量瓶、胶头滴管;
【小问3详解】
a.转移前,容量瓶中含有少量蒸馏水,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度无影响,故a错误;
b.转移时,有少量溶液溅出,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故b正确;
c.定容时,俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故c错误;
故答案选b。
17【答案】(1) ①. Si ②.
(2) (3) ①. HClO4 ②. Al(OH)3
(4) (5)MnO2+4HCl(浓) MnCl2+Cl2↑ +2H2O
【解析】
【分析】根据元素周期表的结构可知,①为N;②为F;③为Na;④为Mg;⑤为Al;⑥为Si;⑦为S;⑧为Cl;⑨为Ar。
【小问1详解】
⑥为Si;⑨为Ar,原子结构示意图为:;
【小问2详解】
③为Na,在空气中燃烧生成过氧化钠,电子式为:;
【小问3详解】
这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4;两性氢氧化物为:Al(OH)3;
【小问4详解】
④的氯化物为MgCl2,电子式表示形成过程为:;
【小问5详解】
实验室制取氯气的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑ +2H2O。
18【答案】(1)ABCE
(2)2.0 (3)①③⑤②④
(4)偏低 (5)11.9 (6)BC
(7)8.4
【解析】
【小问1详解】
溶液配制过程中需要烧杯溶解固体,需要500mL容量瓶和胶头滴管定容,且需要玻璃棒搅拌和引流,不需要漏斗,故选ABCE;
【小问2详解】
需要NaOH的质量m=cVM=0.1mol/L×0.5L×40g/mol=2.0g;
【小问3详解】
实验操作的步骤:计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作进行排序,所以其排列顺序为①③⑤②④;
【小问4详解】
步骤⑤是洗涤烧杯和玻璃棒,如果缺少,则容量瓶中NaOH的质量减少,导致配制出的NaOH溶液浓度偏低;
【小问5详解】
浓盐酸中HCl的物质的量浓度:c=mol/L=11.9mol/L;
【小问6详解】
根据n=cV、N=cVNA知,溶质的物质的量、溶液中微粒数与体积有关,溶液是均一稳定的,溶液物质的量浓度、密度与溶液体积无关,故选BC;
【小问7详解】
浓盐酸稀释时HCl的物质的量不变,则配制500mL物质的量浓度为0.400mol L-1的稀盐酸,设需要浓盐酸体积为V,依据溶液稀释过程中溶质的物质的量不变:V×11.9mol/L=0.4mol/L×0.25L,解得V=8.4mL,所以需要用量筒量取8.4mL的浓盐酸。
19
防止过氧化氢分解或降低温度以降低产物的溶解度而析出
过滤
第20页,共21页
同课章节目录
