2022-2023学年人教版九年级化学下册 第八单元 课题2 金属的化学性质 课时作业(word版 有答案)
文档属性
| 名称 | 2022-2023学年人教版九年级化学下册 第八单元 课题2 金属的化学性质 课时作业(word版 有答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 267.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-07 21:40:16 | ||
图片预览

文档简介
课题2 金属的化学性质
第2课时 金属活动性顺序及其应用
补全金属活动性顺序:
基础强化
1.(2021营口中考)下列金属不能与CuCl2溶液反应的是( )
A.Zn B.Ag C.Fe D.Al
2.下列各组物质恰好完全反应,所得溶液呈无色的是( )
A.锌和稀硫酸 B.铁和稀硫酸
C.铁和硫酸铜溶液 D.铜和硝酸汞溶液
3.(2021福建中考)据文献报道:一种特殊的铜纳米颗粒具有与金、银极其相似的反应惰性,可替代黄金作精密电子元器件。下列对该铜纳米颗粒的判断正确的是( )
A.能与盐酸反应产生氢气 B.在空气中容易锈蚀
C.能与硫酸亚铁发生置换反应 D.具有良好的导电性
4.(2021扬州二模)将一根洁净的铜丝放入硝酸银溶液中,过一会儿取出,溶液从无色变为蓝色,铜丝表面生长出如图所示的白色“树枝”,下列叙述错误的是( )
A.白色“树枝”的成分是银
B.该反应为置换反应
C.所得溶液中肯定不含Ag+
D.溶液变为蓝色,表明Cu转变为Cu2+
5.为了获取“铁的金属活动性比铜强”的证据,可以采用的方法是( )
A.比较铁的利用范围是否比铜广
B.观察铁是否能置换出硫酸铜溶液中的铜
C.观察铁表面的锈迹是否比铜多
D.比较铁的相对原子质量是否比铜小
6.青铜的主要成分为Cu、Sn,为验证二者的金属活动性强弱,下列不能选用的是( )
A.FeSO4溶液 B.稀盐酸 C.CuSO4溶液 D.SnSO4溶液
7.(2021温州中考)通过实验可以比较铁、铜、银三种金属的活动性强弱。下列装置能够达到实验目的的是( )
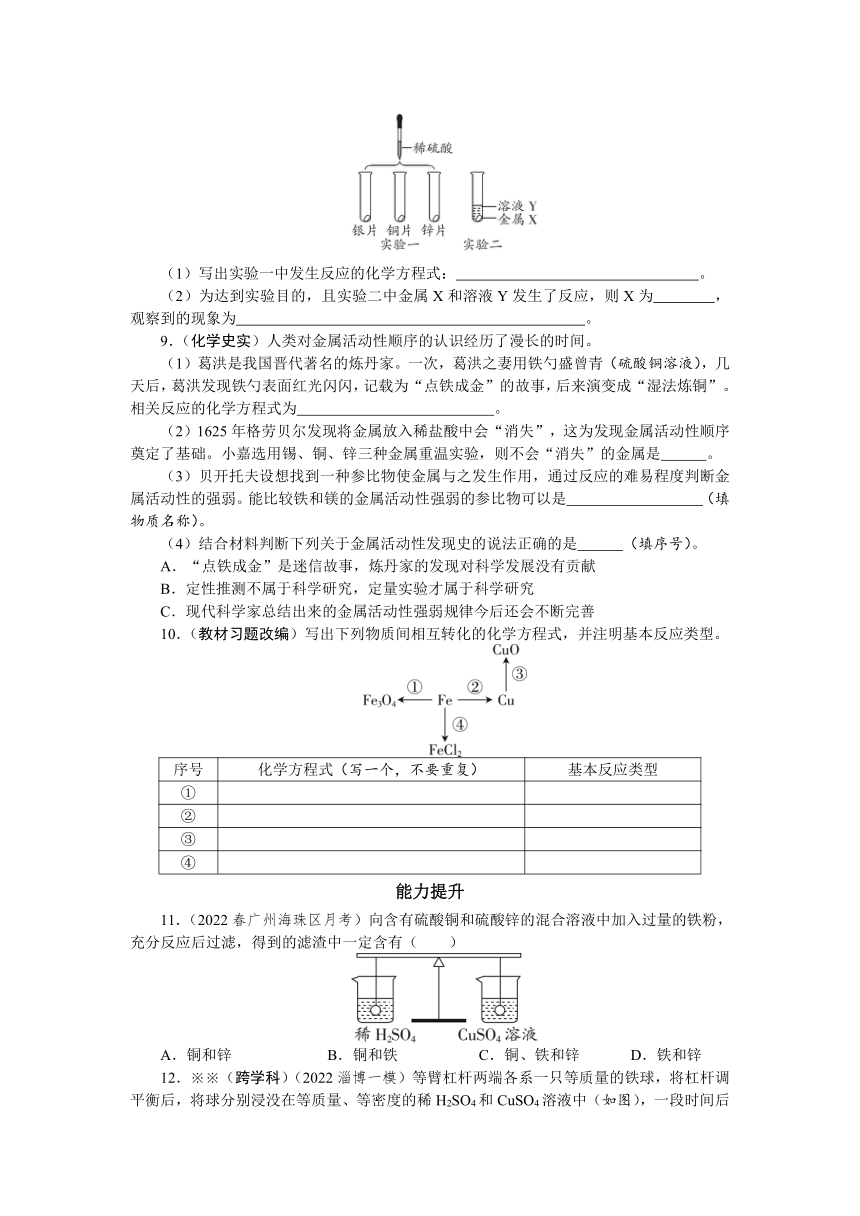
8.(2022长春模拟)为了验证银、铜、锌的金属活动性强弱,同学们设计了如图实验。
(1)写出实验一中发生反应的化学方程式: 。
(2)为达到实验目的,且实验二中金属X和溶液Y发生了反应,则X为 ,观察到的现象为 。
9.(化学史实)人类对金属活动性顺序的认识经历了漫长的时间。
(1)葛洪是我国晋代著名的炼丹家。一次,葛洪之妻用铁勺盛曾青(硫酸铜溶液),几天后,葛洪发现铁勺表面红光闪闪,记载为“点铁成金”的故事,后来演变成“湿法炼铜”。相关反应的化学方程式为 。
(2)1625年格劳贝尔发现将金属放入稀盐酸中会“消失”,这为发现金属活动性顺序奠定了基础。小嘉选用锡、铜、锌三种金属重温实验,则不会“消失”的金属是 。
(3)贝开托夫设想找到一种参比物使金属与之发生作用,通过反应的难易程度判断金属活动性的强弱。能比较铁和镁的金属活动性强弱的参比物可以是 (填物质名称)。
(4)结合材料判断下列关于金属活动性发现史的说法正确的是 (填序号)。
A.“点铁成金”是迷信故事,炼丹家的发现对科学发展没有贡献
B.定性推测不属于科学研究,定量实验才属于科学研究
C.现代科学家总结出来的金属活动性强弱规律今后还会不断完善
10.(教材习题改编)写出下列物质间相互转化的化学方程式,并注明基本反应类型。
序号 化学方程式(写一个,不要重复) 基本反应类型
①
②
③
④
能力提升
11.(2022春广州海珠区月考)向含有硫酸铜和硫酸锌的混合溶液中加入过量的铁粉,充分反应后过滤,得到的滤渣中一定含有( )
A.铜和锌 B.铜和铁 C.铜、铁和锌 D.铁和锌
12.※※(跨学科)(2022淄博一模)等臂杠杆两端各系一只等质量的铁球,将杠杆调平衡后,将球分别浸没在等质量、等密度的稀H2SO4和CuSO4溶液中(如图),一段时间后杠杆将会( )
A.左端上翘 B.右端上翘 C.仍然平衡 D.无法判断
13.(2020毕节中考)向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入足量的锌粉,先后发生反应Ⅰ、Ⅱ,下列对反应前后溶液质量变化的分析正确的是( )
A.Ⅰ减小、Ⅱ减小 B.Ⅰ减小、Ⅱ增大
C.Ⅰ增大、Ⅱ增大 D.Ⅰ增大、Ⅱ减小
14.※※(2021佛山一模改编)等质量的Mg、Fe、Zn三种金属,分别与足量的等质量、等浓度的稀H2SO4反应,生成氢气质量与消耗稀H2SO4质量的关系如图,下列结论错误的是( )
A.消耗稀H2SO4质量:Mg>Fe>Zn
B.金属相对原子质量:Mg<Fe<Zn
C.金属活动性顺序:Mg>Fe>Zn
D.反应后溶液质量:Mg<Fe<Zn
15.(2021秋南通期末)下列有关金属的实验操作不能达到实验目的的是( )
选项 实验目的 主要实验操作
A 检验Zn粉中是否有Fe粉 取样,加入足量的稀盐酸,观察溶液颜色
B 比较镁和铁的活动性 将镁片、铁片分别在空气中灼烧
C 除去Fe粉中的Zn粉 加入足量的硫酸亚铁溶液,过滤、洗涤、干燥
D 区分铜粉和银粉 取样,加入足量的稀盐酸,观察现象
16.某化工厂的废液中主要含有硝酸银、硝酸亚铁。取一定量的该废液样品,加入锌粉,充分反应后过滤,得到滤液和滤渣。请回答下列问题:
(1)上述过程中一定发生反应的化学方程式为____________________________。
(2)若滤渣中含有锌,则滤渣中除锌外,还含有 (填化学式,下同)。
(3)若滤渣中含有铁,则滤液中一定含有 ,可能含有__________________。
(4)若滤渣中不含铁,则滤液中一定含有 ,可能含有_________________。
17.(2021秋淮安期末节选)为除去固体混合物中的Fe粉,获得纯净的Cu粉,某同学设计了如图两个实验方案:
(1)方案Ⅰ中,由于________________________________________________,
可能导致Fe粉除不尽。
(2)写出方案Ⅱ中涉及反应的化学方程式: 。
18.(2021福建模拟)某校同学开展金属化学性质的实验探究活动。
(1)某同学设计两种不同的实验方案,验证铁和铜的金属活动性:
实验方案 实验现象 实验结论
①分别取等量的铁片和铜片于两支试管中,加入等量的稀硫酸 铁比铜活动性强
②取打磨过的铁片放入适量的 中
(2)同学们做镁和稀硫酸反应的实验时,观察到反应很剧烈,试管内产生“白雾”。
①反应过程中,“白雾”产生的原因是镁和稀硫酸反应 ,使试管内的水汽化成水蒸气,水蒸气 。写出镁和稀硫酸反应的化学方程式: 。
②将燃着的木条放在试管口,可听到尖锐的爆鸣声,说明试管内的气体 。
参考答案
补全金属活动性顺序:钾 钙 钠 镁 铝 锌 铁 铜 汞 银
1.B 2.A 3.D 4.C 5.B 6.A 7.D
8.(1)Zn+H2SO4=== ZnSO4+H2↑
(2)铜 铜片表面有银白色固体析出,溶液由无色变为蓝色
9.(1)Fe+CuSO4=== FeSO4+Cu (2)铜
(3)氯化亚铁溶液(合理即可) (4)C
10.①3Fe+2O2 Fe3O4 化合反应
②Fe+CuSO4=== FeSO4+Cu[或Fe+Cu(NO3)2=== Fe(NO3)2+Cu等] 置换反应
③2Cu+O2 2CuO 化合反应
④Fe+2HCl=== FeCl2+H2↑(或Fe+CuCl2=== FeCl2+Cu) 置换反应
11.B
12.A 【解析】铁与稀硫酸反应生成氢气和硫酸亚铁,参加反应的铁溶解进溶液,使左边金属的质量减小;铁与硫酸铜反应生成硫酸亚铁和铜,生成的铜覆盖在铁的表面,且每56份的铁参加反应,生成64份质量的铜,使右边金属的质量增大。左边质量减小,右边质量增大,故杠杆左端上翘。故选A。
13.B
14.C 【解析】A.据图可知,三种金属消耗稀H2SO4质量:Mg>Fe>Zn,正确;B.三种金属的相对原子质量:Mg<Fe<Zn,正确;C.三种金属活动性顺序:Mg>Zn>Fe,错误;D.反应生成氢气越多,最终形成溶液质量越小,因此三种金属与稀H2SO4反应后溶液质量:Mg<Fe<Zn,正确。故选C。
15.D
16.(1)Zn+2AgNO3=== Zn(NO3)2+2Ag
(2)Ag、Fe (3)Zn(NO3)2 Fe(NO3)2
(4)Zn(NO3)2、Fe(NO3)2 AgNO3
17.(1)Fe置换出的Cu会附着在铁的表面,阻止反应进一步发生(合理即可)
(2)Fe+H2SO4=== FeSO4+H2↑
18.(1)铁与稀硫酸反应有气泡产生,而铜没有明显现象 硫酸铜溶液(合理即可)
铁片表面有红色固体析出
(2)①放热 遇冷后冷凝成小水珠 Mg+H2SO4=== MgSO4+H2↑ ②不纯
第2课时 金属活动性顺序及其应用
补全金属活动性顺序:
基础强化
1.(2021营口中考)下列金属不能与CuCl2溶液反应的是( )
A.Zn B.Ag C.Fe D.Al
2.下列各组物质恰好完全反应,所得溶液呈无色的是( )
A.锌和稀硫酸 B.铁和稀硫酸
C.铁和硫酸铜溶液 D.铜和硝酸汞溶液
3.(2021福建中考)据文献报道:一种特殊的铜纳米颗粒具有与金、银极其相似的反应惰性,可替代黄金作精密电子元器件。下列对该铜纳米颗粒的判断正确的是( )
A.能与盐酸反应产生氢气 B.在空气中容易锈蚀
C.能与硫酸亚铁发生置换反应 D.具有良好的导电性
4.(2021扬州二模)将一根洁净的铜丝放入硝酸银溶液中,过一会儿取出,溶液从无色变为蓝色,铜丝表面生长出如图所示的白色“树枝”,下列叙述错误的是( )
A.白色“树枝”的成分是银
B.该反应为置换反应
C.所得溶液中肯定不含Ag+
D.溶液变为蓝色,表明Cu转变为Cu2+
5.为了获取“铁的金属活动性比铜强”的证据,可以采用的方法是( )
A.比较铁的利用范围是否比铜广
B.观察铁是否能置换出硫酸铜溶液中的铜
C.观察铁表面的锈迹是否比铜多
D.比较铁的相对原子质量是否比铜小
6.青铜的主要成分为Cu、Sn,为验证二者的金属活动性强弱,下列不能选用的是( )
A.FeSO4溶液 B.稀盐酸 C.CuSO4溶液 D.SnSO4溶液
7.(2021温州中考)通过实验可以比较铁、铜、银三种金属的活动性强弱。下列装置能够达到实验目的的是( )
8.(2022长春模拟)为了验证银、铜、锌的金属活动性强弱,同学们设计了如图实验。
(1)写出实验一中发生反应的化学方程式: 。
(2)为达到实验目的,且实验二中金属X和溶液Y发生了反应,则X为 ,观察到的现象为 。
9.(化学史实)人类对金属活动性顺序的认识经历了漫长的时间。
(1)葛洪是我国晋代著名的炼丹家。一次,葛洪之妻用铁勺盛曾青(硫酸铜溶液),几天后,葛洪发现铁勺表面红光闪闪,记载为“点铁成金”的故事,后来演变成“湿法炼铜”。相关反应的化学方程式为 。
(2)1625年格劳贝尔发现将金属放入稀盐酸中会“消失”,这为发现金属活动性顺序奠定了基础。小嘉选用锡、铜、锌三种金属重温实验,则不会“消失”的金属是 。
(3)贝开托夫设想找到一种参比物使金属与之发生作用,通过反应的难易程度判断金属活动性的强弱。能比较铁和镁的金属活动性强弱的参比物可以是 (填物质名称)。
(4)结合材料判断下列关于金属活动性发现史的说法正确的是 (填序号)。
A.“点铁成金”是迷信故事,炼丹家的发现对科学发展没有贡献
B.定性推测不属于科学研究,定量实验才属于科学研究
C.现代科学家总结出来的金属活动性强弱规律今后还会不断完善
10.(教材习题改编)写出下列物质间相互转化的化学方程式,并注明基本反应类型。
序号 化学方程式(写一个,不要重复) 基本反应类型
①
②
③
④
能力提升
11.(2022春广州海珠区月考)向含有硫酸铜和硫酸锌的混合溶液中加入过量的铁粉,充分反应后过滤,得到的滤渣中一定含有( )
A.铜和锌 B.铜和铁 C.铜、铁和锌 D.铁和锌
12.※※(跨学科)(2022淄博一模)等臂杠杆两端各系一只等质量的铁球,将杠杆调平衡后,将球分别浸没在等质量、等密度的稀H2SO4和CuSO4溶液中(如图),一段时间后杠杆将会( )
A.左端上翘 B.右端上翘 C.仍然平衡 D.无法判断
13.(2020毕节中考)向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入足量的锌粉,先后发生反应Ⅰ、Ⅱ,下列对反应前后溶液质量变化的分析正确的是( )
A.Ⅰ减小、Ⅱ减小 B.Ⅰ减小、Ⅱ增大
C.Ⅰ增大、Ⅱ增大 D.Ⅰ增大、Ⅱ减小
14.※※(2021佛山一模改编)等质量的Mg、Fe、Zn三种金属,分别与足量的等质量、等浓度的稀H2SO4反应,生成氢气质量与消耗稀H2SO4质量的关系如图,下列结论错误的是( )
A.消耗稀H2SO4质量:Mg>Fe>Zn
B.金属相对原子质量:Mg<Fe<Zn
C.金属活动性顺序:Mg>Fe>Zn
D.反应后溶液质量:Mg<Fe<Zn
15.(2021秋南通期末)下列有关金属的实验操作不能达到实验目的的是( )
选项 实验目的 主要实验操作
A 检验Zn粉中是否有Fe粉 取样,加入足量的稀盐酸,观察溶液颜色
B 比较镁和铁的活动性 将镁片、铁片分别在空气中灼烧
C 除去Fe粉中的Zn粉 加入足量的硫酸亚铁溶液,过滤、洗涤、干燥
D 区分铜粉和银粉 取样,加入足量的稀盐酸,观察现象
16.某化工厂的废液中主要含有硝酸银、硝酸亚铁。取一定量的该废液样品,加入锌粉,充分反应后过滤,得到滤液和滤渣。请回答下列问题:
(1)上述过程中一定发生反应的化学方程式为____________________________。
(2)若滤渣中含有锌,则滤渣中除锌外,还含有 (填化学式,下同)。
(3)若滤渣中含有铁,则滤液中一定含有 ,可能含有__________________。
(4)若滤渣中不含铁,则滤液中一定含有 ,可能含有_________________。
17.(2021秋淮安期末节选)为除去固体混合物中的Fe粉,获得纯净的Cu粉,某同学设计了如图两个实验方案:
(1)方案Ⅰ中,由于________________________________________________,
可能导致Fe粉除不尽。
(2)写出方案Ⅱ中涉及反应的化学方程式: 。
18.(2021福建模拟)某校同学开展金属化学性质的实验探究活动。
(1)某同学设计两种不同的实验方案,验证铁和铜的金属活动性:
实验方案 实验现象 实验结论
①分别取等量的铁片和铜片于两支试管中,加入等量的稀硫酸 铁比铜活动性强
②取打磨过的铁片放入适量的 中
(2)同学们做镁和稀硫酸反应的实验时,观察到反应很剧烈,试管内产生“白雾”。
①反应过程中,“白雾”产生的原因是镁和稀硫酸反应 ,使试管内的水汽化成水蒸气,水蒸气 。写出镁和稀硫酸反应的化学方程式: 。
②将燃着的木条放在试管口,可听到尖锐的爆鸣声,说明试管内的气体 。
参考答案
补全金属活动性顺序:钾 钙 钠 镁 铝 锌 铁 铜 汞 银
1.B 2.A 3.D 4.C 5.B 6.A 7.D
8.(1)Zn+H2SO4=== ZnSO4+H2↑
(2)铜 铜片表面有银白色固体析出,溶液由无色变为蓝色
9.(1)Fe+CuSO4=== FeSO4+Cu (2)铜
(3)氯化亚铁溶液(合理即可) (4)C
10.①3Fe+2O2 Fe3O4 化合反应
②Fe+CuSO4=== FeSO4+Cu[或Fe+Cu(NO3)2=== Fe(NO3)2+Cu等] 置换反应
③2Cu+O2 2CuO 化合反应
④Fe+2HCl=== FeCl2+H2↑(或Fe+CuCl2=== FeCl2+Cu) 置换反应
11.B
12.A 【解析】铁与稀硫酸反应生成氢气和硫酸亚铁,参加反应的铁溶解进溶液,使左边金属的质量减小;铁与硫酸铜反应生成硫酸亚铁和铜,生成的铜覆盖在铁的表面,且每56份的铁参加反应,生成64份质量的铜,使右边金属的质量增大。左边质量减小,右边质量增大,故杠杆左端上翘。故选A。
13.B
14.C 【解析】A.据图可知,三种金属消耗稀H2SO4质量:Mg>Fe>Zn,正确;B.三种金属的相对原子质量:Mg<Fe<Zn,正确;C.三种金属活动性顺序:Mg>Zn>Fe,错误;D.反应生成氢气越多,最终形成溶液质量越小,因此三种金属与稀H2SO4反应后溶液质量:Mg<Fe<Zn,正确。故选C。
15.D
16.(1)Zn+2AgNO3=== Zn(NO3)2+2Ag
(2)Ag、Fe (3)Zn(NO3)2 Fe(NO3)2
(4)Zn(NO3)2、Fe(NO3)2 AgNO3
17.(1)Fe置换出的Cu会附着在铁的表面,阻止反应进一步发生(合理即可)
(2)Fe+H2SO4=== FeSO4+H2↑
18.(1)铁与稀硫酸反应有气泡产生,而铜没有明显现象 硫酸铜溶液(合理即可)
铁片表面有红色固体析出
(2)①放热 遇冷后冷凝成小水珠 Mg+H2SO4=== MgSO4+H2↑ ②不纯
同课章节目录
