2022-2023学年人教版九年级化学下册 第九单元 课题3 溶液的浓度 课时作业(word版有答案)
文档属性
| 名称 | 2022-2023学年人教版九年级化学下册 第九单元 课题3 溶液的浓度 课时作业(word版有答案) |  | |
| 格式 | zip | ||
| 文件大小 | 356.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-07 21:51:00 | ||
图片预览



文档简介
课题3 溶液的浓度
第1课时 溶质的质量分数(1)
1.某温度下,将20 g硝酸钾溶液蒸干,得到4 g固体。该硝酸钾溶液的溶质质量分数为( )
A.25% B.20% C.16.7% D.4%
2.0.9%的生理盐水广泛用于医疗中,若要配制500 g生理盐水,需要水的质量为( )
A.4.5 g B.45 g C.455 g D.495.5 g
3.现有20 ℃时一定质量的氯化钠饱和溶液,向其中加入少量的硝酸钾固体,充分溶解,所得溶液中氯化钠的质量分数( )
A.增大 B.减小 C.不变 D.无法确定
4.下列有关溶液的说法中,正确的是( )
A.一定温度下,某物质的饱和溶液中溶质的质量分数是定值
B.同一物质的饱和溶液一定比其不饱和溶液中溶质的质量分数大
C.饱和溶液析出晶体后,溶液中溶质的质量分数一定减小
D.不饱和溶液转化为饱和溶液,溶液中溶质的质量分数一定增大
5.用硫酸铜进行如图所示的实验,下列分析正确的是( )
A.三种溶液中溶质的溶解度相等
B.②中溶液是不饱和溶液
C.③中溶液颜色最深
D.温度不同,无法比较①③中溶液的溶质质量分数
6.(2021佛山一模节选)如图是a、b、c三种固体物质的溶解度曲线。
(1)P点表示 。
(2)t2 ℃时,向50 g水中加入50 g a,所得溶液中溶质的质量分数为 (结果精确到0.1%)。
(3)将t1 ℃时三种物质的饱和溶液分别升温至t2 ℃,所得溶液中溶质的质量分数由大到小的顺序为 。
7.(2020柳州中考节选)新冠疫情期间,可用体积分数为75%的乙醇(C2H5OH)消毒液进行消毒。如图为某品牌乙醇消毒液的标签。(纯乙醇的密度约为0.8 g/mL,水的密度约为1 g/mL)
(1)配制该乙醇消毒液需要乙醇和水的体积比为 。
(2)该乙醇消毒液中乙醇的质量分数为多少?(写出计算过程,结果精确到0.1%)
第2课时 溶质的质量分数(2)
1.(2021深圳模拟)将80 g质量分数为36%的浓盐酸稀释成6%的稀盐酸,需加水的质量为( )
A.480 g B.400 g C.320 g D.80 g
2.向100 g 10%的氢氧化钠溶液中加入12.5 g氢氧化钠固体,完全溶解后所得溶液中溶质的质量分数为( )
A.12.5% B.25% C.20% D.22.5%
3.(2022春淮南月考)要使20 g 20%的食盐水的质量分数变为原来的一半,可采取的方法是( )
A.加入20 g 水 B.加入10 g 水
C.加入10 g 食盐 D.蒸发掉10 g 水
4.某温度下,向200 g溶质质量分数为20%的KNO3不饱和溶液甲中加入20 g KNO3固体,完全溶解后恰好得到饱和溶液乙,下列说法正确的是( )
A.该温度下,KNO3的溶解度为30 g
B.溶液乙的溶质质量分数为30%
C.升高温度,甲、乙两溶液的溶质质量分数都增大
D.降低温度,可以使溶液甲变为饱和溶液
5.(2021苏州中考)NaCl和KNO3的溶解度曲线如图所示,下列说法正确的是( )
A.KNO3的溶解度一定大于NaCl
B.NaCl的溶解度受温度影响的程度比KNO3大
C.40 ℃时,KNO3饱和溶液的溶质质量分数为63.9%
D.将60 ℃时的210 g KNO3饱和溶液稀释到20%需加水340 g
6.医疗上通常用过氧化氢溶液或酒精溶液来杀菌消毒,但不同质量分数的溶液性质和用途不同,所以需要配制不同质量分数的溶液。
(1)若要配制300 g质量分数为5%的过氧化氢溶液,需要质量分数为30%的过氧化氢溶液的质量为 g。
(2)某种酒精(C2H5OH)的水溶液,溶质和溶剂中氢原子的个数相等,则该溶液中溶质的质量分数为 。
7.(2021秋台州期末)在每年的杨梅季结束后,果农为了给杨梅果园杀菌灭虫需要喷洒农药。农药A低毒高效,其产品信息标签如图。
(1)1 000 mL农药A的质量为 g,其中含溶质 g。
(2)小明爸爸欲配制20 kg质量分数为0.4%的该农药给杨梅果园杀菌灭虫,需要农药A和水的质量分别为多少?(写出计算过程)
第3课时 根据化学方程式进行的溶质质量分数的综合计算
基础强化
1.(2021阜新中考)某工厂利用废铁屑与废硫酸反应制取硫酸亚铁。现取废硫酸4.9 t与足量的废铁屑反应,得到硫酸亚铁1.52 t,计算该废硫酸中溶质的质量分数。
2.(2021湘西中考改编)为测定一瓶失去标签的Na2CO3溶液的浓度,现取50 g 样品于烧杯中,然后逐滴加入CaCl2溶液,反应过程中生成沉淀的质量与加入
CaCl2溶液的质量关系如图。
(提示:Na2CO3+CaCl2=== CaCO3↓+2NaCl)
(1)恰好完全反应时加入CaCl2溶液的质量为 g。
(2)该Na2CO3溶液中溶质的质量分数为多少?
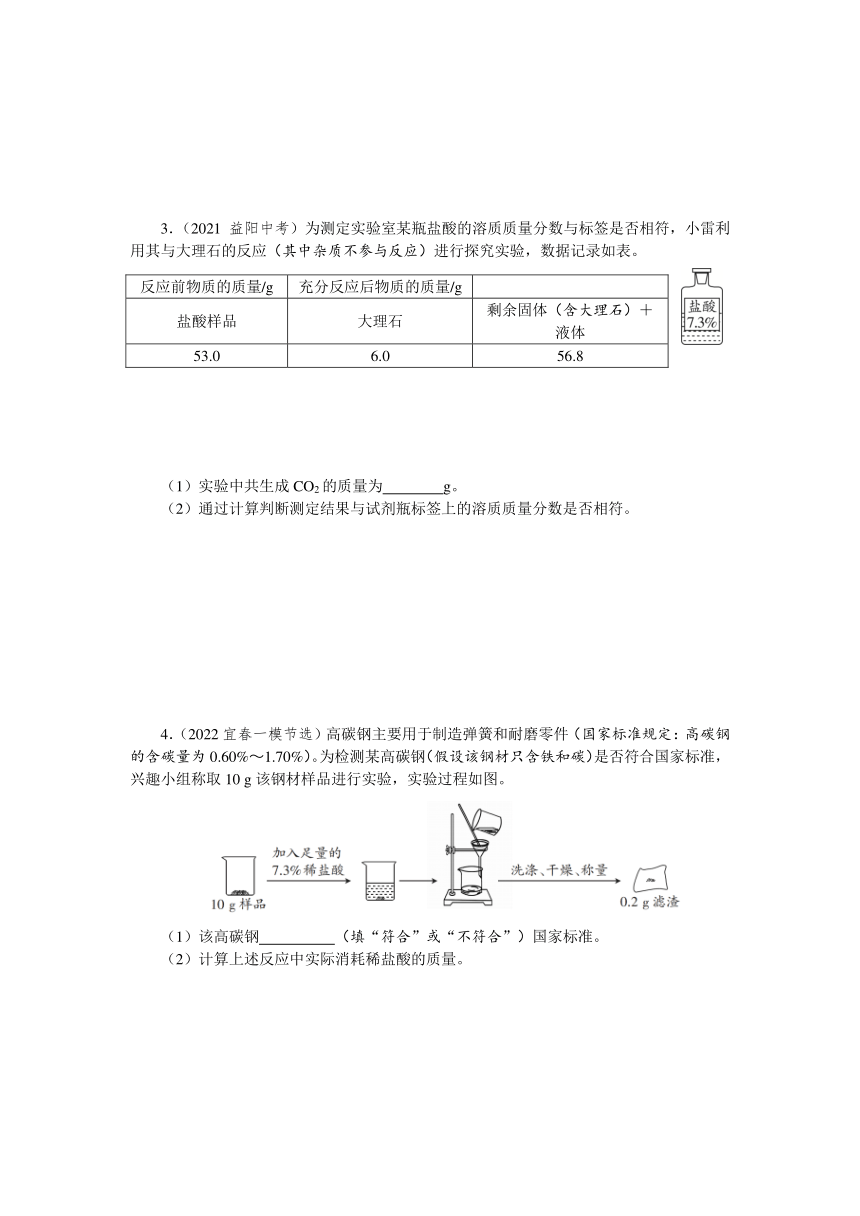
3.(2021益阳中考)为测定实验室某瓶盐酸的溶质质量分数与标签是否相符,小雷利用其与大理石的反应(其中杂质不参与反应)进行探究实验,数据记录如表。
反应前物质的质量/g 充分反应后物质的质量/g
盐酸样品 大理石 剩余固体(含大理石)+液体
53.0 6.0 56.8
(1)实验中共生成CO2的质量为 g。
(2)通过计算判断测定结果与试剂瓶标签上的溶质质量分数是否相符。
4.(2022宜春一模节选)高碳钢主要用于制造弹簧和耐磨零件(国家标准规定:高碳钢的含碳量为0.60%~1.70%)。为检测某高碳钢(假设该钢材只含铁和碳)是否符合国家标准,兴趣小组称取10 g该钢材样品进行实验,实验过程如图。
(1)该高碳钢 (填“符合”或“不符合”)国家标准。
(2)计算上述反应中实际消耗稀盐酸的质量。
能力提升
5.(2020广东中考)某实验小组探究了溶质的质量分数对H2O2分解速率的影响。实验装置如图1所示,用注射器加入不同浓度的H2O2溶液(见下表),实验中使用传感器装置测算生成O2的质量(圆底烧瓶内气压变化在安全范围),绘制氧气质量随时间变化的曲线,如图2所示。
实验 编号 H2O2的质 量分数(%) H2O2溶液 的体积(mL) 对应曲线
Ⅰ 3.4 10.0 a
Ⅱ 2.4 10.0 b
Ⅲ 1.7 10.0 c(待绘制)
(1)实验前需准备不同浓度的H2O2溶液,若要配制100.0 g质量分数为2.4%的H2O2溶液,需质量分数为30%的H2O2溶液 g。
(2)根据实验探究目的,由曲线a、b可得出的结论是___________________________________________
____________________________。
(3)计算实验 Ⅰ 条件下H2O2完全分解所得氧气的质量,并写出具体计算过程(1.5%~5.0% H2O2溶液的密度取值1.0 g/mL)。
(4)在图2中画出曲线c的大致位置及趋势。
参考答案
第1课时 溶质的质量分数(1)
1.B 2.D 3.B 4.A 5.C
6.(1)t1 ℃时,a、c的溶解度相等,均为20 g
(2)33.3% (3)b>a>c
7.(1)3∶1
(2)解:每100 mL 75%的乙醇消毒液中有75 mL乙醇和25 mL水,则100 mL该消毒液中乙醇的质量为75 mL×0.8 g/mL=60 g,
水的质量为25 mL×1 g/mL=25 g,故该乙醇消毒液中乙醇的质量分数=×100%≈70.6%。
答:该乙醇消毒液中乙醇的质量分数为70.6%。
第2课时 溶质的质量分数(2)
1.B 2.C 3.A 4.D 5.D
6.(1)50 (2)46%
7.(1)1 100 220
(2)解:设需要农药A的质量为x。
20 kg×0.4%=x×20%,x=0.4 kg
需要水的质量为20 kg-0.4 kg=19.6 kg
答:需要0.4 kg农药A和19.6 kg水。
第3课时 根据化学方程式进行的溶质质量分数的综合计算
1.解:设4.9 t该废硫酸中溶质的质量为x。
Fe+H2SO4=== FeSO4+H2↑
98 152
x 1.52 t
=,x=0.98 t
该废硫酸中溶质的质量分数为×100%=20%
答:该废硫酸中溶质的质量分数为20%。
2.(1)50
(2)解:设50 g 该Na2CO3溶液中溶质的质量为x。
Na2CO3+CaCl2=== CaCO3↓+2NaCl
106 100
x 5.0 g
=,x=5.3 g
该Na2CO3溶液中溶质的质量分数为
×100%=10.6%
答:该Na2CO3溶液中溶质的质量分数为10.6%。
3.(1)2.2
(2)解:设53.0 g 该盐酸中溶质的质量为x。
CaCO3+2HCl=== CaCl2+H2O+CO2↑
73 44
x 2.2 g
=,x=3.65 g
该瓶盐酸的溶质质量分数=×100%≈6.9%<7.3%,与试剂瓶标签上的溶质质量分数不相符
答:测定结果与试剂瓶标签上的溶质质量分数不相符。
4.(1)不符合
(2)解:样品中铁的质量为10 g-0.2 g=9.8 g。
设上述反应中实际消耗稀盐酸的质量为x。
Fe + 2HCl=== FeCl2+H2↑
56 73
9.8 g x×7.3%
=,x=175 g
答:上述反应中实际消耗稀盐酸的质量为175 g。
5.(1)8.0
(2)H2O2的质量分数越大,分解越快
(3)解:实验 Ⅰ 中H2O2溶液的质量为10.0 mL×1.0 g/mL=10 g。设实验Ⅰ条件下H2O2完全分解所得氧气的质量为x。
2H2O2 2H2O+O2↑
68 32
10 g×3.4% x
=,x=0.16 g
答:实验Ⅰ条件下H2O2完全分解所得氧气的质量为0.16 g。
(4)如图中曲线c
第1课时 溶质的质量分数(1)
1.某温度下,将20 g硝酸钾溶液蒸干,得到4 g固体。该硝酸钾溶液的溶质质量分数为( )
A.25% B.20% C.16.7% D.4%
2.0.9%的生理盐水广泛用于医疗中,若要配制500 g生理盐水,需要水的质量为( )
A.4.5 g B.45 g C.455 g D.495.5 g
3.现有20 ℃时一定质量的氯化钠饱和溶液,向其中加入少量的硝酸钾固体,充分溶解,所得溶液中氯化钠的质量分数( )
A.增大 B.减小 C.不变 D.无法确定
4.下列有关溶液的说法中,正确的是( )
A.一定温度下,某物质的饱和溶液中溶质的质量分数是定值
B.同一物质的饱和溶液一定比其不饱和溶液中溶质的质量分数大
C.饱和溶液析出晶体后,溶液中溶质的质量分数一定减小
D.不饱和溶液转化为饱和溶液,溶液中溶质的质量分数一定增大
5.用硫酸铜进行如图所示的实验,下列分析正确的是( )
A.三种溶液中溶质的溶解度相等
B.②中溶液是不饱和溶液
C.③中溶液颜色最深
D.温度不同,无法比较①③中溶液的溶质质量分数
6.(2021佛山一模节选)如图是a、b、c三种固体物质的溶解度曲线。
(1)P点表示 。
(2)t2 ℃时,向50 g水中加入50 g a,所得溶液中溶质的质量分数为 (结果精确到0.1%)。
(3)将t1 ℃时三种物质的饱和溶液分别升温至t2 ℃,所得溶液中溶质的质量分数由大到小的顺序为 。
7.(2020柳州中考节选)新冠疫情期间,可用体积分数为75%的乙醇(C2H5OH)消毒液进行消毒。如图为某品牌乙醇消毒液的标签。(纯乙醇的密度约为0.8 g/mL,水的密度约为1 g/mL)
(1)配制该乙醇消毒液需要乙醇和水的体积比为 。
(2)该乙醇消毒液中乙醇的质量分数为多少?(写出计算过程,结果精确到0.1%)
第2课时 溶质的质量分数(2)
1.(2021深圳模拟)将80 g质量分数为36%的浓盐酸稀释成6%的稀盐酸,需加水的质量为( )
A.480 g B.400 g C.320 g D.80 g
2.向100 g 10%的氢氧化钠溶液中加入12.5 g氢氧化钠固体,完全溶解后所得溶液中溶质的质量分数为( )
A.12.5% B.25% C.20% D.22.5%
3.(2022春淮南月考)要使20 g 20%的食盐水的质量分数变为原来的一半,可采取的方法是( )
A.加入20 g 水 B.加入10 g 水
C.加入10 g 食盐 D.蒸发掉10 g 水
4.某温度下,向200 g溶质质量分数为20%的KNO3不饱和溶液甲中加入20 g KNO3固体,完全溶解后恰好得到饱和溶液乙,下列说法正确的是( )
A.该温度下,KNO3的溶解度为30 g
B.溶液乙的溶质质量分数为30%
C.升高温度,甲、乙两溶液的溶质质量分数都增大
D.降低温度,可以使溶液甲变为饱和溶液
5.(2021苏州中考)NaCl和KNO3的溶解度曲线如图所示,下列说法正确的是( )
A.KNO3的溶解度一定大于NaCl
B.NaCl的溶解度受温度影响的程度比KNO3大
C.40 ℃时,KNO3饱和溶液的溶质质量分数为63.9%
D.将60 ℃时的210 g KNO3饱和溶液稀释到20%需加水340 g
6.医疗上通常用过氧化氢溶液或酒精溶液来杀菌消毒,但不同质量分数的溶液性质和用途不同,所以需要配制不同质量分数的溶液。
(1)若要配制300 g质量分数为5%的过氧化氢溶液,需要质量分数为30%的过氧化氢溶液的质量为 g。
(2)某种酒精(C2H5OH)的水溶液,溶质和溶剂中氢原子的个数相等,则该溶液中溶质的质量分数为 。
7.(2021秋台州期末)在每年的杨梅季结束后,果农为了给杨梅果园杀菌灭虫需要喷洒农药。农药A低毒高效,其产品信息标签如图。
(1)1 000 mL农药A的质量为 g,其中含溶质 g。
(2)小明爸爸欲配制20 kg质量分数为0.4%的该农药给杨梅果园杀菌灭虫,需要农药A和水的质量分别为多少?(写出计算过程)
第3课时 根据化学方程式进行的溶质质量分数的综合计算
基础强化
1.(2021阜新中考)某工厂利用废铁屑与废硫酸反应制取硫酸亚铁。现取废硫酸4.9 t与足量的废铁屑反应,得到硫酸亚铁1.52 t,计算该废硫酸中溶质的质量分数。
2.(2021湘西中考改编)为测定一瓶失去标签的Na2CO3溶液的浓度,现取50 g 样品于烧杯中,然后逐滴加入CaCl2溶液,反应过程中生成沉淀的质量与加入
CaCl2溶液的质量关系如图。
(提示:Na2CO3+CaCl2=== CaCO3↓+2NaCl)
(1)恰好完全反应时加入CaCl2溶液的质量为 g。
(2)该Na2CO3溶液中溶质的质量分数为多少?
3.(2021益阳中考)为测定实验室某瓶盐酸的溶质质量分数与标签是否相符,小雷利用其与大理石的反应(其中杂质不参与反应)进行探究实验,数据记录如表。
反应前物质的质量/g 充分反应后物质的质量/g
盐酸样品 大理石 剩余固体(含大理石)+液体
53.0 6.0 56.8
(1)实验中共生成CO2的质量为 g。
(2)通过计算判断测定结果与试剂瓶标签上的溶质质量分数是否相符。
4.(2022宜春一模节选)高碳钢主要用于制造弹簧和耐磨零件(国家标准规定:高碳钢的含碳量为0.60%~1.70%)。为检测某高碳钢(假设该钢材只含铁和碳)是否符合国家标准,兴趣小组称取10 g该钢材样品进行实验,实验过程如图。
(1)该高碳钢 (填“符合”或“不符合”)国家标准。
(2)计算上述反应中实际消耗稀盐酸的质量。
能力提升
5.(2020广东中考)某实验小组探究了溶质的质量分数对H2O2分解速率的影响。实验装置如图1所示,用注射器加入不同浓度的H2O2溶液(见下表),实验中使用传感器装置测算生成O2的质量(圆底烧瓶内气压变化在安全范围),绘制氧气质量随时间变化的曲线,如图2所示。
实验 编号 H2O2的质 量分数(%) H2O2溶液 的体积(mL) 对应曲线
Ⅰ 3.4 10.0 a
Ⅱ 2.4 10.0 b
Ⅲ 1.7 10.0 c(待绘制)
(1)实验前需准备不同浓度的H2O2溶液,若要配制100.0 g质量分数为2.4%的H2O2溶液,需质量分数为30%的H2O2溶液 g。
(2)根据实验探究目的,由曲线a、b可得出的结论是___________________________________________
____________________________。
(3)计算实验 Ⅰ 条件下H2O2完全分解所得氧气的质量,并写出具体计算过程(1.5%~5.0% H2O2溶液的密度取值1.0 g/mL)。
(4)在图2中画出曲线c的大致位置及趋势。
参考答案
第1课时 溶质的质量分数(1)
1.B 2.D 3.B 4.A 5.C
6.(1)t1 ℃时,a、c的溶解度相等,均为20 g
(2)33.3% (3)b>a>c
7.(1)3∶1
(2)解:每100 mL 75%的乙醇消毒液中有75 mL乙醇和25 mL水,则100 mL该消毒液中乙醇的质量为75 mL×0.8 g/mL=60 g,
水的质量为25 mL×1 g/mL=25 g,故该乙醇消毒液中乙醇的质量分数=×100%≈70.6%。
答:该乙醇消毒液中乙醇的质量分数为70.6%。
第2课时 溶质的质量分数(2)
1.B 2.C 3.A 4.D 5.D
6.(1)50 (2)46%
7.(1)1 100 220
(2)解:设需要农药A的质量为x。
20 kg×0.4%=x×20%,x=0.4 kg
需要水的质量为20 kg-0.4 kg=19.6 kg
答:需要0.4 kg农药A和19.6 kg水。
第3课时 根据化学方程式进行的溶质质量分数的综合计算
1.解:设4.9 t该废硫酸中溶质的质量为x。
Fe+H2SO4=== FeSO4+H2↑
98 152
x 1.52 t
=,x=0.98 t
该废硫酸中溶质的质量分数为×100%=20%
答:该废硫酸中溶质的质量分数为20%。
2.(1)50
(2)解:设50 g 该Na2CO3溶液中溶质的质量为x。
Na2CO3+CaCl2=== CaCO3↓+2NaCl
106 100
x 5.0 g
=,x=5.3 g
该Na2CO3溶液中溶质的质量分数为
×100%=10.6%
答:该Na2CO3溶液中溶质的质量分数为10.6%。
3.(1)2.2
(2)解:设53.0 g 该盐酸中溶质的质量为x。
CaCO3+2HCl=== CaCl2+H2O+CO2↑
73 44
x 2.2 g
=,x=3.65 g
该瓶盐酸的溶质质量分数=×100%≈6.9%<7.3%,与试剂瓶标签上的溶质质量分数不相符
答:测定结果与试剂瓶标签上的溶质质量分数不相符。
4.(1)不符合
(2)解:样品中铁的质量为10 g-0.2 g=9.8 g。
设上述反应中实际消耗稀盐酸的质量为x。
Fe + 2HCl=== FeCl2+H2↑
56 73
9.8 g x×7.3%
=,x=175 g
答:上述反应中实际消耗稀盐酸的质量为175 g。
5.(1)8.0
(2)H2O2的质量分数越大,分解越快
(3)解:实验 Ⅰ 中H2O2溶液的质量为10.0 mL×1.0 g/mL=10 g。设实验Ⅰ条件下H2O2完全分解所得氧气的质量为x。
2H2O2 2H2O+O2↑
68 32
10 g×3.4% x
=,x=0.16 g
答:实验Ⅰ条件下H2O2完全分解所得氧气的质量为0.16 g。
(4)如图中曲线c
同课章节目录
