第2章 物质转化与材料利用 单元测试(含答案)
文档属性
| 名称 | 第2章 物质转化与材料利用 单元测试(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 188.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-09-09 15:33:16 | ||
图片预览


文档简介
浙教版九年级第二单元巩固复习(难)
一、单选题
1.飞机的制造材料主要是铝合金。一架普通的飞机,差不多要用50万个铝合金做的铆钉,飞机的外壳、机翼、机尾螺旋桨、引擎的许多部件也是用铝合金制成的。对此,下列叙述错误的是( )
A.铝合金的导电性极差,使飞机不容易被闪电击中
B.铝的密度比较小,大量使用铝材能减小飞机质量,有利于飞行
C.铝的表面容易形成致密的氧化物保护膜,不容易生锈
D.飞机材料采用铝合金而不用纯铝的主要原因,是纯铝比较软而铝合金比较硬
2.将一定量的铜铁混合粉末放入盛有硝酸银溶液的烧杯,不断搅拌,充分反应后过滤,得到滤渣和滤液。向滤渣中加入足量稀盐酸,无现象,向滤液中加入稀盐酸,有白色沉淀。则滤渣的成分是( )
A.银 B.银、铁 C.银、铜 D.银、铜、铁
3.将一定量金属M加入到ZnSO4和CuSO4的混合溶液中,充分反应后,过滤,得到固体滤渣,滤液为无色,向滤渣中滴加稀盐酸有气泡产生。下列有关M、Zn、Cu金属活动性判断一定正确的是( )
A.M>Zn B.Zn>M C.M>Cu D.Cu>M
4.向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入铁粉,反应过程中,测得混合溶液的质量与加入铁粉质量的关系如图所示。下列说法正确的是( )
A.a点时,向溶液中滴加稀盐酸,有白色沉淀产生
B.c点时,向过滤后得到的固体中滴加稀盐酸,有气泡产生
C.d点时,溶液中的溶质为Fe(NO3)2和Cu(NO3)2
D.e点时,过滤后得到的固体中只含有2种物质
5.某溶液含有Cu(NO3)2和AgNO3,现向混合溶液中加入一定量的锌粉,参加反应的锌质量与溶液中金属离子种类的关系如图所示。下列说法错误的是( )
A.ab间(不含两点)的溶液中金属离子为Zn2+、Ag+、Cu2+
B.cd间(不含两点)的溶液中金属离子为Zn2+、Cu2+
C.当参加反应的锌质量为m3时,溶液中金属离子为Zn2+
D.当参加反应的锌质量分别为m1、m2时,溶液中Cu(NO3)2的溶质质量分数相等
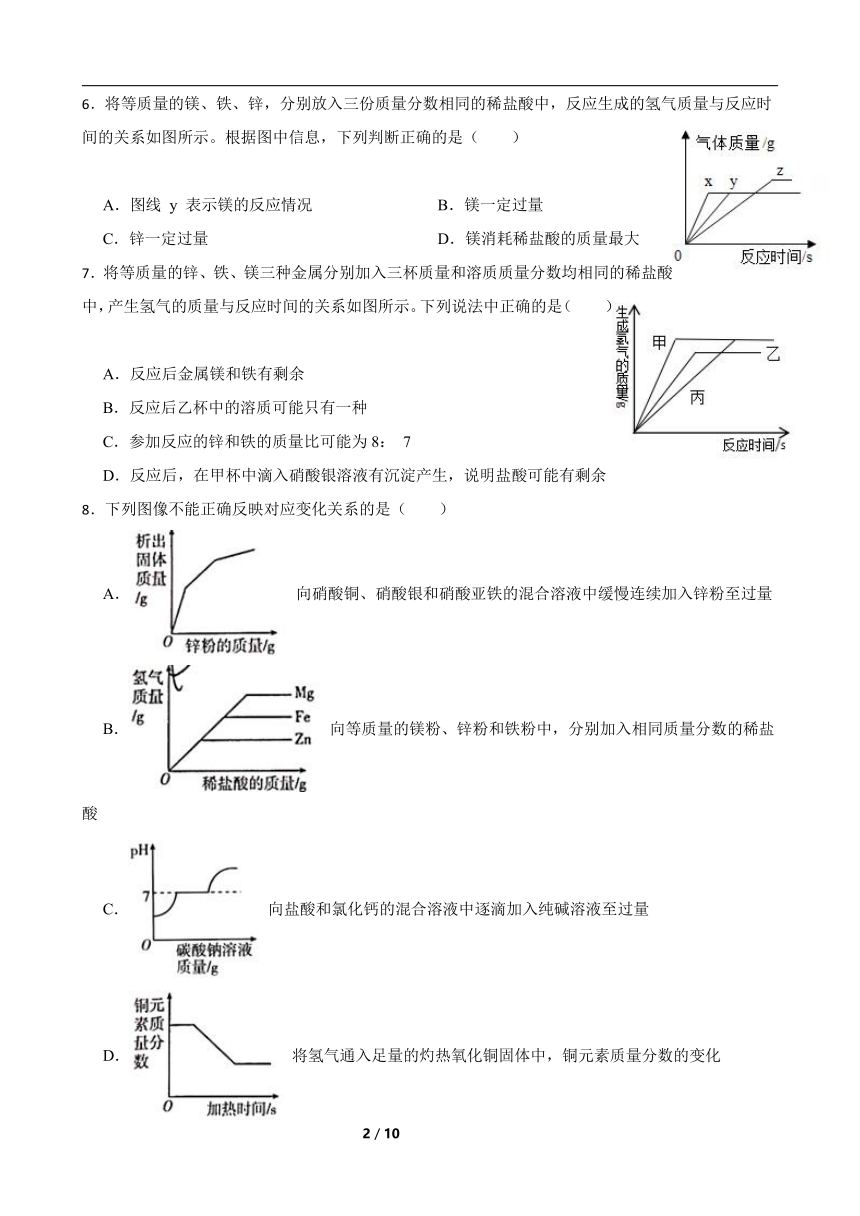
6.将等质量的镁、铁、锌,分别放入三份质量分数相同的稀盐酸中,反应生成的氢气质量与反应时间的关系如图所示。根据图中信息,下列判断正确的是( )
A.图线 y 表示镁的反应情况 B.镁一定过量
C.锌一定过量 D.镁消耗稀盐酸的质量最大
7.将等质量的锌、铁、镁三种金属分别加入三杯质量和溶质质量分数均相同的稀盐酸中,产生氢气的质量与反应时间的关系如图所示。下列说法中正确的是( )
A.反应后金属镁和铁有剩余
B.反应后乙杯中的溶质可能只有一种
C.参加反应的锌和铁的质量比可能为8: 7
D.反应后,在甲杯中滴入硝酸银溶液有沉淀产生,说明盐酸可能有剩余
8.下列图像不能正确反映对应变化关系的是( )
A. 向硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入锌粉至过量
B. 向等质量的镁粉、锌粉和铁粉中,分别加入相同质量分数的稀盐酸
C. 向盐酸和氯化钙的混合溶液中逐滴加入纯碱溶液至过量
D. 将氢气通入足量的灼热氧化铜固体中,铜元素质量分数的变化
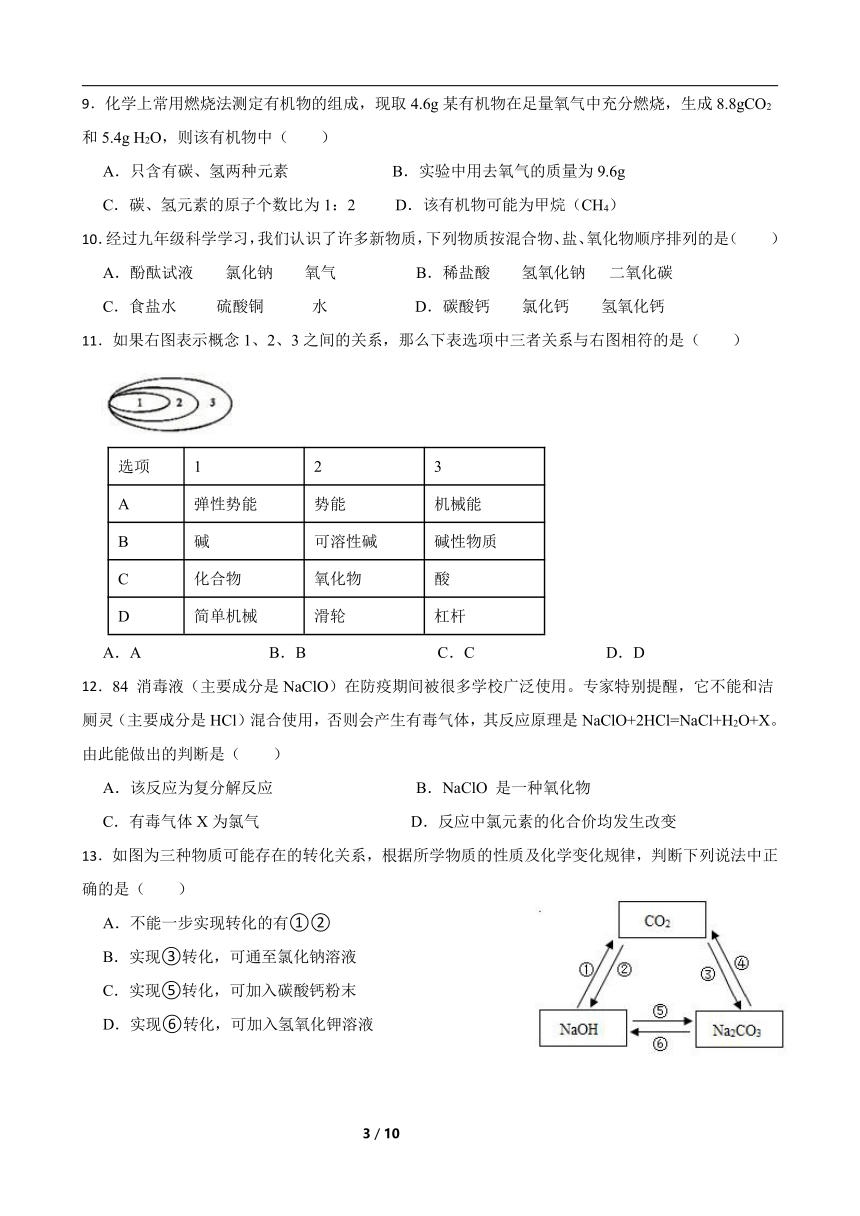
9.化学上常用燃烧法测定有机物的组成,现取4.6g某有机物在足量氧气中充分燃烧,生成8.8gCO2和5.4g H2O,则该有机物中( )
A.只含有碳、氢两种元素 B.实验中用去氧气的质量为9.6g
C.碳、氢元素的原子个数比为1:2 D.该有机物可能为甲烷(CH4)
10.经过九年级科学学习,我们认识了许多新物质,下列物质按混合物、盐、氧化物顺序排列的是( )
A.酚酞试液 氯化钠 氧气 B.稀盐酸 氢氧化钠 二氧化碳
C.食盐水 硫酸铜 水 D.碳酸钙 氯化钙 氢氧化钙
11.如果右图表示概念1、2、3之间的关系,那么下表选项中三者关系与右图相符的是( )
选项 1 2 3
A 弹性势能 势能 机械能
B 碱 可溶性碱 碱性物质
C 化合物 氧化物 酸
D 简单机械 滑轮 杠杆
A.A B.B C.C D.D
12.84 消毒液(主要成分是NaClO)在防疫期间被很多学校广泛使用。专家特别提醒,它不能和洁厕灵(主要成分是HCl)混合使用,否则会产生有毒气体,其反应原理是NaClO+2HCl=NaCl+H2O+X。由此能做出的判断是( )
A.该反应为复分解反应 B.NaClO 是一种氧化物
C.有毒气体X为氯气 D.反应中氯元素的化合价均发生改变
13.如图为三种物质可能存在的转化关系,根据所学物质的性质及化学变化规律,判断下列说法中正确的是( )
A.不能一步实现转化的有①②
B.实现③转化,可通至氯化钠溶液
C.实现⑤转化,可加入碳酸钙粉末
D.实现⑥转化,可加入氢氧化钾溶液
14.一包不纯的Na2CO3固体,杂质可能是CaCl2、NaCl、NaHCO3中的一种或几种。现取该样品溶于水得到澄清溶液;另取样品10.6g,加入100g稀盐酸恰好完全反应,产生气体4g,则下列判断不正确的是( )
A.加水得澄清溶液,样品中一定没有CaCl2 B.样品中一定含有NaCl,可能含有NaHCO3
C.样品中杂质可能只含有NaCl D.所加的稀盐酸溶质质量分数大于7.3%
15.在托盘天平两边各放一只等质量的烧杯,向左右两只烧杯中分别注入相同质量、相同质量分数的盐酸和稀硫酸,天平平衡,若向两烧杯中分别投入等质量,等表面积的锌粒和镁粒,待充分反应后,发现两烧杯中固体均有剩余,则天平指针发生的偏转是( )
A.一直偏向左 B.一直偏向右
C.先偏向左后偏向右 D.先偏向右后偏向左
16.有一包金属粉末,可能由Mg、Zn、Fe、Al、Ag这几种金属中的一种或几种组成。取该样品2.4g,加入100g稀硫酸恰好完全反应,只得到0.2gH2和无色溶液。下列说法正确的是( )
A.样品中一定只含有Mg B.样品中一定不含有Ag,可能含有Fe
C.该粉末中最多含有3种金属 D.100g稀硫酸中含H2SO4质量为19.6g
二、填空题
17.古往今来,金属材料和制品在我们的社会生活中一直起者非常重要的作用。
(1)考古工作者发现铁质的出土文物往往锈蚀严重,铁生锈的条件是 。在实验室常用稀盐酸清除铁锈,化学方程式为 。
(2)近年来,我国高铁建设促进了经济、社会的快速发展。制造铁轨的材料是合金钢,主要原因是合金钢具有 的优越性能(要求只答一条)。
(3)某同学在实验室进行了两个有关金属性质的实验:实验Ⅰ:硫酸铝溶液和铁粉混合
实验Ⅱ:硫酸铜溶液与铁粉混合
在上述两个实验结束后,该同学将实验Ⅰ和Ⅱ的物质全部倒入同一个烧杯中,发现烧杯内的红色固体明显增多。一段时间后过滤,向滤渣中滴加盐酸,结果没有气泡产生。那么,滤液中所含金属离子的情况可能是 〔填写序号)。
①A13+②A13+、Fe2+③A13+、Fe3+④Fe2+、Cu2+⑤A13+、Fe2+、Cu2+
18.有机物是自然界物质中的一个大家族。
(1)下列是生活中常见的物质:①尿素[CO(NH2)2];②纯碱(Na2CO3);③酒精(C2H5OH);④葡萄糖(C6H12O6);⑤碳酸(H2CO3);⑥甲烷(CH4),属于有机物的是 。(填序号)
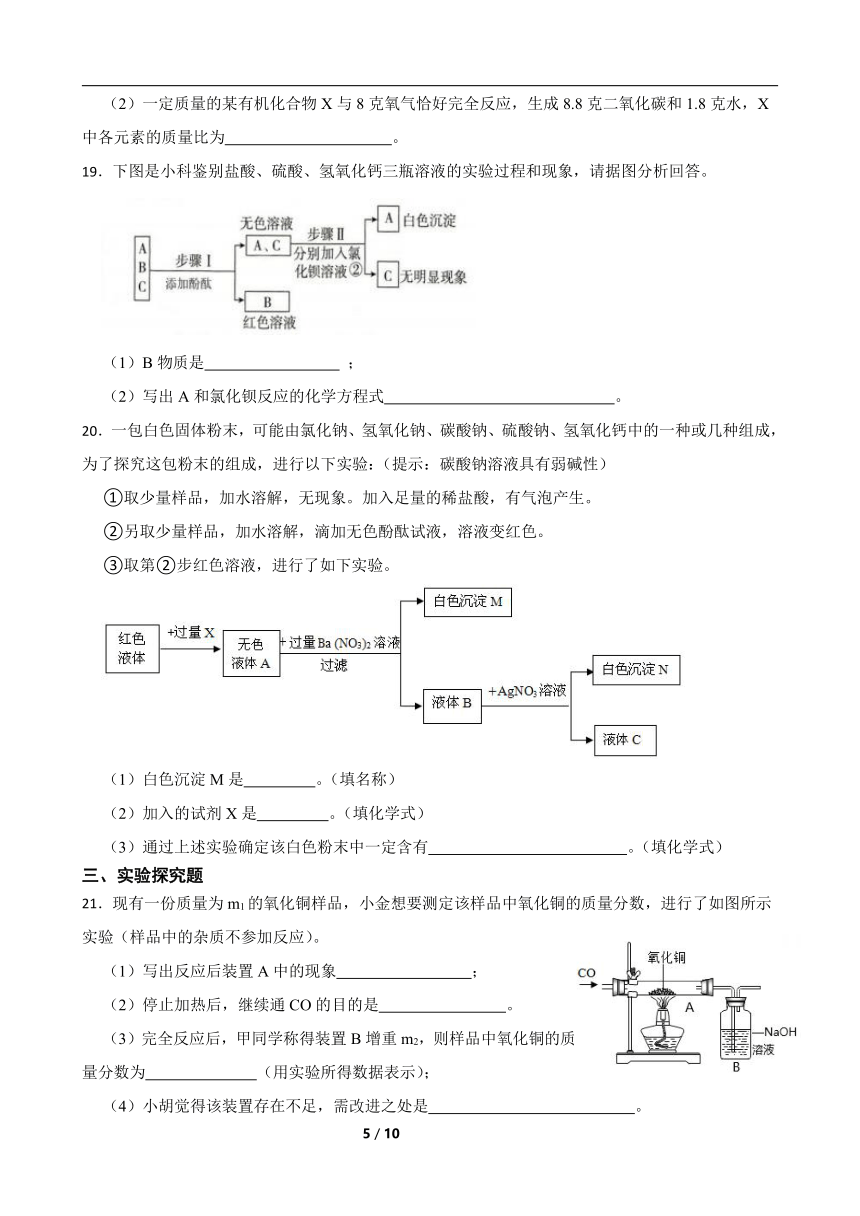
(2)一定质量的某有机化合物X与8克氧气恰好完全反应,生成8.8克二氧化碳和1.8克水,X中各元素的质量比为 。
19.下图是小科鉴别盐酸、硫酸、氢氧化钙三瓶溶液的实验过程和现象,请据图分析回答。
(1)B物质是 ;
(2)写出A和氯化钡反应的化学方程式 。
20.一包白色固体粉末,可能由氯化钠、氢氧化钠、碳酸钠、硫酸钠、氢氧化钙中的一种或几种组成,为了探究这包粉末的组成,进行以下实验:(提示:碳酸钠溶液具有弱碱性)
①取少量样品,加水溶解,无现象。加入足量的稀盐酸,有气泡产生。
②另取少量样品,加水溶解,滴加无色酚酞试液,溶液变红色。
③取第②步红色溶液,进行了如下实验。
(1)白色沉淀M是 。(填名称)
(2)加入的试剂X是 。(填化学式)
(3)通过上述实验确定该白色粉末中一定含有 。(填化学式)
三、实验探究题
21.现有一份质量为m1的氧化铜样品,小金想要测定该样品中氧化铜的质量分数,进行了如图所示实验(样品中的杂质不参加反应)。
(1)写出反应后装置A中的现象 ;
(2)停止加热后,继续通CO的目的是 。
(3)完全反应后,甲同学称得装置B增重m2,则样品中氧化铜的质量分数为 (用实验所得数据表示);
(4)小胡觉得该装置存在不足,需改进之处是 。
22.某固体混合物中可能含有氢氧化钠、硝酸钠、氯化钠、硫酸钠、碳酸钠。为了研究该混合物的成分,某同学按下列流程进行了实验(各步均恰好完全反应):
根据流程图回答问题:
(1)反应④的化学方程式为 。
(2)根据实验现象推断该混合物中一定含有的物质是 ( 填化学式)。
(3)该同学为了进一步确定固体混合物的组成,取样品20.9g (其中含钠元素质量为6.9g),按上述流程图进行实验,产生11.65g白色沉淀A,产生2.2g气体W。通过计算,确定该混合物中还含有的物质是 (填化学式),其质量为 g。
四、解答题
23.杭州绕城下沙南出口在元旦开通,下沙开车去机场最快十分钟.地铁1号线三期从下沙江滨到机场也只需要12分钟左右.
(1)小应开车从下沙南出发,小应的汽车使用无铅汽油,我国部分地区使用乙醇汽油.请写出乙醇(C2H5OH)在足量的氧气中完全燃烧生成CO2和H2O的化学方程式.
(2)为了改善汽车内空气质量,车内安装智能空气净化器。空气净化一般经过 ①滤网过滤 ②活性炭吸附 ③负离子沉降 ④臭氧消毒等四步骤,其中主要通过化学变化实现净化目的的是 。(填序号)
(3)从低碳环保考虑,许多人会选择电动汽车代步,用直流充电桩给电动汽车充电时将电能转化为 贮存在电动汽车的蓄电池内.
(4)地铁的动力为电力,开动时电车上裸露的电刷沿架空电线滑动.当它开动时,跟架空电线的接触点上,由于高速摩擦,会产生高温,因此接触点上材料应该具有耐高温、不易氧化,能导电的性质.下列材料较为合适的是______.
A.金刚石 B.石墨 C.铝 D.铜
24.阅读下列材料。
新型铸铁材料 蠕墨铸铁在高碳铁液中加入稀土合金,得到断口呈“花斑”状,石墨为蠕虫状蠕墨铸铁(又称蠕铁)。蠕铁是具有片状和球状石墨之间的过渡形态铸铁,片状石墨和球状石墨内部原子排列方式不同。蠕铁是一种具有良好力学性能(耐高温、强度大、断面敏感性小)、导热率高和抗氧化性能的新型铸铁材料。蠕铁广泛用于制造汽车发动机、汽车制动零件、排气管等。国产蠕铁中的蠕化剂均含有稀土元素,如稀土硅铁镁合金、稀土硅钙合金等。国产蠕铁技术冲破了国外的技术封锁,助推我国发动机制造技术迈向世界领先水平。
回答下列问题:
(1)蠕墨铸铁从材料分类看属于 材料(填“有机合成”或“金属”)。
(2)蠕墨铸铁作为发动机材料主要是利用其独特的 (填“物理”或“化学”)性质。
(3)片状石墨和球状石墨的组成元素 (填“相同”或“不同”)。
(4)工业上采用赤铁矿石(主要成分为氧化铁)炼铁的反应原理是 。(用化学方程式表示),其中 是还原剂
(5)要炼出含铁90%的生铁100吨,至少需要Fe2O3质量分数为80%的铁矿石多少吨?(计算结果取整数)
25.在5.6g铁粉中,先逐滴加入M1克Cu(NO3)2溶液,充分反应后再逐滴加入AgNO3溶液,剩余固体质量(生成溶质均未达到饱和状态)与所加溶液总质量的关系如图所示。
请根据题目所给信息回答下列问题:
(1)写出ab段发生的反应的化学方程式: 。
(2)e点对应的固体为 ,溶液中的溶质有 种。
(3)若c点所得溶液质量为100克,请计算c点溶质的质量分数。
答案解析部分
1.【答案】A
2.【答案】A
3.【答案】C
4.【答案】A
5.【答案】D
6.【答案】B
7.【答案】C
8.【答案】D
9.【答案】B
10.【答案】C
11.【答案】A
12.【答案】C
13.【答案】A
14.【答案】D
15.【答案】C
16.【答案】C
17.【答案】(1)铁与氧气、水同时接触(潮湿的空气);Fe2O3+ 6HCl=2FeCl3+3H2O
(2)硬度大、机械性能好、韧性好等言之有理即可
(3)②⑤
18.【答案】(1)①③④⑥
(2)m(C)∶m(H)=12∶1
19.【答案】(1)氢氧化钙溶液
(2)H2SO4+BaCl2=BaSO4↓+2HCl
20.【答案】(1)硫酸钡
(2)HNO3
(3)NaCl、Na2CO3、Na2SO4
21.【答案】(1)黑色固体变红
(2)防止Cu被空气氧化,防止氢氧化钠溶液倒吸
(3)20m2/11m1
(4)B装置后加尾气处理装置
22.【答案】(1)AgNO3+NaCl=AgCl↓+NaNO3
(2)Na2CO3 Na2SO4
(3)NaNO3;8.5
23.【答案】(1)C2H5OH+3O2=2CO2+3H2O
(2)④
(3)化学能
(4)B
24.【答案】(1)金属
(2)物理
(3)相同
(4)Fe2O3+3CO 2Fe+3CO2;CO
(5)解:设需要赤铁矿石的质量为x.
Fe2O3+3CO 2Fe+3CO2
160 112
80%x 100t×90%
x=160.7t
答:需要赤铁矿石 161t.
25.【答案】(1)Fe+Cu(NO ) =Fe(NO ) +Cu
(2)Ag;3
(3)解:ac段反生的反应有:Fe+Cu(NO ) =Fe(NO ) +Cu
Fe+AgNO =Fe(NO ) +2Ag
可知c点所得溶液中的溶质为Fe(NO ) ,设生成Fe(NO ) 的质量为x,
且5.6克铁粉全部反应,则可得出:
Fe~ Fe(NO )
56 180
5.6克 x
得出x=18克
Fe(NO ) %=
1 / 1
一、单选题
1.飞机的制造材料主要是铝合金。一架普通的飞机,差不多要用50万个铝合金做的铆钉,飞机的外壳、机翼、机尾螺旋桨、引擎的许多部件也是用铝合金制成的。对此,下列叙述错误的是( )
A.铝合金的导电性极差,使飞机不容易被闪电击中
B.铝的密度比较小,大量使用铝材能减小飞机质量,有利于飞行
C.铝的表面容易形成致密的氧化物保护膜,不容易生锈
D.飞机材料采用铝合金而不用纯铝的主要原因,是纯铝比较软而铝合金比较硬
2.将一定量的铜铁混合粉末放入盛有硝酸银溶液的烧杯,不断搅拌,充分反应后过滤,得到滤渣和滤液。向滤渣中加入足量稀盐酸,无现象,向滤液中加入稀盐酸,有白色沉淀。则滤渣的成分是( )
A.银 B.银、铁 C.银、铜 D.银、铜、铁
3.将一定量金属M加入到ZnSO4和CuSO4的混合溶液中,充分反应后,过滤,得到固体滤渣,滤液为无色,向滤渣中滴加稀盐酸有气泡产生。下列有关M、Zn、Cu金属活动性判断一定正确的是( )
A.M>Zn B.Zn>M C.M>Cu D.Cu>M
4.向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入铁粉,反应过程中,测得混合溶液的质量与加入铁粉质量的关系如图所示。下列说法正确的是( )
A.a点时,向溶液中滴加稀盐酸,有白色沉淀产生
B.c点时,向过滤后得到的固体中滴加稀盐酸,有气泡产生
C.d点时,溶液中的溶质为Fe(NO3)2和Cu(NO3)2
D.e点时,过滤后得到的固体中只含有2种物质
5.某溶液含有Cu(NO3)2和AgNO3,现向混合溶液中加入一定量的锌粉,参加反应的锌质量与溶液中金属离子种类的关系如图所示。下列说法错误的是( )
A.ab间(不含两点)的溶液中金属离子为Zn2+、Ag+、Cu2+
B.cd间(不含两点)的溶液中金属离子为Zn2+、Cu2+
C.当参加反应的锌质量为m3时,溶液中金属离子为Zn2+
D.当参加反应的锌质量分别为m1、m2时,溶液中Cu(NO3)2的溶质质量分数相等
6.将等质量的镁、铁、锌,分别放入三份质量分数相同的稀盐酸中,反应生成的氢气质量与反应时间的关系如图所示。根据图中信息,下列判断正确的是( )
A.图线 y 表示镁的反应情况 B.镁一定过量
C.锌一定过量 D.镁消耗稀盐酸的质量最大
7.将等质量的锌、铁、镁三种金属分别加入三杯质量和溶质质量分数均相同的稀盐酸中,产生氢气的质量与反应时间的关系如图所示。下列说法中正确的是( )
A.反应后金属镁和铁有剩余
B.反应后乙杯中的溶质可能只有一种
C.参加反应的锌和铁的质量比可能为8: 7
D.反应后,在甲杯中滴入硝酸银溶液有沉淀产生,说明盐酸可能有剩余
8.下列图像不能正确反映对应变化关系的是( )
A. 向硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入锌粉至过量
B. 向等质量的镁粉、锌粉和铁粉中,分别加入相同质量分数的稀盐酸
C. 向盐酸和氯化钙的混合溶液中逐滴加入纯碱溶液至过量
D. 将氢气通入足量的灼热氧化铜固体中,铜元素质量分数的变化
9.化学上常用燃烧法测定有机物的组成,现取4.6g某有机物在足量氧气中充分燃烧,生成8.8gCO2和5.4g H2O,则该有机物中( )
A.只含有碳、氢两种元素 B.实验中用去氧气的质量为9.6g
C.碳、氢元素的原子个数比为1:2 D.该有机物可能为甲烷(CH4)
10.经过九年级科学学习,我们认识了许多新物质,下列物质按混合物、盐、氧化物顺序排列的是( )
A.酚酞试液 氯化钠 氧气 B.稀盐酸 氢氧化钠 二氧化碳
C.食盐水 硫酸铜 水 D.碳酸钙 氯化钙 氢氧化钙
11.如果右图表示概念1、2、3之间的关系,那么下表选项中三者关系与右图相符的是( )
选项 1 2 3
A 弹性势能 势能 机械能
B 碱 可溶性碱 碱性物质
C 化合物 氧化物 酸
D 简单机械 滑轮 杠杆
A.A B.B C.C D.D
12.84 消毒液(主要成分是NaClO)在防疫期间被很多学校广泛使用。专家特别提醒,它不能和洁厕灵(主要成分是HCl)混合使用,否则会产生有毒气体,其反应原理是NaClO+2HCl=NaCl+H2O+X。由此能做出的判断是( )
A.该反应为复分解反应 B.NaClO 是一种氧化物
C.有毒气体X为氯气 D.反应中氯元素的化合价均发生改变
13.如图为三种物质可能存在的转化关系,根据所学物质的性质及化学变化规律,判断下列说法中正确的是( )
A.不能一步实现转化的有①②
B.实现③转化,可通至氯化钠溶液
C.实现⑤转化,可加入碳酸钙粉末
D.实现⑥转化,可加入氢氧化钾溶液
14.一包不纯的Na2CO3固体,杂质可能是CaCl2、NaCl、NaHCO3中的一种或几种。现取该样品溶于水得到澄清溶液;另取样品10.6g,加入100g稀盐酸恰好完全反应,产生气体4g,则下列判断不正确的是( )
A.加水得澄清溶液,样品中一定没有CaCl2 B.样品中一定含有NaCl,可能含有NaHCO3
C.样品中杂质可能只含有NaCl D.所加的稀盐酸溶质质量分数大于7.3%
15.在托盘天平两边各放一只等质量的烧杯,向左右两只烧杯中分别注入相同质量、相同质量分数的盐酸和稀硫酸,天平平衡,若向两烧杯中分别投入等质量,等表面积的锌粒和镁粒,待充分反应后,发现两烧杯中固体均有剩余,则天平指针发生的偏转是( )
A.一直偏向左 B.一直偏向右
C.先偏向左后偏向右 D.先偏向右后偏向左
16.有一包金属粉末,可能由Mg、Zn、Fe、Al、Ag这几种金属中的一种或几种组成。取该样品2.4g,加入100g稀硫酸恰好完全反应,只得到0.2gH2和无色溶液。下列说法正确的是( )
A.样品中一定只含有Mg B.样品中一定不含有Ag,可能含有Fe
C.该粉末中最多含有3种金属 D.100g稀硫酸中含H2SO4质量为19.6g
二、填空题
17.古往今来,金属材料和制品在我们的社会生活中一直起者非常重要的作用。
(1)考古工作者发现铁质的出土文物往往锈蚀严重,铁生锈的条件是 。在实验室常用稀盐酸清除铁锈,化学方程式为 。
(2)近年来,我国高铁建设促进了经济、社会的快速发展。制造铁轨的材料是合金钢,主要原因是合金钢具有 的优越性能(要求只答一条)。
(3)某同学在实验室进行了两个有关金属性质的实验:实验Ⅰ:硫酸铝溶液和铁粉混合
实验Ⅱ:硫酸铜溶液与铁粉混合
在上述两个实验结束后,该同学将实验Ⅰ和Ⅱ的物质全部倒入同一个烧杯中,发现烧杯内的红色固体明显增多。一段时间后过滤,向滤渣中滴加盐酸,结果没有气泡产生。那么,滤液中所含金属离子的情况可能是 〔填写序号)。
①A13+②A13+、Fe2+③A13+、Fe3+④Fe2+、Cu2+⑤A13+、Fe2+、Cu2+
18.有机物是自然界物质中的一个大家族。
(1)下列是生活中常见的物质:①尿素[CO(NH2)2];②纯碱(Na2CO3);③酒精(C2H5OH);④葡萄糖(C6H12O6);⑤碳酸(H2CO3);⑥甲烷(CH4),属于有机物的是 。(填序号)
(2)一定质量的某有机化合物X与8克氧气恰好完全反应,生成8.8克二氧化碳和1.8克水,X中各元素的质量比为 。
19.下图是小科鉴别盐酸、硫酸、氢氧化钙三瓶溶液的实验过程和现象,请据图分析回答。
(1)B物质是 ;
(2)写出A和氯化钡反应的化学方程式 。
20.一包白色固体粉末,可能由氯化钠、氢氧化钠、碳酸钠、硫酸钠、氢氧化钙中的一种或几种组成,为了探究这包粉末的组成,进行以下实验:(提示:碳酸钠溶液具有弱碱性)
①取少量样品,加水溶解,无现象。加入足量的稀盐酸,有气泡产生。
②另取少量样品,加水溶解,滴加无色酚酞试液,溶液变红色。
③取第②步红色溶液,进行了如下实验。
(1)白色沉淀M是 。(填名称)
(2)加入的试剂X是 。(填化学式)
(3)通过上述实验确定该白色粉末中一定含有 。(填化学式)
三、实验探究题
21.现有一份质量为m1的氧化铜样品,小金想要测定该样品中氧化铜的质量分数,进行了如图所示实验(样品中的杂质不参加反应)。
(1)写出反应后装置A中的现象 ;
(2)停止加热后,继续通CO的目的是 。
(3)完全反应后,甲同学称得装置B增重m2,则样品中氧化铜的质量分数为 (用实验所得数据表示);
(4)小胡觉得该装置存在不足,需改进之处是 。
22.某固体混合物中可能含有氢氧化钠、硝酸钠、氯化钠、硫酸钠、碳酸钠。为了研究该混合物的成分,某同学按下列流程进行了实验(各步均恰好完全反应):
根据流程图回答问题:
(1)反应④的化学方程式为 。
(2)根据实验现象推断该混合物中一定含有的物质是 ( 填化学式)。
(3)该同学为了进一步确定固体混合物的组成,取样品20.9g (其中含钠元素质量为6.9g),按上述流程图进行实验,产生11.65g白色沉淀A,产生2.2g气体W。通过计算,确定该混合物中还含有的物质是 (填化学式),其质量为 g。
四、解答题
23.杭州绕城下沙南出口在元旦开通,下沙开车去机场最快十分钟.地铁1号线三期从下沙江滨到机场也只需要12分钟左右.
(1)小应开车从下沙南出发,小应的汽车使用无铅汽油,我国部分地区使用乙醇汽油.请写出乙醇(C2H5OH)在足量的氧气中完全燃烧生成CO2和H2O的化学方程式.
(2)为了改善汽车内空气质量,车内安装智能空气净化器。空气净化一般经过 ①滤网过滤 ②活性炭吸附 ③负离子沉降 ④臭氧消毒等四步骤,其中主要通过化学变化实现净化目的的是 。(填序号)
(3)从低碳环保考虑,许多人会选择电动汽车代步,用直流充电桩给电动汽车充电时将电能转化为 贮存在电动汽车的蓄电池内.
(4)地铁的动力为电力,开动时电车上裸露的电刷沿架空电线滑动.当它开动时,跟架空电线的接触点上,由于高速摩擦,会产生高温,因此接触点上材料应该具有耐高温、不易氧化,能导电的性质.下列材料较为合适的是______.
A.金刚石 B.石墨 C.铝 D.铜
24.阅读下列材料。
新型铸铁材料 蠕墨铸铁在高碳铁液中加入稀土合金,得到断口呈“花斑”状,石墨为蠕虫状蠕墨铸铁(又称蠕铁)。蠕铁是具有片状和球状石墨之间的过渡形态铸铁,片状石墨和球状石墨内部原子排列方式不同。蠕铁是一种具有良好力学性能(耐高温、强度大、断面敏感性小)、导热率高和抗氧化性能的新型铸铁材料。蠕铁广泛用于制造汽车发动机、汽车制动零件、排气管等。国产蠕铁中的蠕化剂均含有稀土元素,如稀土硅铁镁合金、稀土硅钙合金等。国产蠕铁技术冲破了国外的技术封锁,助推我国发动机制造技术迈向世界领先水平。
回答下列问题:
(1)蠕墨铸铁从材料分类看属于 材料(填“有机合成”或“金属”)。
(2)蠕墨铸铁作为发动机材料主要是利用其独特的 (填“物理”或“化学”)性质。
(3)片状石墨和球状石墨的组成元素 (填“相同”或“不同”)。
(4)工业上采用赤铁矿石(主要成分为氧化铁)炼铁的反应原理是 。(用化学方程式表示),其中 是还原剂
(5)要炼出含铁90%的生铁100吨,至少需要Fe2O3质量分数为80%的铁矿石多少吨?(计算结果取整数)
25.在5.6g铁粉中,先逐滴加入M1克Cu(NO3)2溶液,充分反应后再逐滴加入AgNO3溶液,剩余固体质量(生成溶质均未达到饱和状态)与所加溶液总质量的关系如图所示。
请根据题目所给信息回答下列问题:
(1)写出ab段发生的反应的化学方程式: 。
(2)e点对应的固体为 ,溶液中的溶质有 种。
(3)若c点所得溶液质量为100克,请计算c点溶质的质量分数。
答案解析部分
1.【答案】A
2.【答案】A
3.【答案】C
4.【答案】A
5.【答案】D
6.【答案】B
7.【答案】C
8.【答案】D
9.【答案】B
10.【答案】C
11.【答案】A
12.【答案】C
13.【答案】A
14.【答案】D
15.【答案】C
16.【答案】C
17.【答案】(1)铁与氧气、水同时接触(潮湿的空气);Fe2O3+ 6HCl=2FeCl3+3H2O
(2)硬度大、机械性能好、韧性好等言之有理即可
(3)②⑤
18.【答案】(1)①③④⑥
(2)m(C)∶m(H)=12∶1
19.【答案】(1)氢氧化钙溶液
(2)H2SO4+BaCl2=BaSO4↓+2HCl
20.【答案】(1)硫酸钡
(2)HNO3
(3)NaCl、Na2CO3、Na2SO4
21.【答案】(1)黑色固体变红
(2)防止Cu被空气氧化,防止氢氧化钠溶液倒吸
(3)20m2/11m1
(4)B装置后加尾气处理装置
22.【答案】(1)AgNO3+NaCl=AgCl↓+NaNO3
(2)Na2CO3 Na2SO4
(3)NaNO3;8.5
23.【答案】(1)C2H5OH+3O2=2CO2+3H2O
(2)④
(3)化学能
(4)B
24.【答案】(1)金属
(2)物理
(3)相同
(4)Fe2O3+3CO 2Fe+3CO2;CO
(5)解:设需要赤铁矿石的质量为x.
Fe2O3+3CO 2Fe+3CO2
160 112
80%x 100t×90%
x=160.7t
答:需要赤铁矿石 161t.
25.【答案】(1)Fe+Cu(NO ) =Fe(NO ) +Cu
(2)Ag;3
(3)解:ac段反生的反应有:Fe+Cu(NO ) =Fe(NO ) +Cu
Fe+AgNO =Fe(NO ) +2Ag
可知c点所得溶液中的溶质为Fe(NO ) ,设生成Fe(NO ) 的质量为x,
且5.6克铁粉全部反应,则可得出:
Fe~ Fe(NO )
56 180
5.6克 x
得出x=18克
Fe(NO ) %=
1 / 1
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
