湖南省长沙市天心区2022-2023学年高三上学期9月入学检测化学试卷(Word版含答案)
文档属性
| 名称 | 湖南省长沙市天心区2022-2023学年高三上学期9月入学检测化学试卷(Word版含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-09 00:00:00 | ||
图片预览



文档简介
长沙市天心区2022-2023学年高三上学期9月入学检测
化学试题
满分:100分可能用到的原子量:H1 O16 Na23 S32 C135.5 C12 Bi209 Fe56 K39 Mn55 Cu64 I127
一、选择题(本题共10小题,每小题3分,共30分。每小题只有一个正确选项。)
1.化学与生活密切相关。下列叙述正确的是
A.漂白粉与盐酸可混合使用以提高消毒效果
B.温室气体是形成酸雨的主要物质
C.棉花、麻和蚕丝均为碳水化合物
D.干冰可用在舞台上制造“云雾”
2.下列化学用语正确的是
A.二氧化碳的电子式:
B.乙醛的空间填充模型:
C.基态的价电子轨道表示式:
D.反式聚异戊二烯的结构简式:
3.为阿伏加德罗常数的值,下列说法正确的是
A.下,氢气中质子的数目为
B.溶液中,的数目为
C.苯甲酸完全燃烧,生成的数目为
D.电解熔融,阴极增重,外电路中通过电子的数目为
*4.已知有下列三个反应:
①
;
③
下列有关说法正确的是
A.反应①②③中的氧化产物分别是
B.根据以上方程式可以得到氧化性:
C.可以推理得到:
D.在反应(3)中有2个生成,则被还原的为2个
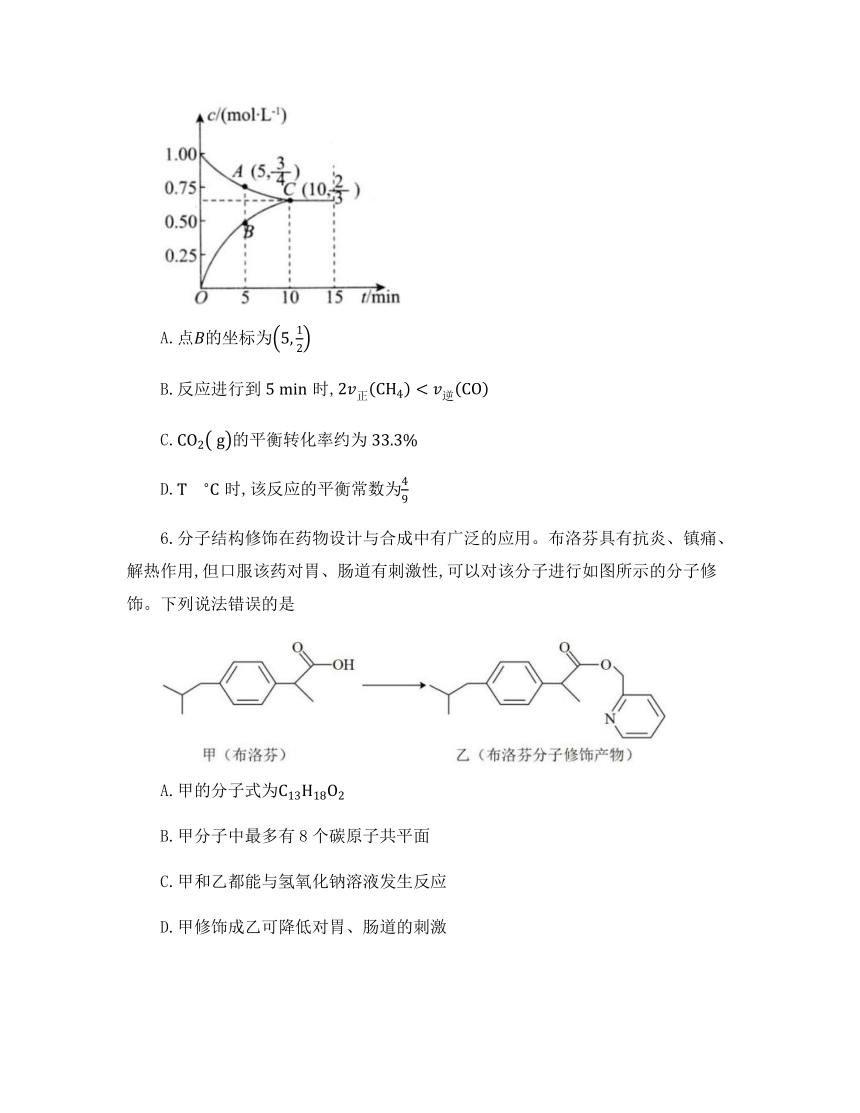
5.时,向某恒温恒容密闭容器中充入等物质的量的和,发生二氧化碳重整甲烷反应:,测得体系中和的物质的量浓度随时间变化如图所示,下列说法错误的是
A.点的坐标为
B.反应进行到时,
C.的平衡转化率约为
D.时,该反应的平衡常数为
6.分子结构修饰在药物设计与合成中有广泛的应用。布洛芬具有抗炎、镇痛、解热作用,但口服该药对胃、肠道有刺激性,可以对该分子进行如图所示的分子修饰。下列说法错误的是
A.甲的分子式为
B.甲分子中最多有8个碳原子共平面
C.甲和乙都能与氢氧化钠溶液发生反应
D.甲修饰成乙可降低对胃、肠道的刺激
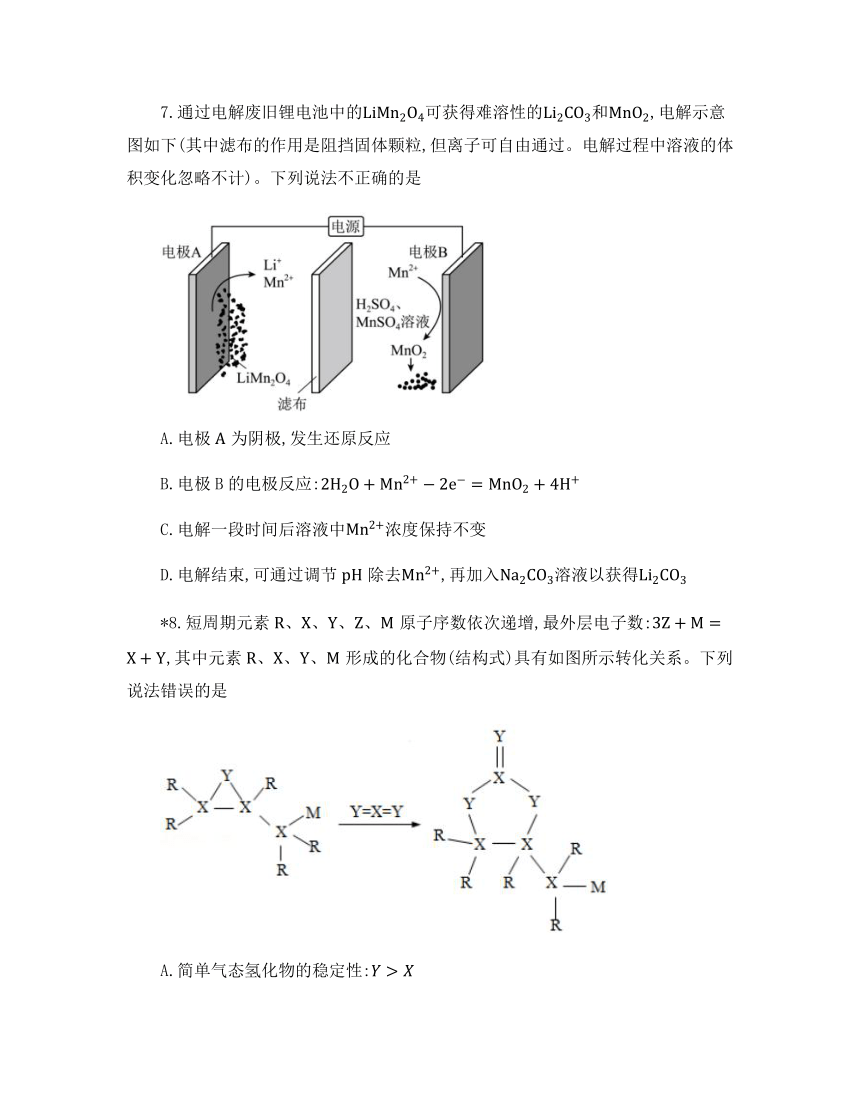
7.通过电解废旧锂电池中的可获得难溶性的和,电解示意图如下(其中滤布的作用是阻挡固体颗粒,但离子可自由通过。电解过程中溶液的体积变化忽略不计)。下列说法不正确的是
A.电极为阴极,发生还原反应
B.电极B的电极反应:
C.电解一段时间后溶液中浓度保持不变
D.电解结束,可通过调节除去,再加入溶液以获得
*8.短周期元素原子序数依次递增,最外层电子数:,其中元素形成的化合物(结构式)具有如图所示转化关系。下列说法错误的是
A.简单气态氢化物的稳定性:
B.简单离子半径:
C.的最高价氧化物对应水化物为强酸
D.分别与形成的化合物中均只含离子键
*9.某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。下列分析或结果错误的是
A.原混合酸中物质的量为
B.OA段产生的是段的反应为段产生氢气
C.第二份溶液中最终溶质为
D.浓度为
*10.常温下浓度均为的两种溶液:(1)溶液(2)溶液,下列说法不正确的是
A.水电离产生的:(1)<(2)
B.溶液说明为弱酸
C.两种溶液中均存在:
D.等体积混合所得酸性溶液中:
二、选择题,本题共4小题,每小题4分,共16分。每小题有一个或两个正确选项,全部选对得4分,选对但不全得2分,有选错得0分。)
*11.中国科学家研究在催化剂上还原生成和的路径,各基元反应及活化能如图所示,下列说法错误的是
A.生成的各基元反应中,元素均被还原
B.生成的总反应方程式为
C.在催化剂上,更容易被还原为
D.该过程中涉及极性键、非极性键的断裂和形成
12.以印刷线路板酸性蚀刻废液(含有)为原料制备纳米的流程如图:
下列说法错误的是
A.“沉淀”产生的,不洗涤直接灼烧不影响产品质量
B.“在空气中灼烧”时发生了非氧化还原反应
C.调节为的目的是使完全沉淀,不沉淀
D.“沉淀”过程中用代替,得到的中不可能混有
13.钙钛矿型化合物是一类可用于生产太阳能电池、传感器等的功能材料,其一种晶胞如图(a)所示,一种具有立方钙钛矿结构的金属卤化物光电材料的组成为和有机碱离子其晶胞如图(b)所示,下列说法错误的是
A.基态的核外电子排布式为
B.图(a)对应钲钓矿型化合物的化学式为
C.图(b)中与图(a)中的空间位置相同
D.图(a)对应化合物中与等距离且最近的有6个
14.测定某溶液中甲醇含量的部分过程如下:
①碱性溶液处理:(末配平,下同)
②酸化处理:
下列说法错误的是
A.“反应①”中氧化剂与还原剂的物质的量之比为
B.“反应①”中氧化性:
C.“反应②”中,可用硫酸进行酸化
D.“反应②”消耗时,反应中转移
三、非选择题(本题包括4小题,共54分。)
15.(14分)铋酸钠是分析化学中的重要试剂,遇沸水或酸则迅速分解。某兴趣小组设计实验制取铋酸钠并探究其应用。回答下列问题:
I.制取铋酸钠制取装置如图(加热和夹持仪器已略去),已知相关物质部分性质如表:
(1)为的发生装置,盛放的玻璃仪器名称是 ;D装置中盛放的液体是 .
(2)中盛放与混合物,与反应生成,反应的离子方程式为 .
(3)当观察到 (填现象)时,可以初步判断中反应已经完成。
(4)反应结束后,为从装置中获得尽可能多的产品,需要进行的操作是 、过滤、洗涤、干燥。
II.铋酸钠的应用——检验
(5)往待测液中加入铋酸钠晶体,加硫酸酸化,溶液变为紫红色,则证明待测液中存在。某同学在较浓的溶液中加入铋酸钠晶体,加硫酸酸化,末观测到溶液出现紫红色,但溶液变浑浊。解释该现象产生的原因: .
III.产品纯度的测定
(6)取上述产品,加入足量稀硫酸和稀溶液使其完全反应,溶液变为紫红色,再用的标准溶液滴定生成的,当溶液紫红色恰好褪去时,消耗标准溶液。该产品中的质量分数为 (用含的代数式表示)。
*16.(14分)工业上以锂辉石为原料生产碳酸锂的部分工业流程如图所示:
已知:(1)锂辉石的主要成分为.其中含少量元素。
(2)(浓)2500C-3000C
(3)某些物质的溶解度(S)如下表所示:
回答下列问题:
(1)从滤流1中分离出的流程如图所示:
写出生成沉淀的离子方程式: 。
(2)已知滤渣2的主要成分有 。
(3)最后一个步骤中,用“热水洗涤”的目的是 。
(4)工业上,将粗品制备成高纯的部分工艺如下:
a.将溶于盐酸作电解槽的阳极液,溶液作阴极液,两者用离子选择性透过膜隔开,用惰性电极电解。
b.电解后向溶液中加入少量溶液并共热,过滤、烘干得高纯。
①中电解时所用的是 (填“阳离子交换膜”或“阴离子交换膜”)。
②电解后,溶液浓度增大的原因是 中生成反应的化学方程式是(5)磷酸亚铁锂电池总反应为,电池中的固体电解质可传导,写出该电池放电时的正极反应: 。
17.(12分)明矶[是一种净水剂,也可以作为中药,有抗菌、收敛、固脱、利胆的作用.硫酸铁铵常用作分析试剂,测定卤素时作指示剂.是一种重要的无机化合物,可作食盐中的补碘剂.
(1)基态硫原子的核外电子排布式为 ,有 个未成对电子.
(2)中 (填“有”或“无”)配位键,的空间构型是 。
(3)氮的同周期元素硼能形成,其分子中的硼原子杂化方式为,前四周期的氧族元素中的两种元素的氢化物分别为,其沸点的高低为,稳定性强弱为,则是 (写元素符号).
(4)晶体是一种性能良好的光学材料,晶胞结构如下图所示,边长为anm,晶胞中分别处于顶角、体心、面心位置.与紧邻的的个数为 .已知阿伏加德罗常数的值为,则的密度为 (列式表示)。
18.(14分)是合成某药物的中间体,以为原料合成的路线如图(部分条件和产物省略):
请回答下列问题:
(1)的化学名称为 。
(2)B有多种同分异构体,其中能同时满足下列条件的芳香族化合物的结构简式为 、 。
①能发生水解反应,不能发生银镜反应;
②核磁共振氢谱有4组峰,峰面积比为1:2:2:3。
(3)的结构简式为 。
(4)由生成的化学方程式为 。
(5)由生成的多步反应中,存在反应,结合合成路线中的相关反应,说明设计该反应的目的为 。
(6)参照上述流程,设计以乙醇为原料合成2-丁醇的合成路线。(无机试剂自选)
化学试题
满分:100分可能用到的原子量:H1 O16 Na23 S32 C135.5 C12 Bi209 Fe56 K39 Mn55 Cu64 I127
一、选择题(本题共10小题,每小题3分,共30分。每小题只有一个正确选项。)
1.化学与生活密切相关。下列叙述正确的是
A.漂白粉与盐酸可混合使用以提高消毒效果
B.温室气体是形成酸雨的主要物质
C.棉花、麻和蚕丝均为碳水化合物
D.干冰可用在舞台上制造“云雾”
2.下列化学用语正确的是
A.二氧化碳的电子式:
B.乙醛的空间填充模型:
C.基态的价电子轨道表示式:
D.反式聚异戊二烯的结构简式:
3.为阿伏加德罗常数的值,下列说法正确的是
A.下,氢气中质子的数目为
B.溶液中,的数目为
C.苯甲酸完全燃烧,生成的数目为
D.电解熔融,阴极增重,外电路中通过电子的数目为
*4.已知有下列三个反应:
①
;
③
下列有关说法正确的是
A.反应①②③中的氧化产物分别是
B.根据以上方程式可以得到氧化性:
C.可以推理得到:
D.在反应(3)中有2个生成,则被还原的为2个
5.时,向某恒温恒容密闭容器中充入等物质的量的和,发生二氧化碳重整甲烷反应:,测得体系中和的物质的量浓度随时间变化如图所示,下列说法错误的是
A.点的坐标为
B.反应进行到时,
C.的平衡转化率约为
D.时,该反应的平衡常数为
6.分子结构修饰在药物设计与合成中有广泛的应用。布洛芬具有抗炎、镇痛、解热作用,但口服该药对胃、肠道有刺激性,可以对该分子进行如图所示的分子修饰。下列说法错误的是
A.甲的分子式为
B.甲分子中最多有8个碳原子共平面
C.甲和乙都能与氢氧化钠溶液发生反应
D.甲修饰成乙可降低对胃、肠道的刺激
7.通过电解废旧锂电池中的可获得难溶性的和,电解示意图如下(其中滤布的作用是阻挡固体颗粒,但离子可自由通过。电解过程中溶液的体积变化忽略不计)。下列说法不正确的是
A.电极为阴极,发生还原反应
B.电极B的电极反应:
C.电解一段时间后溶液中浓度保持不变
D.电解结束,可通过调节除去,再加入溶液以获得
*8.短周期元素原子序数依次递增,最外层电子数:,其中元素形成的化合物(结构式)具有如图所示转化关系。下列说法错误的是
A.简单气态氢化物的稳定性:
B.简单离子半径:
C.的最高价氧化物对应水化物为强酸
D.分别与形成的化合物中均只含离子键
*9.某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。下列分析或结果错误的是
A.原混合酸中物质的量为
B.OA段产生的是段的反应为段产生氢气
C.第二份溶液中最终溶质为
D.浓度为
*10.常温下浓度均为的两种溶液:(1)溶液(2)溶液,下列说法不正确的是
A.水电离产生的:(1)<(2)
B.溶液说明为弱酸
C.两种溶液中均存在:
D.等体积混合所得酸性溶液中:
二、选择题,本题共4小题,每小题4分,共16分。每小题有一个或两个正确选项,全部选对得4分,选对但不全得2分,有选错得0分。)
*11.中国科学家研究在催化剂上还原生成和的路径,各基元反应及活化能如图所示,下列说法错误的是
A.生成的各基元反应中,元素均被还原
B.生成的总反应方程式为
C.在催化剂上,更容易被还原为
D.该过程中涉及极性键、非极性键的断裂和形成
12.以印刷线路板酸性蚀刻废液(含有)为原料制备纳米的流程如图:
下列说法错误的是
A.“沉淀”产生的,不洗涤直接灼烧不影响产品质量
B.“在空气中灼烧”时发生了非氧化还原反应
C.调节为的目的是使完全沉淀,不沉淀
D.“沉淀”过程中用代替,得到的中不可能混有
13.钙钛矿型化合物是一类可用于生产太阳能电池、传感器等的功能材料,其一种晶胞如图(a)所示,一种具有立方钙钛矿结构的金属卤化物光电材料的组成为和有机碱离子其晶胞如图(b)所示,下列说法错误的是
A.基态的核外电子排布式为
B.图(a)对应钲钓矿型化合物的化学式为
C.图(b)中与图(a)中的空间位置相同
D.图(a)对应化合物中与等距离且最近的有6个
14.测定某溶液中甲醇含量的部分过程如下:
①碱性溶液处理:(末配平,下同)
②酸化处理:
下列说法错误的是
A.“反应①”中氧化剂与还原剂的物质的量之比为
B.“反应①”中氧化性:
C.“反应②”中,可用硫酸进行酸化
D.“反应②”消耗时,反应中转移
三、非选择题(本题包括4小题,共54分。)
15.(14分)铋酸钠是分析化学中的重要试剂,遇沸水或酸则迅速分解。某兴趣小组设计实验制取铋酸钠并探究其应用。回答下列问题:
I.制取铋酸钠制取装置如图(加热和夹持仪器已略去),已知相关物质部分性质如表:
(1)为的发生装置,盛放的玻璃仪器名称是 ;D装置中盛放的液体是 .
(2)中盛放与混合物,与反应生成,反应的离子方程式为 .
(3)当观察到 (填现象)时,可以初步判断中反应已经完成。
(4)反应结束后,为从装置中获得尽可能多的产品,需要进行的操作是 、过滤、洗涤、干燥。
II.铋酸钠的应用——检验
(5)往待测液中加入铋酸钠晶体,加硫酸酸化,溶液变为紫红色,则证明待测液中存在。某同学在较浓的溶液中加入铋酸钠晶体,加硫酸酸化,末观测到溶液出现紫红色,但溶液变浑浊。解释该现象产生的原因: .
III.产品纯度的测定
(6)取上述产品,加入足量稀硫酸和稀溶液使其完全反应,溶液变为紫红色,再用的标准溶液滴定生成的,当溶液紫红色恰好褪去时,消耗标准溶液。该产品中的质量分数为 (用含的代数式表示)。
*16.(14分)工业上以锂辉石为原料生产碳酸锂的部分工业流程如图所示:
已知:(1)锂辉石的主要成分为.其中含少量元素。
(2)(浓)2500C-3000C
(3)某些物质的溶解度(S)如下表所示:
回答下列问题:
(1)从滤流1中分离出的流程如图所示:
写出生成沉淀的离子方程式: 。
(2)已知滤渣2的主要成分有 。
(3)最后一个步骤中,用“热水洗涤”的目的是 。
(4)工业上,将粗品制备成高纯的部分工艺如下:
a.将溶于盐酸作电解槽的阳极液,溶液作阴极液,两者用离子选择性透过膜隔开,用惰性电极电解。
b.电解后向溶液中加入少量溶液并共热,过滤、烘干得高纯。
①中电解时所用的是 (填“阳离子交换膜”或“阴离子交换膜”)。
②电解后,溶液浓度增大的原因是 中生成反应的化学方程式是(5)磷酸亚铁锂电池总反应为,电池中的固体电解质可传导,写出该电池放电时的正极反应: 。
17.(12分)明矶[是一种净水剂,也可以作为中药,有抗菌、收敛、固脱、利胆的作用.硫酸铁铵常用作分析试剂,测定卤素时作指示剂.是一种重要的无机化合物,可作食盐中的补碘剂.
(1)基态硫原子的核外电子排布式为 ,有 个未成对电子.
(2)中 (填“有”或“无”)配位键,的空间构型是 。
(3)氮的同周期元素硼能形成,其分子中的硼原子杂化方式为,前四周期的氧族元素中的两种元素的氢化物分别为,其沸点的高低为,稳定性强弱为,则是 (写元素符号).
(4)晶体是一种性能良好的光学材料,晶胞结构如下图所示,边长为anm,晶胞中分别处于顶角、体心、面心位置.与紧邻的的个数为 .已知阿伏加德罗常数的值为,则的密度为 (列式表示)。
18.(14分)是合成某药物的中间体,以为原料合成的路线如图(部分条件和产物省略):
请回答下列问题:
(1)的化学名称为 。
(2)B有多种同分异构体,其中能同时满足下列条件的芳香族化合物的结构简式为 、 。
①能发生水解反应,不能发生银镜反应;
②核磁共振氢谱有4组峰,峰面积比为1:2:2:3。
(3)的结构简式为 。
(4)由生成的化学方程式为 。
(5)由生成的多步反应中,存在反应,结合合成路线中的相关反应,说明设计该反应的目的为 。
(6)参照上述流程,设计以乙醇为原料合成2-丁醇的合成路线。(无机试剂自选)
同课章节目录
