化学人教版(2019)选择性必修1 2.2.2化学平衡常数(共27张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 2.2.2化学平衡常数(共27张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-13 09:51:40 | ||
图片预览






文档简介
(共27张PPT)
第二节 化学平衡
第2课时 化学平衡常数
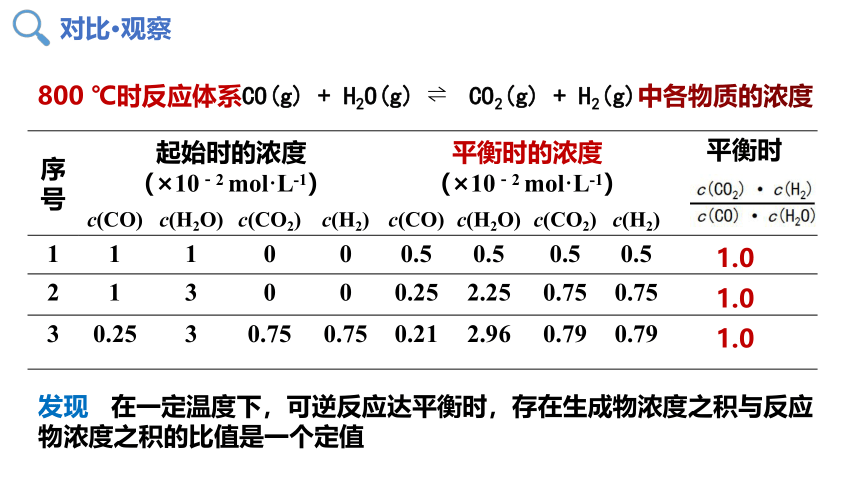
800 ℃时反应体系CO(g) + H2O(g) CO2(g) + H2(g)中各物质的浓度
序号 起始时的浓度 (×10-2 mol·L-1) 平衡时的浓度 (×10-2 mol·L-1) 平衡时
c(CO) c(H2O) c(CO2) c(H2) c(CO) c(H2O) c(CO2) c(H2)
1 1 1 0 0 0.5 0.5 0.5 0.5
2 1 3 0 0 0.25 2.25 0.75 0.75
3 0.25 3 0.75 0.75 0.21 2.96 0.79 0.79
1.0
1.0
1.0
对比 观察
发现 在一定温度下,可逆反应达平衡时,存在生成物浓度之积与反应物浓度之积的比值是一个定值
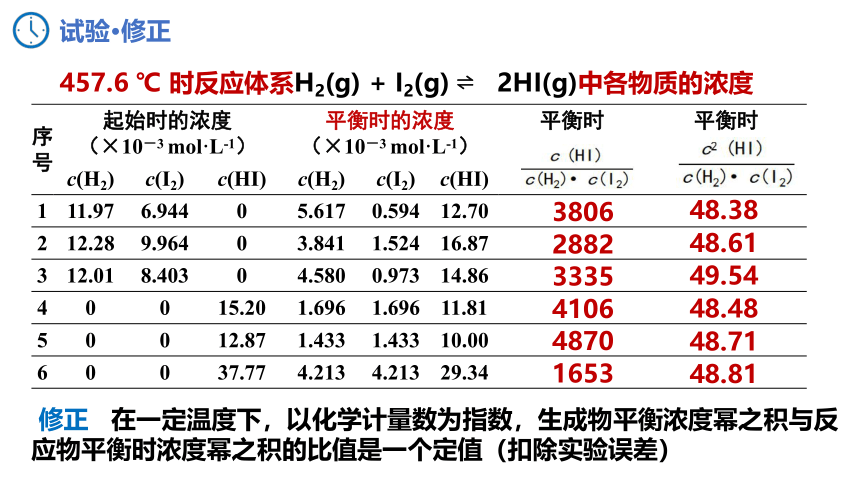
457.6 ℃ 时反应体系H2(g) + I2(g) 2HI(g)中各物质的浓度
序号 起始时的浓度 (×10-3 mol·L-1) 平衡时的浓度 (×10-3 mol·L-1) 平衡时 平衡时
c(H2) c(I2) c(HI) c(H2) c(I2) c(HI)
1 11.97 6.944 0 5.617 0.594 12.70
2 12.28 9.964 0 3.841 1.524 16.87
3 12.01 8.403 0 4.580 0.973 14.86
4 0 0 15.20 1.696 1.696 11.81
5 0 0 12.87 1.433 1.433 10.00
6 0 0 37.77 4.213 4.213 29.34
3806
2882
3335
4106
4870
1653
48.38
48.61
49.54
48.48
48.71
48.81
试验 修正
修正 在一定温度下,以化学计量数为指数,生成物平衡浓度幂之积与反应物平衡时浓度幂之积的比值是一个定值(扣除实验误差)
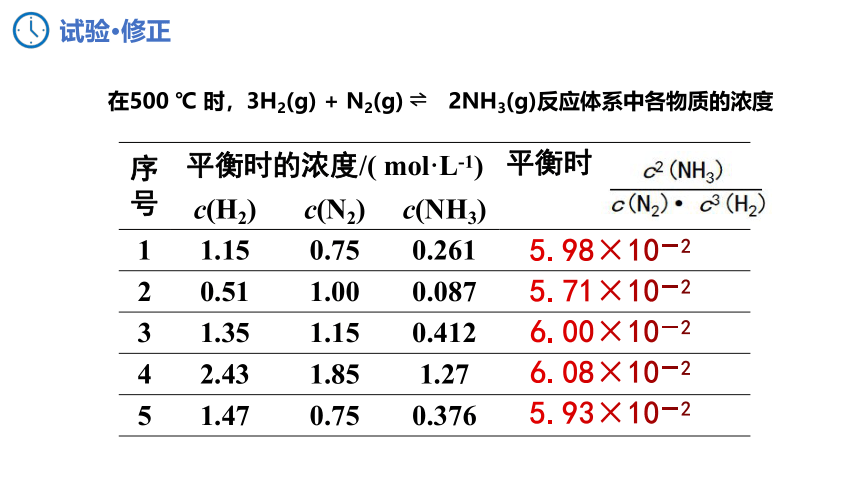
序号 平衡时的浓度/( mol·L-1) 平衡时
c(H2) c(N2) c(NH3)
1 1.15 0.75 0.261
2 0.51 1.00 0.087
3 1.35 1.15 0.412
4 2.43 1.85 1.27
5 1.47 0.75 0.376
6.00×10-2
5.98×10-2
5.71×10-2
5.93×10-2
6.08×10-2
在500 ℃ 时,3H2(g) + N2(g) 2NH3(g)反应体系中各物质的浓度
试验 修正
化学平衡常数
1定 义 在一定温度下,当一个具体的可逆反应达到平衡状态时,生成物的浓度幂之积与反应物浓度幂之积的比值是一个常数,称为化学平衡常数,简称平衡常数,用符号K表示。
2表达式 对于一般的可逆反应
m A(g) + n B(g) p C(g) + q D(g)
在一定温度下达到化学平衡时,
Fe3O4(s) + 4H2(g) 3Fe(s) + 4H2O(g)
)
H
(
c
)
O
H
(
c
2
4
2
4
K
=
CO2(g)+H2(g) CO(g)+H2O(g)
K
=
)
Cr2O72-
(
c
)
CrO42-
(
c
2
)
H+
(
c
2
Cr2O72-(aq) +H2O(l) 2CrO42- (aq) +2H+ (aq)
K
=
C2H5OH (l) +CH3COOH (l) CH3COOC2H5 (l) +H2O (l)
K
=
写出下列可逆反应的平衡常数表达式
(1)固体或纯液体物质的浓度一般不列入表达式中
(2)关于液态水的处理
①在水溶液中进行的反应,水的浓度不列入表达式
②非水溶液中进行的反应,水的浓度须列入表达式
书写化学平衡常数表达式注意事项
1) N2(g)+ 3H2(g) 2NH3(g)
2) 2NH3(g) N2(g)+ 3H2(g)
3) N2(g)+ H2(g) NH3(g)
思考与发现 在同一温度下,K1 、 K2、K3之间是什么关系?
T下的平衡浓度 /( mol·L-1) c(H2) c(N2) c(NH3)
0.1 0.4 0.04
根据表中的数据分别计算K1 、 K2、K3
一定温度下存在下列三个反应
①2NO(g) + O2 (g) 2NO2 (g) ΔH1 K1
②2NO2(g) N2O4 (g) ΔH2 K2
③2NO (g) +O2(g) N2O4 (g) ΔH3 K3
K3 =K1 K2
ΔH1、ΔH2、ΔH3三者关系为:
K1、K2、K3三者关系为:
ΔH3=ΔH1+ΔH2
结论:方程式相加(减),ΔH相加(减),则K相乘(除)
化学方程式与平衡常数K的关系
1)化学方程式改变方向,则平衡常数变为原来的倒数
2)化学计量数变为原来n倍,平衡常数变为原来的n次方
3)方程式相加(减),平衡常数相乘(除)
4)若ΔH=aΔH1+bΔH2 +cΔH3,则有K =
已知下列反应的平衡常数:
①H2(g) + S(s) H2S(g) K1
②S(s) + O2(g) SO2(g) K2
则反应③H2(g) + SO2(g) O2(g) + H2S(g)的平衡常数是( )
A.K1 + K2 B.K1–K2 C.K1×K2 D.K1/K2
D
C (s) + H2O (g) CO (g) + H2 (g) K1
CO (g) +H2O (g) CO2 (g) + H2 (g) K2
C (s) + CO2(g) 2CO(g) K
K = K1/K2
某温度下,已知下列三个反应的平衡常数分别为K1、K2、K,写出平衡常数表达式,找出三者间的关系
H2(g) + I2(g) 2HI(g)不同条件下的平衡常数
序号 起始浓度 (×10-2 mol·L-1) 不同温度下的平衡常数(K )
c(H2) c(I2) c(HI) 457.6 ℃ 425.6 ℃ 25 ℃
1 1.197 0.694 0 48.38 54.51 867
2 1.228 0.996 0 48.61 54.62 867
3 1.201 0.840 0 49.54 54.21 867
4 0 0 1.520 48.48 54.10 867
5 0 0 1.287 48.71 54.42 867
请根据以下资料,分析影响平衡常数的因素。
25 ℃ 时,生成卤化氢反应的平衡常数
请根据以下资料,分析影响平衡常数的因素。
化学方程式 平衡常数 ( K )
F2(g) + H2(g) 2HF(g) 6.5 ×1095
Cl2(g) + H2(g) 2HCl(g) 2.57 ×1033
Br2(g) + H2(g) 2HBr(g) 1.91 ×1019
I2(g) + H2(g) 2HI(g) 8.67 ×102
对于一个确定的可逆反应来说,平衡常数K只受温度影响。
3影响平衡常数的因素
反应 温度 平衡常数K
相同 相同 相同
相同 不同 不同
25 ℃ 时,生成卤化氢反应的平衡常数
化学方程式 平衡常数 ( K )
F2(g) + H2(g) 2HF(g) 6.5 ×1095
Cl2(g) + H2(g) 2HCl(g) 2.57 ×1033
Br2(g) + H2(g) 2HBr(g) 1.91 ×1019
I2(g) + H2(g) 2HI(g) 8.67 ×102
结合平衡常数的表达式思考,K 的大小表示什么含义?
平衡常数的大小反映了化学反应进行的程度。K值越大,正反应进行的程度越大,即该反应进行得越完全,平衡时反应物的转化率越高;反之则转化率越低。
一般来说 当K时,该反应就进行得基本完全;当K<时,反应很难进行。
4意义
应用1).判断反应的热效应
5化学平衡常数的应用
反应 温度 平衡常数K 的关系 正反应焓变特征
相同 升高 增大 正相关 正值 ΔH>0
降低 减小 正
升高 减小 负相关 负值 ΔH<0
降低 增大 负
根据温度与平衡常数的关系,分别判断①、 ②的热效应
温度 K1 K2
973K 1.47 2.38
1173K 2.15 1.67
已知
化学反应①:Fe(s)+CO2(g) FeO(s)+CO(g), K1;
化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g), K2,
在温度973K和1173K的情况下,平衡常数K1、K2的值分别如下
ΔH1>0
ΔH2<0
浓度商:
mA(g) + nB(g) pC(g) + qD(g)
cp(C)·cq(D)
cm(A)·cn(B)
Q=
任何可逆反应的终极目标是使 Q=K
任意时刻下的浓度
由浓度决定
应用2).判断反应进行的方向
5化学平衡常数的应用
cp(C)·cq(D)
cm(A)·cn(B)
K =
平衡状态下的浓度
由温度决定
平衡常数:
对一定温度T下的可逆反应mA(g) + nB(g) pC(g) + qD(g)
任何可逆反应的终极目标是使 Q=K
Q
K
t1
t
v逆
v正 = v逆
v正
对一定温度T下的可逆反应mA(g) + nB(g) pC(g) + qD(g)
任何可逆反应的终极目标是使 Q=K
Q
K
t2
t
v逆
v正 = v逆
v正
t2
t
序号 Q与K v正 与 v逆 反应进行的方向 变量
Ⅰ Q<K v正 > v逆 向正反应方向进行 在变
Ⅱ Q = K v正 = v逆 反应达到平衡状态 不变
Ⅲ Q >K v正 < v逆 向逆反应方向进行 在变
具体方法如下
序号 CO (mol/L) H2O (mol/L) CO2 (mol/L) H2 (mol/L) Q与K关系及反应进行的方向
1 0.3 0.5 0.4 0.4
2 1.0 0.3 0.5 0.6
3 0.8 1.6 0.7 1.7
已知800℃时,化学反应CO(g) + H2O(g) CO2(g)+ H2(g) K = 1
推导在下列浓度下反应进行的方向
Q>K ,逆
Q=K ,平衡状态
Q<K ,正
附 基本计算关系式
1)反应物的转化率 =
2)生成物的产率=
3)B气体的体积分数=B的
4)B气体的分压=气体的总压 B的
5)PV=nRT
化学平衡常数概要
考查角度 难易程度
1)书写平衡常数表达式 易
2)影响平衡常数的因素 易
3)利用K与T的关系判断反应的热效应 中
4)利用K与Q的关系判断反应进行的方向 中
5)平衡常数K的综合计算 难
对未来的真正慷慨,是把一切都献给现在
第二节 化学平衡
第2课时 化学平衡常数
800 ℃时反应体系CO(g) + H2O(g) CO2(g) + H2(g)中各物质的浓度
序号 起始时的浓度 (×10-2 mol·L-1) 平衡时的浓度 (×10-2 mol·L-1) 平衡时
c(CO) c(H2O) c(CO2) c(H2) c(CO) c(H2O) c(CO2) c(H2)
1 1 1 0 0 0.5 0.5 0.5 0.5
2 1 3 0 0 0.25 2.25 0.75 0.75
3 0.25 3 0.75 0.75 0.21 2.96 0.79 0.79
1.0
1.0
1.0
对比 观察
发现 在一定温度下,可逆反应达平衡时,存在生成物浓度之积与反应物浓度之积的比值是一个定值
457.6 ℃ 时反应体系H2(g) + I2(g) 2HI(g)中各物质的浓度
序号 起始时的浓度 (×10-3 mol·L-1) 平衡时的浓度 (×10-3 mol·L-1) 平衡时 平衡时
c(H2) c(I2) c(HI) c(H2) c(I2) c(HI)
1 11.97 6.944 0 5.617 0.594 12.70
2 12.28 9.964 0 3.841 1.524 16.87
3 12.01 8.403 0 4.580 0.973 14.86
4 0 0 15.20 1.696 1.696 11.81
5 0 0 12.87 1.433 1.433 10.00
6 0 0 37.77 4.213 4.213 29.34
3806
2882
3335
4106
4870
1653
48.38
48.61
49.54
48.48
48.71
48.81
试验 修正
修正 在一定温度下,以化学计量数为指数,生成物平衡浓度幂之积与反应物平衡时浓度幂之积的比值是一个定值(扣除实验误差)
序号 平衡时的浓度/( mol·L-1) 平衡时
c(H2) c(N2) c(NH3)
1 1.15 0.75 0.261
2 0.51 1.00 0.087
3 1.35 1.15 0.412
4 2.43 1.85 1.27
5 1.47 0.75 0.376
6.00×10-2
5.98×10-2
5.71×10-2
5.93×10-2
6.08×10-2
在500 ℃ 时,3H2(g) + N2(g) 2NH3(g)反应体系中各物质的浓度
试验 修正
化学平衡常数
1定 义 在一定温度下,当一个具体的可逆反应达到平衡状态时,生成物的浓度幂之积与反应物浓度幂之积的比值是一个常数,称为化学平衡常数,简称平衡常数,用符号K表示。
2表达式 对于一般的可逆反应
m A(g) + n B(g) p C(g) + q D(g)
在一定温度下达到化学平衡时,
Fe3O4(s) + 4H2(g) 3Fe(s) + 4H2O(g)
)
H
(
c
)
O
H
(
c
2
4
2
4
K
=
CO2(g)+H2(g) CO(g)+H2O(g)
K
=
)
Cr2O72-
(
c
)
CrO42-
(
c
2
)
H+
(
c
2
Cr2O72-(aq) +H2O(l) 2CrO42- (aq) +2H+ (aq)
K
=
C2H5OH (l) +CH3COOH (l) CH3COOC2H5 (l) +H2O (l)
K
=
写出下列可逆反应的平衡常数表达式
(1)固体或纯液体物质的浓度一般不列入表达式中
(2)关于液态水的处理
①在水溶液中进行的反应,水的浓度不列入表达式
②非水溶液中进行的反应,水的浓度须列入表达式
书写化学平衡常数表达式注意事项
1) N2(g)+ 3H2(g) 2NH3(g)
2) 2NH3(g) N2(g)+ 3H2(g)
3) N2(g)+ H2(g) NH3(g)
思考与发现 在同一温度下,K1 、 K2、K3之间是什么关系?
T下的平衡浓度 /( mol·L-1) c(H2) c(N2) c(NH3)
0.1 0.4 0.04
根据表中的数据分别计算K1 、 K2、K3
一定温度下存在下列三个反应
①2NO(g) + O2 (g) 2NO2 (g) ΔH1 K1
②2NO2(g) N2O4 (g) ΔH2 K2
③2NO (g) +O2(g) N2O4 (g) ΔH3 K3
K3 =K1 K2
ΔH1、ΔH2、ΔH3三者关系为:
K1、K2、K3三者关系为:
ΔH3=ΔH1+ΔH2
结论:方程式相加(减),ΔH相加(减),则K相乘(除)
化学方程式与平衡常数K的关系
1)化学方程式改变方向,则平衡常数变为原来的倒数
2)化学计量数变为原来n倍,平衡常数变为原来的n次方
3)方程式相加(减),平衡常数相乘(除)
4)若ΔH=aΔH1+bΔH2 +cΔH3,则有K =
已知下列反应的平衡常数:
①H2(g) + S(s) H2S(g) K1
②S(s) + O2(g) SO2(g) K2
则反应③H2(g) + SO2(g) O2(g) + H2S(g)的平衡常数是( )
A.K1 + K2 B.K1–K2 C.K1×K2 D.K1/K2
D
C (s) + H2O (g) CO (g) + H2 (g) K1
CO (g) +H2O (g) CO2 (g) + H2 (g) K2
C (s) + CO2(g) 2CO(g) K
K = K1/K2
某温度下,已知下列三个反应的平衡常数分别为K1、K2、K,写出平衡常数表达式,找出三者间的关系
H2(g) + I2(g) 2HI(g)不同条件下的平衡常数
序号 起始浓度 (×10-2 mol·L-1) 不同温度下的平衡常数(K )
c(H2) c(I2) c(HI) 457.6 ℃ 425.6 ℃ 25 ℃
1 1.197 0.694 0 48.38 54.51 867
2 1.228 0.996 0 48.61 54.62 867
3 1.201 0.840 0 49.54 54.21 867
4 0 0 1.520 48.48 54.10 867
5 0 0 1.287 48.71 54.42 867
请根据以下资料,分析影响平衡常数的因素。
25 ℃ 时,生成卤化氢反应的平衡常数
请根据以下资料,分析影响平衡常数的因素。
化学方程式 平衡常数 ( K )
F2(g) + H2(g) 2HF(g) 6.5 ×1095
Cl2(g) + H2(g) 2HCl(g) 2.57 ×1033
Br2(g) + H2(g) 2HBr(g) 1.91 ×1019
I2(g) + H2(g) 2HI(g) 8.67 ×102
对于一个确定的可逆反应来说,平衡常数K只受温度影响。
3影响平衡常数的因素
反应 温度 平衡常数K
相同 相同 相同
相同 不同 不同
25 ℃ 时,生成卤化氢反应的平衡常数
化学方程式 平衡常数 ( K )
F2(g) + H2(g) 2HF(g) 6.5 ×1095
Cl2(g) + H2(g) 2HCl(g) 2.57 ×1033
Br2(g) + H2(g) 2HBr(g) 1.91 ×1019
I2(g) + H2(g) 2HI(g) 8.67 ×102
结合平衡常数的表达式思考,K 的大小表示什么含义?
平衡常数的大小反映了化学反应进行的程度。K值越大,正反应进行的程度越大,即该反应进行得越完全,平衡时反应物的转化率越高;反之则转化率越低。
一般来说 当K时,该反应就进行得基本完全;当K<时,反应很难进行。
4意义
应用1).判断反应的热效应
5化学平衡常数的应用
反应 温度 平衡常数K 的关系 正反应焓变特征
相同 升高 增大 正相关 正值 ΔH>0
降低 减小 正
升高 减小 负相关 负值 ΔH<0
降低 增大 负
根据温度与平衡常数的关系,分别判断①、 ②的热效应
温度 K1 K2
973K 1.47 2.38
1173K 2.15 1.67
已知
化学反应①:Fe(s)+CO2(g) FeO(s)+CO(g), K1;
化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g), K2,
在温度973K和1173K的情况下,平衡常数K1、K2的值分别如下
ΔH1>0
ΔH2<0
浓度商:
mA(g) + nB(g) pC(g) + qD(g)
cp(C)·cq(D)
cm(A)·cn(B)
Q=
任何可逆反应的终极目标是使 Q=K
任意时刻下的浓度
由浓度决定
应用2).判断反应进行的方向
5化学平衡常数的应用
cp(C)·cq(D)
cm(A)·cn(B)
K =
平衡状态下的浓度
由温度决定
平衡常数:
对一定温度T下的可逆反应mA(g) + nB(g) pC(g) + qD(g)
任何可逆反应的终极目标是使 Q=K
Q
K
t1
t
v逆
v正 = v逆
v正
对一定温度T下的可逆反应mA(g) + nB(g) pC(g) + qD(g)
任何可逆反应的终极目标是使 Q=K
Q
K
t2
t
v逆
v正 = v逆
v正
t2
t
序号 Q与K v正 与 v逆 反应进行的方向 变量
Ⅰ Q<K v正 > v逆 向正反应方向进行 在变
Ⅱ Q = K v正 = v逆 反应达到平衡状态 不变
Ⅲ Q >K v正 < v逆 向逆反应方向进行 在变
具体方法如下
序号 CO (mol/L) H2O (mol/L) CO2 (mol/L) H2 (mol/L) Q与K关系及反应进行的方向
1 0.3 0.5 0.4 0.4
2 1.0 0.3 0.5 0.6
3 0.8 1.6 0.7 1.7
已知800℃时,化学反应CO(g) + H2O(g) CO2(g)+ H2(g) K = 1
推导在下列浓度下反应进行的方向
Q>K ,逆
Q=K ,平衡状态
Q<K ,正
附 基本计算关系式
1)反应物的转化率 =
2)生成物的产率=
3)B气体的体积分数=B的
4)B气体的分压=气体的总压 B的
5)PV=nRT
化学平衡常数概要
考查角度 难易程度
1)书写平衡常数表达式 易
2)影响平衡常数的因素 易
3)利用K与T的关系判断反应的热效应 中
4)利用K与Q的关系判断反应进行的方向 中
5)平衡常数K的综合计算 难
对未来的真正慷慨,是把一切都献给现在
