1.5.2 物质在水中的溶解 课件(21张PPT)
文档属性
| 名称 | 1.5.2 物质在水中的溶解 课件(21张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 35.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-10-10 14:41:51 | ||
图片预览







文档简介
(共21张PPT)
1.5.2物质在水中的溶解
物质的溶解能力越强,
溶解性越强,
一定量的溶剂里溶解的数量越多
一定的温度下,一定量的溶剂里溶解的数量越多,
物质的溶解能力越强,
溶解性越强。
物质的溶解能力
定性:
定量:
溶解性
溶解度
如何比较不同物质的溶解能力?
条件要相同
①一定的温度下,②一定量的溶剂里
比较最多能溶解溶质的数量
(溶解到不能再溶解为止)
溶液达到饱和了
饱和溶液、不饱和溶液的区别?
溶解溶质的质量
补充:条件不能漏。
某一温度下,某种物质的饱和溶液
如20℃食盐的饱和溶液
如容器底部没有晶体,是否一定不饱和?
可能恰好饱和
也可能不饱和
20℃,食盐的饱和溶液,能溶解白糖吗?
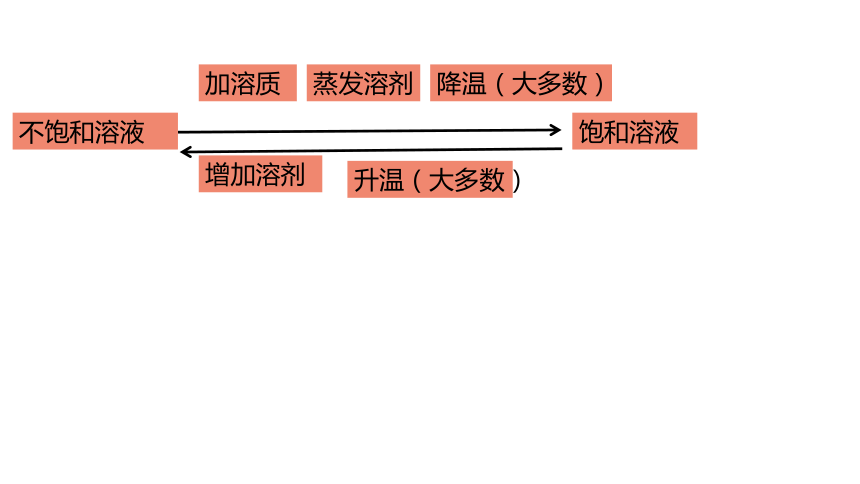
饱和溶液
不饱和溶液
加溶质
蒸发溶剂
降温(大多数)
增加溶剂
升温(大多数)
不饱和溶液
饱和溶液
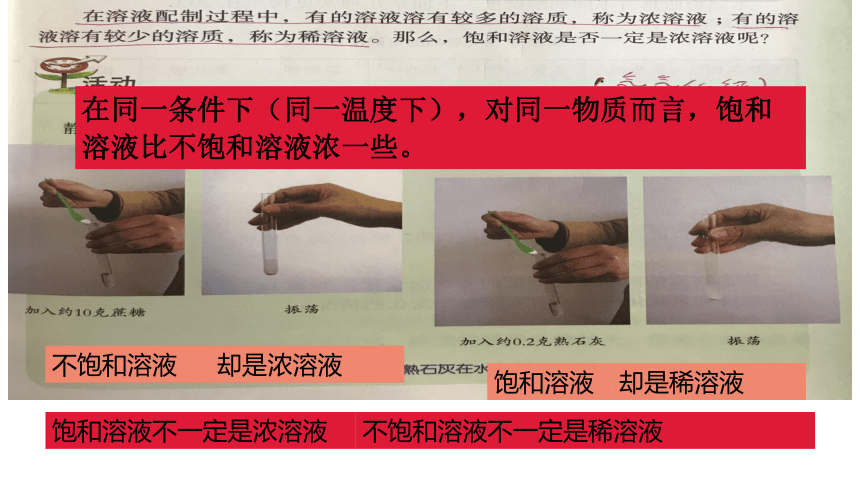
却是浓溶液
却是稀溶液
饱和溶液不一定是浓溶液
不饱和溶液不一定是稀溶液
在同一条件下(同一温度下),对同一物质而言,饱和溶液比不饱和溶液浓一些。
溶解度:
在一定的温度下,某物质在100 克溶剂中达到饱和状态时所溶解的溶质质量,为该物质在这种溶剂里的溶解度。
20℃时,氯化钠的溶解度为36克。意义:
20℃时,氯化钠在100克水中达到饱和状态时所溶解的质量为36克。
或者 20℃时,100克水中最多能溶解氯化钠36克。
补充:某一温度下,某种物质的溶解度
溶解度
一定的温度
100克溶剂
达到饱和
溶质的质量
(溶解度与温度有关)
(单位为克)
溶解度是表示特定条件下(一定温度、100克溶剂、饱和状态时)所溶解溶质的质量。
物质的溶解性等级
易 溶
可 溶
微 溶
难 溶
> 10克
1-10克
0.01-1克
< 0.01克
氢氧化钙
(20℃时的溶解度)
影响溶解度的因素
外因:
温度
硝酸钾的溶解度随着温度的升高而增大,且受温度影响程度较大。
氢氧化钙的溶解度随着温度的升高而减小。
水中溶解有空气,当温度升高,气体的溶解度减小,一部分气体从水中逸出
大多数固体物质的溶解度都随着温度的升高而增大。
少数物质溶解度随着温度的升高而减小,如氢氧化钙、气体
在夏季闷热的天气中,鱼塘里的鱼常将鱼头浮出水面。你知道这是为什么吗?
气体物质的溶解度随温度的升高而减小,随气压的降低而减小。
所以,鱼塘里用增氧机来提高水中的含氧量!
溶解度曲线:
溶解度随温度变化而变化的曲线。
③曲线上每个点表示某物质在该温度下的溶解度。所配制的溶液是该温度下的饱和溶液。
① 不同曲线表示不同物质的溶解度受温度的影响大小的情况。大多数固体物质的溶解度都随着温度的升高而增大。
②两条曲线相交点表示在此温度下两种物质的溶解度相等。
硝酸钾的溶解度随着温度的升高而增大,且受温度影响程度较大。
氢氧化钙
m质= m溶液×P%
m溶液=
m质
P%
根据溶解度S可以求饱和时的质量分数:
溶解度越小,饱和时的质量分数越小
溶解度S和质量分数P%的意义比较
溶解度S:
100克溶剂中含有溶质S克
质量分数P%:
100克溶液中含有溶质P克
质量分数变化的判断
①恒温下蒸发不饱和溶液
从不饱和到恰好饱和:
变大
溶质:
溶剂:
不变
减小
从饱和到过饱和:
不变
溶质:
减小
溶剂:
减小
(原因:都是该温度下的饱和溶液,溶解度不变,饱和时的质量分数不变)
先变大后不变
②降低不饱和溶液温度
从不饱和到恰好饱和:
不变
溶质:
不变
溶剂:
不变
从饱和到过饱和:
变小
溶质:
减小
溶剂:
不变
(或原因:温度下降,还是饱和溶液,是低温下的饱和溶液,溶解度减小,饱和时的质量分数减小)
先不变后变小
④升高饱和溶液的温度(不考虑蒸发)
不变
③增加不饱和溶液的溶质:
先增加后不变
变小
⑤加溶剂(水)
溶液的配置步骤
计算
称量
天平
量筒和滴管
不一定
一定
溶解
玻璃棒
烧杯
装瓶、贴上标签
1.5.2物质在水中的溶解
物质的溶解能力越强,
溶解性越强,
一定量的溶剂里溶解的数量越多
一定的温度下,一定量的溶剂里溶解的数量越多,
物质的溶解能力越强,
溶解性越强。
物质的溶解能力
定性:
定量:
溶解性
溶解度
如何比较不同物质的溶解能力?
条件要相同
①一定的温度下,②一定量的溶剂里
比较最多能溶解溶质的数量
(溶解到不能再溶解为止)
溶液达到饱和了
饱和溶液、不饱和溶液的区别?
溶解溶质的质量
补充:条件不能漏。
某一温度下,某种物质的饱和溶液
如20℃食盐的饱和溶液
如容器底部没有晶体,是否一定不饱和?
可能恰好饱和
也可能不饱和
20℃,食盐的饱和溶液,能溶解白糖吗?
饱和溶液
不饱和溶液
加溶质
蒸发溶剂
降温(大多数)
增加溶剂
升温(大多数)
不饱和溶液
饱和溶液
却是浓溶液
却是稀溶液
饱和溶液不一定是浓溶液
不饱和溶液不一定是稀溶液
在同一条件下(同一温度下),对同一物质而言,饱和溶液比不饱和溶液浓一些。
溶解度:
在一定的温度下,某物质在100 克溶剂中达到饱和状态时所溶解的溶质质量,为该物质在这种溶剂里的溶解度。
20℃时,氯化钠的溶解度为36克。意义:
20℃时,氯化钠在100克水中达到饱和状态时所溶解的质量为36克。
或者 20℃时,100克水中最多能溶解氯化钠36克。
补充:某一温度下,某种物质的溶解度
溶解度
一定的温度
100克溶剂
达到饱和
溶质的质量
(溶解度与温度有关)
(单位为克)
溶解度是表示特定条件下(一定温度、100克溶剂、饱和状态时)所溶解溶质的质量。
物质的溶解性等级
易 溶
可 溶
微 溶
难 溶
> 10克
1-10克
0.01-1克
< 0.01克
氢氧化钙
(20℃时的溶解度)
影响溶解度的因素
外因:
温度
硝酸钾的溶解度随着温度的升高而增大,且受温度影响程度较大。
氢氧化钙的溶解度随着温度的升高而减小。
水中溶解有空气,当温度升高,气体的溶解度减小,一部分气体从水中逸出
大多数固体物质的溶解度都随着温度的升高而增大。
少数物质溶解度随着温度的升高而减小,如氢氧化钙、气体
在夏季闷热的天气中,鱼塘里的鱼常将鱼头浮出水面。你知道这是为什么吗?
气体物质的溶解度随温度的升高而减小,随气压的降低而减小。
所以,鱼塘里用增氧机来提高水中的含氧量!
溶解度曲线:
溶解度随温度变化而变化的曲线。
③曲线上每个点表示某物质在该温度下的溶解度。所配制的溶液是该温度下的饱和溶液。
① 不同曲线表示不同物质的溶解度受温度的影响大小的情况。大多数固体物质的溶解度都随着温度的升高而增大。
②两条曲线相交点表示在此温度下两种物质的溶解度相等。
硝酸钾的溶解度随着温度的升高而增大,且受温度影响程度较大。
氢氧化钙
m质= m溶液×P%
m溶液=
m质
P%
根据溶解度S可以求饱和时的质量分数:
溶解度越小,饱和时的质量分数越小
溶解度S和质量分数P%的意义比较
溶解度S:
100克溶剂中含有溶质S克
质量分数P%:
100克溶液中含有溶质P克
质量分数变化的判断
①恒温下蒸发不饱和溶液
从不饱和到恰好饱和:
变大
溶质:
溶剂:
不变
减小
从饱和到过饱和:
不变
溶质:
减小
溶剂:
减小
(原因:都是该温度下的饱和溶液,溶解度不变,饱和时的质量分数不变)
先变大后不变
②降低不饱和溶液温度
从不饱和到恰好饱和:
不变
溶质:
不变
溶剂:
不变
从饱和到过饱和:
变小
溶质:
减小
溶剂:
不变
(或原因:温度下降,还是饱和溶液,是低温下的饱和溶液,溶解度减小,饱和时的质量分数减小)
先不变后变小
④升高饱和溶液的温度(不考虑蒸发)
不变
③增加不饱和溶液的溶质:
先增加后不变
变小
⑤加溶剂(水)
溶液的配置步骤
计算
称量
天平
量筒和滴管
不一定
一定
溶解
玻璃棒
烧杯
装瓶、贴上标签
同课章节目录
- 第1章 水和水的溶液
- 第1节 地球上的水
- 第2节 水的组成
- 第3节 水的浮力
- 第4节 物质在水中的分散状况
- 第5节 物质的溶解
- 第6节 物质的分离
- 第7节 水资源的利用、开发和保护
- 第2章 天气与气候
- 第1节 大气层
- 第2节 气温
- 第3节 大气的压强
- 第4节 风和降水
- 第5节 天气预报
- 第6节 气候和影响气候的因素
- 第7节 我国的气候特征与主要气象灾害
- 第3章 生命活动的调节
- 第1节 植物生命活动的调节
- 第2节 人体的激素调节
- 第3节 神经调节
- 第4节 动物的行为
- 第5节 体温的控制
- 第4章 电路探秘
- 第1节 电荷与电流
- 第2节 电流的测量
- 第3节 物质的导电性与电阻
- 第4节 变阻器
- 第5节 电压的测量
- 第6节 电流与电压、电阻的关系
- 第7节 电路分析与应用
- 研究性学习课题
- 一 测定本地区的“酸雨”情况及分析原因
- 二 太阳黑子活动与本地区降水的关系
- 三 训练小动物建立某种条件反射
- 四 调查在自然界或生命活动中的电现象
