化学人教版(2019)必修第一册2.1.1.钠(共20张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.1.1.钠(共20张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 7.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-12 13:58:37 | ||
图片预览








文档简介
(共20张PPT)
金属钠及其化合物
钠(第一课时)
一化学核心素养
1知识目标:
了解钠的物理性质,
掌握钠的重要化学性质
2过程与方法
演示实验与分组实验相结合
小组合作学习与分组讨论相结合
培养学生科学严谨的探究精神
3情感态度与价值观
培养学生正确的价值观与爱国主义情怀
【本堂课要达到的目的】
1让学生掌握钠的重要物理化学性质
2培养学生实验动手的操作能力和实验的安全意识
3培养学生团队协作能力和观察探究能力
4培养学生主动思考学习的能力和对知识的科学探究的思维
5培养学生的爱国情怀,实现科技兴国的目标
【新课导入】同学们了解哪些含钠元素的物质呢?它们在生产生活中有哪些用途呢?
【阅读美心】钠元素在自然界中的含量挺多的,尤其是海水中含有大量的氯化钠。人和动物身体都需要一定的盐分,如果缺盐会出现食欲不振,浑身发软,没有力气。所以要摄入适量盐分,但是不能过多,多了对身体仍然有害。
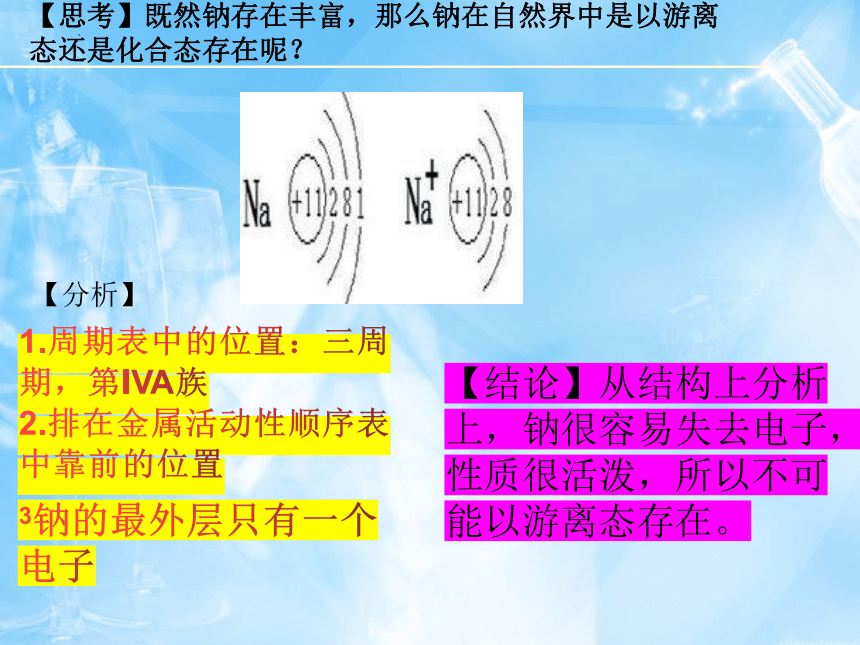
【思考】既然钠存在丰富,那么钠在自然界中是以游离态还是化合态存在呢?
【分析】
1.周期表中的位置:三周期,第IVA族
2.排在金属活动性顺序表中靠前的位置
3钠的最外层只有一个电子
【结论】从结构上分析上,钠很容易失去电子,性质很活泼,所以不可能以游离态存在。
【上图片】
【分组讨论】单质钠如何制得?
2NaCl(熔融)=2Na+Cl ↑
电解
【分组讨论】思考能不能用电解饱和食盐水,或者象炼铁的方法用CO还原来制取钠单质?
【归纳整理】1通过预习知道钠会与水反应,所以在水溶液中是不可能得到钠单质的。
2用CO还原铁是利用了(自发)氧化还原反应是强制弱的规律,而钠本身还原性很强,所以不能用热还原法制得钠单质。只能用电解法(最强有力的氧化还原反应,没有之一,能使非自发的氧化还原反应发生)
钠的性质
观看视频
【学生分组讨论】实验现象和原因
【分组实验】钠与水的反应
【实验操作】
1,用镊子从煤油中取出一块钠
2,用滤纸擦干表面的煤油----Na是保存在煤油中的,思考:为什么
3.用小刀切出绿豆大小(剩余的放回原瓶)注意其他试剂剩余的是不能放回去的---钠软,硬度小
4.将钠投入到有水的烧杯中(加入酚酞)
【特别注意】该部分的实验有一定的危险性,一定要注意安全。
【现象】浮、游、熔、响、(红)
【结论】1钠的密度比水小,且硬度小
2钠与水反应放热,且钠的熔点低,所以能熔化。
3钠与水反应很剧烈,且反应产生了气体
4钠和水反应生成了碱性物质
?
【归纳整理】
钠的物理性质:钠是一种银白色的金属,熔点低,质软。密度比水小。
一钠与水的反应
现象:浮 游 熔 响 红
反应原理:2Na+2H2O =2NaOH+H2↑
【学生实践】离子方程式:2Na+2H2O =2Na++2OH-+H2↑
钠的化学性质
【分组讨论】1如果钠着火了,能不能用水来灭火?
2如果把钠投入到水和煤油的混合物中会有什么现象?
装置示意图
【分组实验并讨论】注意观察现象和钠直接与水反应有什么不同?思考原因是什么?
【归纳现象】:钠会沉到水和煤油的分界线,反应放氢气使钠往上升,然后又掉下来,再上升。
【教师指引】
原因;密度:水>钠>煤油。故钠会沉到水和煤油的分界线,反应放氢气产生向上的作用力使钠往上升,脱离水后没有气体产生,钠在自身重力作用下然后又掉下来,再上升。
【学生困惑探究】实际操作中钠有时候掉不下来,原因是什么?
【分组讨论】总结各组观点,发现有同学观察仔细,发现掉不下来的钠是因为其表面附着许多气泡使其浮力增加故进入煤油层后没有掉下来。
【学生分组实验】:
钠与硫酸铜反应。
操作:将一小块钠投入硫酸铜中
现象:钠熔化成一个闪亮的小球,浮在硫酸铜溶液的表面,快速游动,发出嘶嘶的响声
蓝色溶液中出现蓝色沉淀,且底部有少量黑色的物质
知道学生分析钠与水和硫酸铜反应的现象相同点和不同点的原因。
【总结】钠在溶液中的反应;有酸酸在前,无酸水在前,所以钠与硫酸铜反应,是先与水反应生成氢氧化钠,氢氧化钠再与硫酸铜发生复分解反应。
【反应原理】2Na+2H2O= 2NaOH+H2↑
2NaOH+CuSO4 =Cu(OH)2↓+Na2SO4
总反应:2Na+2H2O+CuSO4=Cu(OH)2+Na2SO4+H2↑
离子方程式: 2Na+2H2O+Cu2+=Cu(OH)2+2Na++H2 ↑
【思考】钠为什么要保存在煤油中?
【观察】金属钠的表面有一层灰白色的物质,说明钠在空气中很容易被氧化。所以为了防止钠被氧化将钠保存在煤油中
【思考】?为什么可以用煤油保存钠?
【分析】钠的密度比煤油大且不与煤油反应)所以可以保存在煤油中。
二钠与氧气反应
1常温下:4Na+O2=2Na2O
观察现象:钠的表面有一层灰白色的物质。
2.加热条件下
【演示实验】
【操作】用坩埚钳夹取一小块钠放入加热后的坩埚中
【现象】钠熔化,再燃烧,发出黄色的火焰,生成淡黄色固体
【分组讨论】为什么要将坩埚加热后再放入钠?
【结论】防止钠在温度较低时发生副反应
反应原理:2Na+O2=Na2O2
加热
三 钠与氯气反应
2Na+CI2=2NaCI
【现象】剧烈燃烧,黄色火焰,大量白烟
点燃
【分组讨论】
钠着火能否用二氧化碳或水灭火。
原因:钠的化学性质很活泼,与水或二氧化碳都能剧烈反应甚至燃烧,所以钠着火不能用水或二氧化碳灭火。可以用沙子灭火
【课堂练习 高温
1 TiCl4+4Na = Ti+4NaCl(高温下制取钛)
该反应利用的是钠的什么性质?氧化剂和还原剂的物质的量之比为?
2 把0.3mol的钠、镁、铝分别投入1mol/L、100ml的盐酸溶液中,产生气体的物质的量之比为( )
A 3:2: 1 B 3: 3: 1 C 3: 1: 1 D 6: 3: 2
【归纳整理】
1学习钠的意义:活泼金属的典型代表
2通过以上分析得知,钠不能像其他的活泼金属把不活泼的金属从它的盐溶液中置换出来,那么在非水的情况下呢?
3通过本节课的学习掌握钠与氧化性单质以及水的反应,在这些反应中钠都是做还原剂。说明金属钠的用途可以用来还原某些金属(不能在水溶液中)
金属钠及其化合物
钠(第一课时)
一化学核心素养
1知识目标:
了解钠的物理性质,
掌握钠的重要化学性质
2过程与方法
演示实验与分组实验相结合
小组合作学习与分组讨论相结合
培养学生科学严谨的探究精神
3情感态度与价值观
培养学生正确的价值观与爱国主义情怀
【本堂课要达到的目的】
1让学生掌握钠的重要物理化学性质
2培养学生实验动手的操作能力和实验的安全意识
3培养学生团队协作能力和观察探究能力
4培养学生主动思考学习的能力和对知识的科学探究的思维
5培养学生的爱国情怀,实现科技兴国的目标
【新课导入】同学们了解哪些含钠元素的物质呢?它们在生产生活中有哪些用途呢?
【阅读美心】钠元素在自然界中的含量挺多的,尤其是海水中含有大量的氯化钠。人和动物身体都需要一定的盐分,如果缺盐会出现食欲不振,浑身发软,没有力气。所以要摄入适量盐分,但是不能过多,多了对身体仍然有害。
【思考】既然钠存在丰富,那么钠在自然界中是以游离态还是化合态存在呢?
【分析】
1.周期表中的位置:三周期,第IVA族
2.排在金属活动性顺序表中靠前的位置
3钠的最外层只有一个电子
【结论】从结构上分析上,钠很容易失去电子,性质很活泼,所以不可能以游离态存在。
【上图片】
【分组讨论】单质钠如何制得?
2NaCl(熔融)=2Na+Cl ↑
电解
【分组讨论】思考能不能用电解饱和食盐水,或者象炼铁的方法用CO还原来制取钠单质?
【归纳整理】1通过预习知道钠会与水反应,所以在水溶液中是不可能得到钠单质的。
2用CO还原铁是利用了(自发)氧化还原反应是强制弱的规律,而钠本身还原性很强,所以不能用热还原法制得钠单质。只能用电解法(最强有力的氧化还原反应,没有之一,能使非自发的氧化还原反应发生)
钠的性质
观看视频
【学生分组讨论】实验现象和原因
【分组实验】钠与水的反应
【实验操作】
1,用镊子从煤油中取出一块钠
2,用滤纸擦干表面的煤油----Na是保存在煤油中的,思考:为什么
3.用小刀切出绿豆大小(剩余的放回原瓶)注意其他试剂剩余的是不能放回去的---钠软,硬度小
4.将钠投入到有水的烧杯中(加入酚酞)
【特别注意】该部分的实验有一定的危险性,一定要注意安全。
【现象】浮、游、熔、响、(红)
【结论】1钠的密度比水小,且硬度小
2钠与水反应放热,且钠的熔点低,所以能熔化。
3钠与水反应很剧烈,且反应产生了气体
4钠和水反应生成了碱性物质
?
【归纳整理】
钠的物理性质:钠是一种银白色的金属,熔点低,质软。密度比水小。
一钠与水的反应
现象:浮 游 熔 响 红
反应原理:2Na+2H2O =2NaOH+H2↑
【学生实践】离子方程式:2Na+2H2O =2Na++2OH-+H2↑
钠的化学性质
【分组讨论】1如果钠着火了,能不能用水来灭火?
2如果把钠投入到水和煤油的混合物中会有什么现象?
装置示意图
【分组实验并讨论】注意观察现象和钠直接与水反应有什么不同?思考原因是什么?
【归纳现象】:钠会沉到水和煤油的分界线,反应放氢气使钠往上升,然后又掉下来,再上升。
【教师指引】
原因;密度:水>钠>煤油。故钠会沉到水和煤油的分界线,反应放氢气产生向上的作用力使钠往上升,脱离水后没有气体产生,钠在自身重力作用下然后又掉下来,再上升。
【学生困惑探究】实际操作中钠有时候掉不下来,原因是什么?
【分组讨论】总结各组观点,发现有同学观察仔细,发现掉不下来的钠是因为其表面附着许多气泡使其浮力增加故进入煤油层后没有掉下来。
【学生分组实验】:
钠与硫酸铜反应。
操作:将一小块钠投入硫酸铜中
现象:钠熔化成一个闪亮的小球,浮在硫酸铜溶液的表面,快速游动,发出嘶嘶的响声
蓝色溶液中出现蓝色沉淀,且底部有少量黑色的物质
知道学生分析钠与水和硫酸铜反应的现象相同点和不同点的原因。
【总结】钠在溶液中的反应;有酸酸在前,无酸水在前,所以钠与硫酸铜反应,是先与水反应生成氢氧化钠,氢氧化钠再与硫酸铜发生复分解反应。
【反应原理】2Na+2H2O= 2NaOH+H2↑
2NaOH+CuSO4 =Cu(OH)2↓+Na2SO4
总反应:2Na+2H2O+CuSO4=Cu(OH)2+Na2SO4+H2↑
离子方程式: 2Na+2H2O+Cu2+=Cu(OH)2+2Na++H2 ↑
【思考】钠为什么要保存在煤油中?
【观察】金属钠的表面有一层灰白色的物质,说明钠在空气中很容易被氧化。所以为了防止钠被氧化将钠保存在煤油中
【思考】?为什么可以用煤油保存钠?
【分析】钠的密度比煤油大且不与煤油反应)所以可以保存在煤油中。
二钠与氧气反应
1常温下:4Na+O2=2Na2O
观察现象:钠的表面有一层灰白色的物质。
2.加热条件下
【演示实验】
【操作】用坩埚钳夹取一小块钠放入加热后的坩埚中
【现象】钠熔化,再燃烧,发出黄色的火焰,生成淡黄色固体
【分组讨论】为什么要将坩埚加热后再放入钠?
【结论】防止钠在温度较低时发生副反应
反应原理:2Na+O2=Na2O2
加热
三 钠与氯气反应
2Na+CI2=2NaCI
【现象】剧烈燃烧,黄色火焰,大量白烟
点燃
【分组讨论】
钠着火能否用二氧化碳或水灭火。
原因:钠的化学性质很活泼,与水或二氧化碳都能剧烈反应甚至燃烧,所以钠着火不能用水或二氧化碳灭火。可以用沙子灭火
【课堂练习 高温
1 TiCl4+4Na = Ti+4NaCl(高温下制取钛)
该反应利用的是钠的什么性质?氧化剂和还原剂的物质的量之比为?
2 把0.3mol的钠、镁、铝分别投入1mol/L、100ml的盐酸溶液中,产生气体的物质的量之比为( )
A 3:2: 1 B 3: 3: 1 C 3: 1: 1 D 6: 3: 2
【归纳整理】
1学习钠的意义:活泼金属的典型代表
2通过以上分析得知,钠不能像其他的活泼金属把不活泼的金属从它的盐溶液中置换出来,那么在非水的情况下呢?
3通过本节课的学习掌握钠与氧化性单质以及水的反应,在这些反应中钠都是做还原剂。说明金属钠的用途可以用来还原某些金属(不能在水溶液中)
