第四单元自然界的水单元测试-2022-2023学年九年级化学人教版上册(含解析)
文档属性
| 名称 | 第四单元自然界的水单元测试-2022-2023学年九年级化学人教版上册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 186.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-12 15:39:06 | ||
图片预览


文档简介
第四单元 自然界的水 单元测试
一、选择题
1.草莓、香蕉等水果具有芳香气味,原因之一是其中含有乙酸乙酯(化学式为 C4H8O2)等物质。下列关于乙酸乙酯的说法正确的是
A.乙酸乙酯中含有 14 个原子 B.乙酸乙酯的相对分子质量为 88g
C.1 个乙酸乙酯分子中含有 1 个氧分子 D.乙酸乙酯中碳、氢、氧三种元素的质量比为 6︰1︰4
2.电解水实验装置如图所示,下列说法正确的是
A.电解前后元素种类不变
B.实验说明水是由氢气和氧气组成
C.反应产生氢气和氧气的质量比为2:1
D.a管收集的气体能使燃着的木条燃烧更旺
3.在SO2、NO2、O2、H2O2四种物质中,都含有的是
A.氧元素 B.氧分子 C.两个氧原子 D.氧气
4.如图所示,甲是溴(Br)的原子结构示意图,乙摘自元素周期表。下列说法正确的是
A.甲元素属于金属元素
B.乙原子的核内中子数为11
C.甲、乙两种元素形成化合物的化学式是NaBr
D.甲原子核外共有5个电子层
5.水通电分解时没有发生变化的是
A.水分子的能量 B.水分子的组成和构成
C.构成水分子的原子种类 D.水的化学性质
6.由MgS、MgSO3、NaHSO4组成的混合中,硫元素的质量分数为a,则氧元素的质量分数为
A.1-a B.1-a C.1-a D.无法确定
7.” ”、“ ”表示质子数不同的原子,下列表示的物质中属于化合物的是
A. B.
C. D.
8.苹果有“智慧果”“记忆果”的美称,多吃苹果有增进记忆、提高智力的效果,苹果中富含的维生素C(C6H8O6)还具有增强免疫力作用,下列关于维生素C的说法正确的是
A.维生素C是由6个碳原子、8个氢原子和6个氧原子构成
B.每个维生素C分子含4个氢分子
C.维生素C由碳、氢、氧三种元素组成
D.维生素C中碳、氢、氧元素的质量比为3:4:3
9.《千里江山图》被称为“中国十大传世名画”之一。该作品利用矿物颜料充分展现了自然山水的秀丽壮美。下列是其所用的部分矿物颜料,主要成分属于氧化物的是
A.大红色:朱砂【HgS】 B.棕红色:赭石【Fe2O3】
C.白色:碎磲【CaCO3】 D.青绿色:孔雀石【Cu2(OH)2CO3】
10.一种有趣的钟表式元素周期表如图所示,该钟表的整点时间小时数与对应元素的质子数相等。下列关于元素的说法正确的是
A.决定元素种类的是原子的最外层电子数
B.7、8、12时对应的元素形成化合物化学式为Mg(NO3)2
C.1、7时对应元素的离子符号为
D.11时对应的元素形成的离子结构示意图
11.四硫富瓦烯可用于制造隐形飞机,分子结构如图所示。下列说法不正确的是
A.化学式为C6H4S4
B.四硫富瓦烯充分燃烧后的产物会导致酸雨
C.四硫富瓦烯中碳、氢、硫原子个数比为3:2:2
D.四硫富瓦烯由3个元素组成,其中硫元素质量分数最大
12.下图为几种初中常见物质的转化关系图。如图所示,以下说法中错误的是
A.反应①是分解反应
B.反应②中正极产生的气体具有助燃性
C.固体C可能是铁,反应现象是剧烈燃烧,火星四射,生成黑色固体
D.如固体C为硫,则气体D会有刺激性气味
13.“宏观一微观一符号”三重表征是化学独特的表示物质及其变化的方法。下图为某化学反应的微观模型图,“ ”表示氧原子,“ ”表示碳原子,则下列说法正确的是
A.该反应前后分子个数不变 B.该反应的两种反应物都为单质
C.该反应属于化合反应 D.反应前的各物质中氧元素均为-2价
14.乙硫醇(化学式为 C2H6S)易挥发,有蒜臭味,人对该气体极其敏感,下列有关乙硫醇的说法不正确的是
A.乙硫醇的相对分子质量为 62
B.乙硫醇中C、H、S 三种元素的质量比为 2∶6∶1
C.硫元素的质量分数是1.2%
D.在管道煤气中添加微量乙硫醇,目的是及时发现煤气泄漏
二、填空题
15.2017年3月22日是第二十五届“世界水日”,今年的宣传主题是“废水”。请回答下列问题:
(1)电解水可以得到氢气和氧气,说明水是由氢氧两种_______(填“分子”、“原子”、“元素”或“离子”)组成的化合物;
(2)下列物质属于纯净物的是_______(填字母代号);
A.自来水 B.冰水混合物 C.矿泉水 D.蓝墨水
(3)生活中,人们常用_______,来鉴别硬水和软水。
(4)水污染的来源主要有:工业排放的废水,农业上农药和化肥的不合理使用,生活污水的排放,请简述从生活上如何防治水体污染_________。
16.黑火药是我国古代的四大发明之一,它由硝酸钾、硫磺和木炭等组成。黑火药中至少含有______种元素,硝酸钾中氮元素的化合价是______。硫原子的质子数为16,则S2-的核外电子数是______。
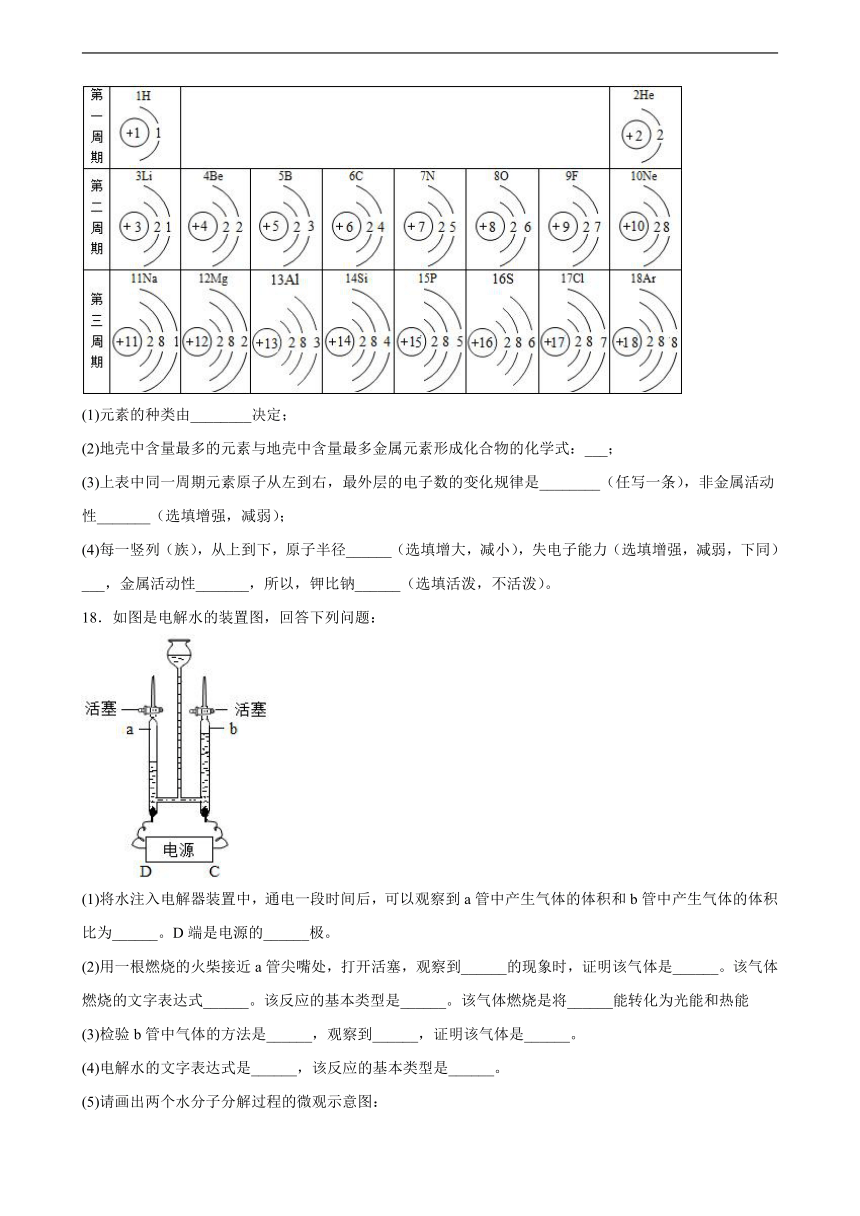
17.元素周期表是学习和研究化学的重要工具.下表是元素周期表中的一部分,请按表中信息填空:
(1)元素的种类由________决定;
(2)地壳中含量最多的元素与地壳中含量最多金属元素形成化合物的化学式:___;
(3)上表中同一周期元素原子从左到右,最外层的电子数的变化规律是________(任写一条),非金属活动性_______(选填增强,减弱);
(4)每一竖列(族),从上到下,原子半径______(选填增大,减小),失电子能力(选填增强,减弱,下同)___,金属活动性_______,所以,钾比钠______(选填活泼,不活泼)。
18.如图是电解水的装置图,回答下列问题:
(1)将水注入电解器装置中,通电一段时间后,可以观察到a管中产生气体的体积和b管中产生气体的体积比为______。D端是电源的______极。
(2)用一根燃烧的火柴接近a管尖嘴处,打开活塞,观察到______的现象时,证明该气体是______。该气体燃烧的文字表达式______。该反应的基本类型是______。该气体燃烧是将______能转化为光能和热能
(3)检验b管中气体的方法是______,观察到______,证明该气体是______。
(4)电解水的文字表达式是______,该反应的基本类型是______。
(5)请画出两个水分子分解过程的微观示意图:
19.某药厂生产的葡萄糖酸锌口服液的标签如下图所示:
已知葡萄糖酸锌的相对分子质量是455,请回答下列问题:
(1)每支口服液含锌6.5 mg,“锌”指的是_____(填“元素”、“原子”或“分子”)。
(2)其中碳、氢、氧元素的质量比是_____(化为最简整数比)。
(3)葡萄糖酸锌中锌元素的质量分数是_____(精确到0.1%)。
三、实验题
20.如图是实验室中过滤操作示意图。回答下列问题:
(1)用酒精灯火焰给图中A里的液体加热时,A应放置在______上,使其受热均匀;
(2)图中B的名称是_______,在过滤操作中,它的作用是________;
(3)过滤时漏斗下端管口应_______烧杯内壁,漏斗中液面应 _____________ 滤纸边缘。
(4)若过滤后发现滤液为浑浊的,应 ______________,若进行此步操作后发现滤液仍为浑浊的,试分析原因?(至少写两条)______________,_______________。
21.如图所示是实验室制取蒸馏水的简易装置,回答下列问题:
(1)实验操作有以下几步:①在蒸馏烧瓶里倒入适量热水,并加入一些碎瓷片;②调节酒精灯、铁圈、铁夹的位置,控制导管末端距试管底的距离;③检查装置的气密性;④连接好全部装置,加热;⑤停止加热;⑥把导管从试管中取出。正确的操作顺序是________。
(2)实验装置中石棉网的作用是________;铁夹的作用是________;铁圈的作用是_____。
(3)导管的末端距试管底2~3 cm,为什么要保持这一段距离:________。
(4)在蒸馏烧瓶中加一些碎瓷片的作用是_________。
四、计算题
22.尿素是一种常用的化学肥料,化学式为 CO(NH2)2,请计算:
(1)尿素中氮、氢元素的质量比
(2)100kg 尿素可为农作物提供多少氮元素?(精确到 0.1kg)
23.图是某厂生产的尿素化肥包装袋上的说明。尿素的化学式为CO(NH2)2
(1)尿素是由___________种元素组成的;每个尿素分子中共有___________个原子。尿素的化学式量为___________。
(2)计算纯尿素中氮、氢元素的质量比。
(3)计算纯尿素中氮元素的质量分数。(计算结果保留到0.1%)
(4)使用该厂生产的一袋尿素化肥,理论上能为农作物提供多少氮元素?
24.苯甲酸(C6H5COOH)是一种酸性比醋酸更强的酸,能使紫色能使紫色石蕊试液变红,请回答并写出计算过程
(1)苯甲酸的相对分子质量。
(2)苯甲酸中碳、氢、氧三种元素的质量比(最简整数比)。
(3)苯甲酸中氧元素的质量分数。(保留到0.1%)
参考答案:
1.D【详解】A、乙酸乙酯是由乙酸乙酯分子构成的,一个乙酸乙酯分中含有4+8+2= 14 个原子,故A错误;
B、乙酸乙酯的相对分子质量为 :,相对分子质量单位是1,通常省略,不是克,故B错误;
C、1 个乙酸乙酯分子中含有4个碳原子、8个氢原子和2个氧原子,不含有氧分子,故C错误;
D、 乙酸乙酯中碳、氢、氧三种元素的质量比为 :,故D正确;
故选D。
2.A【详解】A、根据质量守恒定律,电解水前后元素种类不变,说法正确;
B、电解水生成氢气和氧气,氢气是由氢元素组成,氧气是由氧元素组成,化学变化中元素的种类不变,说明水是由氢元素和氧元素组成的,说法错误;
C、水通电分解生成氢气和氧气,体积比为2:1,不是反应产生氢气和氧气的质量比为2:1,说法错误;
D、水通电分解生成氢气和氧气体积比为2:1,a管收集的气体体积多,是氢气,能燃烧,不能使燃着的木条燃烧更旺,说法错误。
故选:A。
3.A【详解】A、由SO2、NO2、O2、H2O2等化学式可知,都含有氧元素,故正确;
B、SO2、NO2、O2、H2O2等四种物质为纯净物,不可能还含有其他分子,故错误;
C、物质是由分子构成的,应该是这四种物质的每个分子中都含两个氧原子,故错误;
D、SO2、NO2、H2O2三种物质为纯净物,不含氧气,故错误。
故选:A。
4.C【详解】A、甲元素为溴元素,属于非金属元素,此选项错误;
B、由乙图知、乙原子的核内质子数为11,不是中子数,此选项错误;
C、甲为溴,易得一个电子,化合价为-1,乙为钠,易失一个电子,化合价为+1,故溴、钠两种元素形成化合物的化学式是NaBr,此选项正确;
D、由甲图可知,甲原子核外共有4个电子层,此选项错误。
故选C。
5.C【详解】A、水通电生成氢气和氧气,水分子的能量发生变化,故A不正确;
B、水通电生成新物质,水分子的组成和构成发生变化,故B不正确;
C、由质量守恒定律,化学反应前后元素的种类不变,构成水分子的原子种类没有发生变化,故C正确;
D、化学变化后生成了新物质,水电解后生成新物质化学性质一定改变,故D不正确。故选C。
6.B【详解】根据等效原理,可以转化为MgS、MgSO3、MgSO4(相当于NaHSO4)组成,则视为两部分MgS和氧元素组成,硫元素的质量分数为a,则镁元素的质量分数为 ×24=,则氧元素的质量分数为1-a-=1-。故选B。
7.B【分析】化合物为不同种元素组成的纯净物,因此在判断是否为化合物前首先要确定为纯净物;同种分子构成的物质为纯净物,而构成相同的分子为同种物质的分子;确定为纯净物后,再判断分子是否由同种原子构成,同种原子构成的分子为单质的分子。
【详解】A、图中三个分子构成相同,是同种物质的分子,该图所示物质为纯净物;且该分子是由同种原子构成的单质的分子,图示物质为单质,故A不符合题意;
B、图中三个分子构成相同,是同种物质的分子,该图所表示的物质为纯净物;且该分子是由两种不同种原子构成,是化合物的分子,图示物质为化合物,故B符合题意;
C、图中四个分子构成不同,为两种不同物质的分子,一种物质是单质,另一种物质是化合物,该图所示物质为混合物,故C不符合题意;
D、图中四个分子构成不同,为两种不同物质的分子,该图所示物质为混合物,故D不符合题意。
故答案为:B。
8.C【详解】A、维生素C是由维生素C分子构成,1个维生素C分子是由6个碳原子、8个氢原子和6个氧原子构成,故选项说法不正确;
B、每个维生素C分子中含有8个氢原子,不含氢分子,故选项说法不正确;
C、物质由元素组成,维生素C由碳、氢、氧三种元素组成,故选项说法正确;
D、维生素C中碳、氢、氧元素的质量比为(12×6):(1×8):(16×6)=9:1:12,故选项说法不正确。
故选C。
9.B【分析】氧化物是由两种元素组成,其中一种元素为氧元素的化合物。
【详解】A、朱砂由汞、硫两种元素组成,不符合氧化物的特点,不属于氧化物,选项错误;
B、赭石由铁、氧两种元素组成,符合氧化物的特点,属于氧化物,选项正确;
C、碎磲由钙、碳、氧三种元素组成,不属于氧化物,选项错误;
D、孔雀石由铜、碳、氢、氧四种元素组成,不属于氧化物,选项错误;
故选B。
10.B【详解】A、元素是质子数(即核电荷数)相同的一类原子的总称,决定元素种类的是原子的核内质子数,故选项说法错误;
B、7、8、12时对应的元素分别是氮、氧、镁,可组成硝酸镁,硝酸镁的化学式为Mg(NO3)2,故选项说法正确;
C、1、7时对应元素是氢元素和氮元素,可形成铵根离子,其离子符号为,故选项说法错误;
D、11时对应的元素是钠元素,形成的离子是钠离子,钠离子是钠原子失去最外层1个电子后形成的,图中质子数=核外电子数=11,为原子,故选项说法错误。
故选:B。
11.D【详解】A、如图所示,四硫富瓦烯一个分子里含有6个碳原子、4个氢原子和4个硫原子,故其化学式为C6H4S4为,选项正确;
B、根据质量守恒定律可知,反应前后元素种类不变,四硫富瓦烯充分燃烧后会生成硫的氧化物,则会导致酸雨的形成,选项正确;
C、如图所示,四硫富瓦烯中碳、氢、硫原子个数比为,选项正确;
D、如图所示,四硫富瓦烯由碳、氢、硫三种元素组成,碳、氢、硫三种元素质量比为,因此硫元素质量分数最大,但元素不讲个数,选项错误;
故选:D。
12.C【分析】A为暗紫色固体,加热生成氧气,所以A为高锰酸钾;B为无色液体,通电生成氧气,所以B为水;氧气和固体C在点燃条件下生成气体D,可能是碳单质在点燃条件生成二氧化碳气体,或者硫单质在点燃条件下生成二氧化硫气体。
【详解】A、由分析可知,反应①为高锰酸钾在加热条件下分解生成锰酸钾、二氧化锰和氧气,该反应为“一变多”,属于分解反应,故A正确;
B、由分析可知,反应②为水在通电条件下生成氧气和氢气,正极产生的是氧气,具有助燃性,故B正确;
C、铁在氧气中燃烧后的生成物是固体四氧化三铁,而非气体,不符合图中转化关系,所以C不可能是铁,故C错误;
D、由分析可知,如固体C为硫,则气体D为二氧化硫气体,有刺激性气味,故D正确。
故选C。
13.C【分析】由反应的微观模型图可知,反应为一氧化碳和氧气生成二氧化碳。
【详解】A、由反应的微观模型图可知,反应前有3个分子,反应后有2个分子,则该反应前后分子个数发生变化,故A不正确;
B、反应物为一氧化碳和氧气,一氧化碳为化合物,氧气为单质,故B不正确;
C、反应为一氧化碳和氧气生成二氧化碳,反应符合多变一,该反应属于化合反应,故C正确;
D、反应前氧气中氧元素的化合价为0,故D不正确。故选C。
14.BC【详解】A、乙硫醇的相对分子质量=,A正确,不符合题意;
B、乙硫醇中C、H、S 三种元素的质量比=,B错误,符合题意;
C、硫元素的质量分数=,C错误,符合题意;
D、乙硫醇易挥发,有蒜臭味,人对该气体极其敏感,可用于及时发现煤气泄漏,D正确,不符合题意。
故选:BC。
15.(1)元素
(2)B
(3)肥皂水
(4)洗衣服的水不能直接倒在河里(其它合理答案也可)
【解析】(1)
氢气是由氢元素组成的,氧气是由氧元素组成的,根据“反应前后元素的种类不变”可知,水是由氢、氧两种元素组成的,同时水是由水分子构成的,水分子是由氢、氧原子构成的。
(2)
A.自来水中含有多种物质,属于混合物;
B.冰水混合物中只含有一种物质,属于纯净物;
C.矿泉水中含有多种物质,属于混合物;
D.蓝墨水中含有多种物质,属于混合物,
故选B。
(3)
生活中人们常用肥皂水鉴别硬水和软水,其中产生较多浮渣的是硬水,产生较多泡沫的是软水。
(4)
生活中防治水体污染的方法有生活污水集中处理、洗衣服的水不能直接倒在河里等。
16. 5 五 +5 18【详解】硝酸钾中含有K、N、O三种元素,硫磺中含有S元素,木炭中含有C元素。所以黑火药中至少含有5种元素。化合物中各元素化合价代数和为0,硝酸钾(KNO3)中钾元素为+1价、氧元素为-2价,所以氮元素为+5价。S2-由硫原子得到2个电子形成,原子中质子数=核外电子数,所以S2-的核外电子数是16+2=18。
17.(1)质子数(或核电荷数)
(2)Al2O3
(3) 从左到右由1到8递增 增强
(4) 增大 增强 增强 活泼
【解析】(1)
元素是质子数(即核电荷数)相同的一类原子的总称,决定元素种类的是质子数(即核电荷数);
(2)
地壳中含量最多的元素是氧元素,含量最多的金属元素是铝元素,化合物中氧元素的化合价为-2价,铝元素的化合价为+3价,依据化合物中正负化合价代数和为0,可知:铝、氧元素组成的化合物的化学式为Al2O3;
(3)
每一周期元素原子序数的变化规律是从左到右由1到8递增;同一周期中,从左到右,原子失去电子的能力逐渐减弱,得到电子的能力逐渐增强(稀有气体除外),非金属活动性增强,
(4)
同族元素中,最外层电子数相同的原子,原子的半径随电子层数的增加而增大;原子的最外层电子数相同时,电子层数越多,最外层电子离核越远,原子核对最外层电子的吸引力越小,失电子能力增强,金属活动性增强,则钾比钠活泼。
18.(1) 2:1 负
(2) 气体燃烧,有淡蓝色火焰 氢气 H2 氢气+氧气水 化合反应 化学
(3) 将一根带火星的木条放在b管口并打开活塞 木条复燃 氧气 O2
(4) 水氢气+氧气 分解反应
(5)
【解析】(1)
电解水实验正极产生氧气,负极产生氢气,氧气和氢气的体积比为1:2。由图可知,a管气体多是氢气,b管气体少是氧气,故a管中产生气体的体积和b管中产生气体的体积比为2:1,D端与a管相连,为负极;
(2)
a管是氢气,具有可燃烧。所以用一根燃烧的火柴接近a管尖嘴处,打开活塞,观察到气体燃烧,有淡蓝色火焰的现象时,证明该气体是氢气;氢气在空气中燃烧生成水,该反应的文字表达式为:;该反应是由两种物质反应生成一种物质的反应,符合多变一的特点,属于化合反应;该气体燃烧是将化学能转化为光能和热能;
(3)
b管是氧气,具有助燃性。检验方法是将一根带火星的木条放在b管口并打开活塞,观察到木条复燃,证明该气体是氧气;
(4)
水通电生成氢气和氧气,该反应的文字表达式为:;该反应是一种物质生成两种物质的反应,符合一变多的特点,属于分解反应;
(5)
电解水反应微观实质是每个水分子分解为2个氢原子和1个氧原子,然后每2个氢原子构成1个氢分子,每2个氧原子构成1个氧分子。故电解水反应的微观示意图见答案。
19.(1)元素
(2)72:11:112
(3)14.3%
【解析】(1)
宏观物质由元素组成,每支口服液含锌中的“锌”指的是元素;
(2)
物质的各元素质量比等于其相对原子质量乘以原子个数之比,碳、氢、氧元素的质量比是;
(3)
葡萄糖酸锌中锌元素的质量分数是。
20.(1)石棉网
(2) 玻璃棒 引流
(3) 紧靠 低于
(4) 再过滤一次 仪器不干净 滤纸破损;液面高于滤纸边缘;滤纸边缘高于漏斗边缘
【解析】(1)
为了让烧杯受热均匀,防止烧杯破裂,用酒精灯火焰给烧杯加热时,烧杯下面垫上石棉网,故A应放置在石棉网上,使其受热均匀;
(2)
图中B的名称是玻璃棒,过滤需要玻璃棒引流,则在过滤操作中,它的作用是引流。
(3)
为防止滤液飞溅,过滤时漏斗下端管口应紧靠烧杯内壁,为防止待滤液从滤纸与漏斗间直接流进烧杯,漏斗中液面应低于滤纸边缘,故过滤时漏斗下端管口应紧靠烧杯内壁,漏斗中液面应低于滤纸边缘。
(4)
若过滤后发现滤液为浑浊的,应再过滤一次,若进行此步操作后发现滤液仍为浑浊的,原因:仪器不干净;滤纸破损;液面高于滤纸边缘;滤纸边缘高于漏斗边缘。
21.(1)③①②④⑥⑤
(2) 使蒸馏烧瓶受热均匀,保持蒸馏液平稳沸腾 夹持固定烧瓶 支持石棉网
(3)便于水蒸气冷凝
(4)防止水蒸馏时暴沸
【解析】(1)
实验室制取蒸馏水的操作步骤是:加蒸馏液之前应先检查装置的气密性;然后在蒸馏烧瓶里倒入适量的热水,并加入一些碎瓷片;然后调节酒精灯、铁圈、铁夹的位置,控制导管末端距试管底的距离;连接好全部装置,加热;制取蒸馏水之后应先把导管从试管中取出,再停止加热,否则会发生倒吸。故正确的操作顺序是③①②④⑥⑤;
(2)
对烧瓶进行加热时,为防止加热时烧瓶底炸裂,使蒸馏烧瓶受热均匀,保持蒸馏液平稳沸腾,需垫石棉网;铁夹的作用是夹持固定烧瓶;铁圈的作用是支持石棉网;
(3)
导管的末端一般距试管底2~3cm,太高起不到冷却作用,太低水蒸气会倒流,这样正好便于水蒸气冷凝;
(4)
为防止水蒸馏时暴沸,应在蒸馏烧瓶中加一些碎瓷片。
22.(1)根据尿素化学式,尿素中氮、氢元素的质量比为
答:尿素中氮、氢元素的质量比为7:1。
(2)根据尿素的化学式,尿素中氮元素的质量分数为 ,则100kg 尿素可为农作物提供氮元素的质量为
答:100kg 尿素可为农作物提供氮元素的质量为46.7kg。
【解析】(1)
见答案;
(2)
见答案。
23.(1) 4 8 60
(2)尿素中氮元素和氢元素的质量比是:
(3)尿素中氮元素的质量分数为:
(4)该化肥中氮元素的质量为:
【分析】本题考查化学计算。
(1)
尿素由碳、氢、氧、氮四种元素组成;每个尿素分子有一个碳原子、两个氮原子、四个氢原子、一个氧原子,一共有8个原子,尿素的化学式量是:;
(2)
见答案;
(3)
见答案;
(4)
见答案。
24.(1)根据相对分子的质量为组成分子的各原子的相对原子质量之和,可得苯甲酸的相对分子质量为:12×7+6+16×2=122;
(2)根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,可得苯甲酸中碳、氢、氧三种元素的质量比为:(12×7):6:(16×2)=42:3:16;
(3)苯甲酸中氧元素的质量分数为≈26.2%。
【解析】(1)
见答案。
(2)
见答案。
(3)
见答案。
一、选择题
1.草莓、香蕉等水果具有芳香气味,原因之一是其中含有乙酸乙酯(化学式为 C4H8O2)等物质。下列关于乙酸乙酯的说法正确的是
A.乙酸乙酯中含有 14 个原子 B.乙酸乙酯的相对分子质量为 88g
C.1 个乙酸乙酯分子中含有 1 个氧分子 D.乙酸乙酯中碳、氢、氧三种元素的质量比为 6︰1︰4
2.电解水实验装置如图所示,下列说法正确的是
A.电解前后元素种类不变
B.实验说明水是由氢气和氧气组成
C.反应产生氢气和氧气的质量比为2:1
D.a管收集的气体能使燃着的木条燃烧更旺
3.在SO2、NO2、O2、H2O2四种物质中,都含有的是
A.氧元素 B.氧分子 C.两个氧原子 D.氧气
4.如图所示,甲是溴(Br)的原子结构示意图,乙摘自元素周期表。下列说法正确的是
A.甲元素属于金属元素
B.乙原子的核内中子数为11
C.甲、乙两种元素形成化合物的化学式是NaBr
D.甲原子核外共有5个电子层
5.水通电分解时没有发生变化的是
A.水分子的能量 B.水分子的组成和构成
C.构成水分子的原子种类 D.水的化学性质
6.由MgS、MgSO3、NaHSO4组成的混合中,硫元素的质量分数为a,则氧元素的质量分数为
A.1-a B.1-a C.1-a D.无法确定
7.” ”、“ ”表示质子数不同的原子,下列表示的物质中属于化合物的是
A. B.
C. D.
8.苹果有“智慧果”“记忆果”的美称,多吃苹果有增进记忆、提高智力的效果,苹果中富含的维生素C(C6H8O6)还具有增强免疫力作用,下列关于维生素C的说法正确的是
A.维生素C是由6个碳原子、8个氢原子和6个氧原子构成
B.每个维生素C分子含4个氢分子
C.维生素C由碳、氢、氧三种元素组成
D.维生素C中碳、氢、氧元素的质量比为3:4:3
9.《千里江山图》被称为“中国十大传世名画”之一。该作品利用矿物颜料充分展现了自然山水的秀丽壮美。下列是其所用的部分矿物颜料,主要成分属于氧化物的是
A.大红色:朱砂【HgS】 B.棕红色:赭石【Fe2O3】
C.白色:碎磲【CaCO3】 D.青绿色:孔雀石【Cu2(OH)2CO3】
10.一种有趣的钟表式元素周期表如图所示,该钟表的整点时间小时数与对应元素的质子数相等。下列关于元素的说法正确的是
A.决定元素种类的是原子的最外层电子数
B.7、8、12时对应的元素形成化合物化学式为Mg(NO3)2
C.1、7时对应元素的离子符号为
D.11时对应的元素形成的离子结构示意图
11.四硫富瓦烯可用于制造隐形飞机,分子结构如图所示。下列说法不正确的是
A.化学式为C6H4S4
B.四硫富瓦烯充分燃烧后的产物会导致酸雨
C.四硫富瓦烯中碳、氢、硫原子个数比为3:2:2
D.四硫富瓦烯由3个元素组成,其中硫元素质量分数最大
12.下图为几种初中常见物质的转化关系图。如图所示,以下说法中错误的是
A.反应①是分解反应
B.反应②中正极产生的气体具有助燃性
C.固体C可能是铁,反应现象是剧烈燃烧,火星四射,生成黑色固体
D.如固体C为硫,则气体D会有刺激性气味
13.“宏观一微观一符号”三重表征是化学独特的表示物质及其变化的方法。下图为某化学反应的微观模型图,“ ”表示氧原子,“ ”表示碳原子,则下列说法正确的是
A.该反应前后分子个数不变 B.该反应的两种反应物都为单质
C.该反应属于化合反应 D.反应前的各物质中氧元素均为-2价
14.乙硫醇(化学式为 C2H6S)易挥发,有蒜臭味,人对该气体极其敏感,下列有关乙硫醇的说法不正确的是
A.乙硫醇的相对分子质量为 62
B.乙硫醇中C、H、S 三种元素的质量比为 2∶6∶1
C.硫元素的质量分数是1.2%
D.在管道煤气中添加微量乙硫醇,目的是及时发现煤气泄漏
二、填空题
15.2017年3月22日是第二十五届“世界水日”,今年的宣传主题是“废水”。请回答下列问题:
(1)电解水可以得到氢气和氧气,说明水是由氢氧两种_______(填“分子”、“原子”、“元素”或“离子”)组成的化合物;
(2)下列物质属于纯净物的是_______(填字母代号);
A.自来水 B.冰水混合物 C.矿泉水 D.蓝墨水
(3)生活中,人们常用_______,来鉴别硬水和软水。
(4)水污染的来源主要有:工业排放的废水,农业上农药和化肥的不合理使用,生活污水的排放,请简述从生活上如何防治水体污染_________。
16.黑火药是我国古代的四大发明之一,它由硝酸钾、硫磺和木炭等组成。黑火药中至少含有______种元素,硝酸钾中氮元素的化合价是______。硫原子的质子数为16,则S2-的核外电子数是______。
17.元素周期表是学习和研究化学的重要工具.下表是元素周期表中的一部分,请按表中信息填空:
(1)元素的种类由________决定;
(2)地壳中含量最多的元素与地壳中含量最多金属元素形成化合物的化学式:___;
(3)上表中同一周期元素原子从左到右,最外层的电子数的变化规律是________(任写一条),非金属活动性_______(选填增强,减弱);
(4)每一竖列(族),从上到下,原子半径______(选填增大,减小),失电子能力(选填增强,减弱,下同)___,金属活动性_______,所以,钾比钠______(选填活泼,不活泼)。
18.如图是电解水的装置图,回答下列问题:
(1)将水注入电解器装置中,通电一段时间后,可以观察到a管中产生气体的体积和b管中产生气体的体积比为______。D端是电源的______极。
(2)用一根燃烧的火柴接近a管尖嘴处,打开活塞,观察到______的现象时,证明该气体是______。该气体燃烧的文字表达式______。该反应的基本类型是______。该气体燃烧是将______能转化为光能和热能
(3)检验b管中气体的方法是______,观察到______,证明该气体是______。
(4)电解水的文字表达式是______,该反应的基本类型是______。
(5)请画出两个水分子分解过程的微观示意图:
19.某药厂生产的葡萄糖酸锌口服液的标签如下图所示:
已知葡萄糖酸锌的相对分子质量是455,请回答下列问题:
(1)每支口服液含锌6.5 mg,“锌”指的是_____(填“元素”、“原子”或“分子”)。
(2)其中碳、氢、氧元素的质量比是_____(化为最简整数比)。
(3)葡萄糖酸锌中锌元素的质量分数是_____(精确到0.1%)。
三、实验题
20.如图是实验室中过滤操作示意图。回答下列问题:
(1)用酒精灯火焰给图中A里的液体加热时,A应放置在______上,使其受热均匀;
(2)图中B的名称是_______,在过滤操作中,它的作用是________;
(3)过滤时漏斗下端管口应_______烧杯内壁,漏斗中液面应 _____________ 滤纸边缘。
(4)若过滤后发现滤液为浑浊的,应 ______________,若进行此步操作后发现滤液仍为浑浊的,试分析原因?(至少写两条)______________,_______________。
21.如图所示是实验室制取蒸馏水的简易装置,回答下列问题:
(1)实验操作有以下几步:①在蒸馏烧瓶里倒入适量热水,并加入一些碎瓷片;②调节酒精灯、铁圈、铁夹的位置,控制导管末端距试管底的距离;③检查装置的气密性;④连接好全部装置,加热;⑤停止加热;⑥把导管从试管中取出。正确的操作顺序是________。
(2)实验装置中石棉网的作用是________;铁夹的作用是________;铁圈的作用是_____。
(3)导管的末端距试管底2~3 cm,为什么要保持这一段距离:________。
(4)在蒸馏烧瓶中加一些碎瓷片的作用是_________。
四、计算题
22.尿素是一种常用的化学肥料,化学式为 CO(NH2)2,请计算:
(1)尿素中氮、氢元素的质量比
(2)100kg 尿素可为农作物提供多少氮元素?(精确到 0.1kg)
23.图是某厂生产的尿素化肥包装袋上的说明。尿素的化学式为CO(NH2)2
(1)尿素是由___________种元素组成的;每个尿素分子中共有___________个原子。尿素的化学式量为___________。
(2)计算纯尿素中氮、氢元素的质量比。
(3)计算纯尿素中氮元素的质量分数。(计算结果保留到0.1%)
(4)使用该厂生产的一袋尿素化肥,理论上能为农作物提供多少氮元素?
24.苯甲酸(C6H5COOH)是一种酸性比醋酸更强的酸,能使紫色能使紫色石蕊试液变红,请回答并写出计算过程
(1)苯甲酸的相对分子质量。
(2)苯甲酸中碳、氢、氧三种元素的质量比(最简整数比)。
(3)苯甲酸中氧元素的质量分数。(保留到0.1%)
参考答案:
1.D【详解】A、乙酸乙酯是由乙酸乙酯分子构成的,一个乙酸乙酯分中含有4+8+2= 14 个原子,故A错误;
B、乙酸乙酯的相对分子质量为 :,相对分子质量单位是1,通常省略,不是克,故B错误;
C、1 个乙酸乙酯分子中含有4个碳原子、8个氢原子和2个氧原子,不含有氧分子,故C错误;
D、 乙酸乙酯中碳、氢、氧三种元素的质量比为 :,故D正确;
故选D。
2.A【详解】A、根据质量守恒定律,电解水前后元素种类不变,说法正确;
B、电解水生成氢气和氧气,氢气是由氢元素组成,氧气是由氧元素组成,化学变化中元素的种类不变,说明水是由氢元素和氧元素组成的,说法错误;
C、水通电分解生成氢气和氧气,体积比为2:1,不是反应产生氢气和氧气的质量比为2:1,说法错误;
D、水通电分解生成氢气和氧气体积比为2:1,a管收集的气体体积多,是氢气,能燃烧,不能使燃着的木条燃烧更旺,说法错误。
故选:A。
3.A【详解】A、由SO2、NO2、O2、H2O2等化学式可知,都含有氧元素,故正确;
B、SO2、NO2、O2、H2O2等四种物质为纯净物,不可能还含有其他分子,故错误;
C、物质是由分子构成的,应该是这四种物质的每个分子中都含两个氧原子,故错误;
D、SO2、NO2、H2O2三种物质为纯净物,不含氧气,故错误。
故选:A。
4.C【详解】A、甲元素为溴元素,属于非金属元素,此选项错误;
B、由乙图知、乙原子的核内质子数为11,不是中子数,此选项错误;
C、甲为溴,易得一个电子,化合价为-1,乙为钠,易失一个电子,化合价为+1,故溴、钠两种元素形成化合物的化学式是NaBr,此选项正确;
D、由甲图可知,甲原子核外共有4个电子层,此选项错误。
故选C。
5.C【详解】A、水通电生成氢气和氧气,水分子的能量发生变化,故A不正确;
B、水通电生成新物质,水分子的组成和构成发生变化,故B不正确;
C、由质量守恒定律,化学反应前后元素的种类不变,构成水分子的原子种类没有发生变化,故C正确;
D、化学变化后生成了新物质,水电解后生成新物质化学性质一定改变,故D不正确。故选C。
6.B【详解】根据等效原理,可以转化为MgS、MgSO3、MgSO4(相当于NaHSO4)组成,则视为两部分MgS和氧元素组成,硫元素的质量分数为a,则镁元素的质量分数为 ×24=,则氧元素的质量分数为1-a-=1-。故选B。
7.B【分析】化合物为不同种元素组成的纯净物,因此在判断是否为化合物前首先要确定为纯净物;同种分子构成的物质为纯净物,而构成相同的分子为同种物质的分子;确定为纯净物后,再判断分子是否由同种原子构成,同种原子构成的分子为单质的分子。
【详解】A、图中三个分子构成相同,是同种物质的分子,该图所示物质为纯净物;且该分子是由同种原子构成的单质的分子,图示物质为单质,故A不符合题意;
B、图中三个分子构成相同,是同种物质的分子,该图所表示的物质为纯净物;且该分子是由两种不同种原子构成,是化合物的分子,图示物质为化合物,故B符合题意;
C、图中四个分子构成不同,为两种不同物质的分子,一种物质是单质,另一种物质是化合物,该图所示物质为混合物,故C不符合题意;
D、图中四个分子构成不同,为两种不同物质的分子,该图所示物质为混合物,故D不符合题意。
故答案为:B。
8.C【详解】A、维生素C是由维生素C分子构成,1个维生素C分子是由6个碳原子、8个氢原子和6个氧原子构成,故选项说法不正确;
B、每个维生素C分子中含有8个氢原子,不含氢分子,故选项说法不正确;
C、物质由元素组成,维生素C由碳、氢、氧三种元素组成,故选项说法正确;
D、维生素C中碳、氢、氧元素的质量比为(12×6):(1×8):(16×6)=9:1:12,故选项说法不正确。
故选C。
9.B【分析】氧化物是由两种元素组成,其中一种元素为氧元素的化合物。
【详解】A、朱砂由汞、硫两种元素组成,不符合氧化物的特点,不属于氧化物,选项错误;
B、赭石由铁、氧两种元素组成,符合氧化物的特点,属于氧化物,选项正确;
C、碎磲由钙、碳、氧三种元素组成,不属于氧化物,选项错误;
D、孔雀石由铜、碳、氢、氧四种元素组成,不属于氧化物,选项错误;
故选B。
10.B【详解】A、元素是质子数(即核电荷数)相同的一类原子的总称,决定元素种类的是原子的核内质子数,故选项说法错误;
B、7、8、12时对应的元素分别是氮、氧、镁,可组成硝酸镁,硝酸镁的化学式为Mg(NO3)2,故选项说法正确;
C、1、7时对应元素是氢元素和氮元素,可形成铵根离子,其离子符号为,故选项说法错误;
D、11时对应的元素是钠元素,形成的离子是钠离子,钠离子是钠原子失去最外层1个电子后形成的,图中质子数=核外电子数=11,为原子,故选项说法错误。
故选:B。
11.D【详解】A、如图所示,四硫富瓦烯一个分子里含有6个碳原子、4个氢原子和4个硫原子,故其化学式为C6H4S4为,选项正确;
B、根据质量守恒定律可知,反应前后元素种类不变,四硫富瓦烯充分燃烧后会生成硫的氧化物,则会导致酸雨的形成,选项正确;
C、如图所示,四硫富瓦烯中碳、氢、硫原子个数比为,选项正确;
D、如图所示,四硫富瓦烯由碳、氢、硫三种元素组成,碳、氢、硫三种元素质量比为,因此硫元素质量分数最大,但元素不讲个数,选项错误;
故选:D。
12.C【分析】A为暗紫色固体,加热生成氧气,所以A为高锰酸钾;B为无色液体,通电生成氧气,所以B为水;氧气和固体C在点燃条件下生成气体D,可能是碳单质在点燃条件生成二氧化碳气体,或者硫单质在点燃条件下生成二氧化硫气体。
【详解】A、由分析可知,反应①为高锰酸钾在加热条件下分解生成锰酸钾、二氧化锰和氧气,该反应为“一变多”,属于分解反应,故A正确;
B、由分析可知,反应②为水在通电条件下生成氧气和氢气,正极产生的是氧气,具有助燃性,故B正确;
C、铁在氧气中燃烧后的生成物是固体四氧化三铁,而非气体,不符合图中转化关系,所以C不可能是铁,故C错误;
D、由分析可知,如固体C为硫,则气体D为二氧化硫气体,有刺激性气味,故D正确。
故选C。
13.C【分析】由反应的微观模型图可知,反应为一氧化碳和氧气生成二氧化碳。
【详解】A、由反应的微观模型图可知,反应前有3个分子,反应后有2个分子,则该反应前后分子个数发生变化,故A不正确;
B、反应物为一氧化碳和氧气,一氧化碳为化合物,氧气为单质,故B不正确;
C、反应为一氧化碳和氧气生成二氧化碳,反应符合多变一,该反应属于化合反应,故C正确;
D、反应前氧气中氧元素的化合价为0,故D不正确。故选C。
14.BC【详解】A、乙硫醇的相对分子质量=,A正确,不符合题意;
B、乙硫醇中C、H、S 三种元素的质量比=,B错误,符合题意;
C、硫元素的质量分数=,C错误,符合题意;
D、乙硫醇易挥发,有蒜臭味,人对该气体极其敏感,可用于及时发现煤气泄漏,D正确,不符合题意。
故选:BC。
15.(1)元素
(2)B
(3)肥皂水
(4)洗衣服的水不能直接倒在河里(其它合理答案也可)
【解析】(1)
氢气是由氢元素组成的,氧气是由氧元素组成的,根据“反应前后元素的种类不变”可知,水是由氢、氧两种元素组成的,同时水是由水分子构成的,水分子是由氢、氧原子构成的。
(2)
A.自来水中含有多种物质,属于混合物;
B.冰水混合物中只含有一种物质,属于纯净物;
C.矿泉水中含有多种物质,属于混合物;
D.蓝墨水中含有多种物质,属于混合物,
故选B。
(3)
生活中人们常用肥皂水鉴别硬水和软水,其中产生较多浮渣的是硬水,产生较多泡沫的是软水。
(4)
生活中防治水体污染的方法有生活污水集中处理、洗衣服的水不能直接倒在河里等。
16. 5 五 +5 18【详解】硝酸钾中含有K、N、O三种元素,硫磺中含有S元素,木炭中含有C元素。所以黑火药中至少含有5种元素。化合物中各元素化合价代数和为0,硝酸钾(KNO3)中钾元素为+1价、氧元素为-2价,所以氮元素为+5价。S2-由硫原子得到2个电子形成,原子中质子数=核外电子数,所以S2-的核外电子数是16+2=18。
17.(1)质子数(或核电荷数)
(2)Al2O3
(3) 从左到右由1到8递增 增强
(4) 增大 增强 增强 活泼
【解析】(1)
元素是质子数(即核电荷数)相同的一类原子的总称,决定元素种类的是质子数(即核电荷数);
(2)
地壳中含量最多的元素是氧元素,含量最多的金属元素是铝元素,化合物中氧元素的化合价为-2价,铝元素的化合价为+3价,依据化合物中正负化合价代数和为0,可知:铝、氧元素组成的化合物的化学式为Al2O3;
(3)
每一周期元素原子序数的变化规律是从左到右由1到8递增;同一周期中,从左到右,原子失去电子的能力逐渐减弱,得到电子的能力逐渐增强(稀有气体除外),非金属活动性增强,
(4)
同族元素中,最外层电子数相同的原子,原子的半径随电子层数的增加而增大;原子的最外层电子数相同时,电子层数越多,最外层电子离核越远,原子核对最外层电子的吸引力越小,失电子能力增强,金属活动性增强,则钾比钠活泼。
18.(1) 2:1 负
(2) 气体燃烧,有淡蓝色火焰 氢气 H2 氢气+氧气水 化合反应 化学
(3) 将一根带火星的木条放在b管口并打开活塞 木条复燃 氧气 O2
(4) 水氢气+氧气 分解反应
(5)
【解析】(1)
电解水实验正极产生氧气,负极产生氢气,氧气和氢气的体积比为1:2。由图可知,a管气体多是氢气,b管气体少是氧气,故a管中产生气体的体积和b管中产生气体的体积比为2:1,D端与a管相连,为负极;
(2)
a管是氢气,具有可燃烧。所以用一根燃烧的火柴接近a管尖嘴处,打开活塞,观察到气体燃烧,有淡蓝色火焰的现象时,证明该气体是氢气;氢气在空气中燃烧生成水,该反应的文字表达式为:;该反应是由两种物质反应生成一种物质的反应,符合多变一的特点,属于化合反应;该气体燃烧是将化学能转化为光能和热能;
(3)
b管是氧气,具有助燃性。检验方法是将一根带火星的木条放在b管口并打开活塞,观察到木条复燃,证明该气体是氧气;
(4)
水通电生成氢气和氧气,该反应的文字表达式为:;该反应是一种物质生成两种物质的反应,符合一变多的特点,属于分解反应;
(5)
电解水反应微观实质是每个水分子分解为2个氢原子和1个氧原子,然后每2个氢原子构成1个氢分子,每2个氧原子构成1个氧分子。故电解水反应的微观示意图见答案。
19.(1)元素
(2)72:11:112
(3)14.3%
【解析】(1)
宏观物质由元素组成,每支口服液含锌中的“锌”指的是元素;
(2)
物质的各元素质量比等于其相对原子质量乘以原子个数之比,碳、氢、氧元素的质量比是;
(3)
葡萄糖酸锌中锌元素的质量分数是。
20.(1)石棉网
(2) 玻璃棒 引流
(3) 紧靠 低于
(4) 再过滤一次 仪器不干净 滤纸破损;液面高于滤纸边缘;滤纸边缘高于漏斗边缘
【解析】(1)
为了让烧杯受热均匀,防止烧杯破裂,用酒精灯火焰给烧杯加热时,烧杯下面垫上石棉网,故A应放置在石棉网上,使其受热均匀;
(2)
图中B的名称是玻璃棒,过滤需要玻璃棒引流,则在过滤操作中,它的作用是引流。
(3)
为防止滤液飞溅,过滤时漏斗下端管口应紧靠烧杯内壁,为防止待滤液从滤纸与漏斗间直接流进烧杯,漏斗中液面应低于滤纸边缘,故过滤时漏斗下端管口应紧靠烧杯内壁,漏斗中液面应低于滤纸边缘。
(4)
若过滤后发现滤液为浑浊的,应再过滤一次,若进行此步操作后发现滤液仍为浑浊的,原因:仪器不干净;滤纸破损;液面高于滤纸边缘;滤纸边缘高于漏斗边缘。
21.(1)③①②④⑥⑤
(2) 使蒸馏烧瓶受热均匀,保持蒸馏液平稳沸腾 夹持固定烧瓶 支持石棉网
(3)便于水蒸气冷凝
(4)防止水蒸馏时暴沸
【解析】(1)
实验室制取蒸馏水的操作步骤是:加蒸馏液之前应先检查装置的气密性;然后在蒸馏烧瓶里倒入适量的热水,并加入一些碎瓷片;然后调节酒精灯、铁圈、铁夹的位置,控制导管末端距试管底的距离;连接好全部装置,加热;制取蒸馏水之后应先把导管从试管中取出,再停止加热,否则会发生倒吸。故正确的操作顺序是③①②④⑥⑤;
(2)
对烧瓶进行加热时,为防止加热时烧瓶底炸裂,使蒸馏烧瓶受热均匀,保持蒸馏液平稳沸腾,需垫石棉网;铁夹的作用是夹持固定烧瓶;铁圈的作用是支持石棉网;
(3)
导管的末端一般距试管底2~3cm,太高起不到冷却作用,太低水蒸气会倒流,这样正好便于水蒸气冷凝;
(4)
为防止水蒸馏时暴沸,应在蒸馏烧瓶中加一些碎瓷片。
22.(1)根据尿素化学式,尿素中氮、氢元素的质量比为
答:尿素中氮、氢元素的质量比为7:1。
(2)根据尿素的化学式,尿素中氮元素的质量分数为 ,则100kg 尿素可为农作物提供氮元素的质量为
答:100kg 尿素可为农作物提供氮元素的质量为46.7kg。
【解析】(1)
见答案;
(2)
见答案。
23.(1) 4 8 60
(2)尿素中氮元素和氢元素的质量比是:
(3)尿素中氮元素的质量分数为:
(4)该化肥中氮元素的质量为:
【分析】本题考查化学计算。
(1)
尿素由碳、氢、氧、氮四种元素组成;每个尿素分子有一个碳原子、两个氮原子、四个氢原子、一个氧原子,一共有8个原子,尿素的化学式量是:;
(2)
见答案;
(3)
见答案;
(4)
见答案。
24.(1)根据相对分子的质量为组成分子的各原子的相对原子质量之和,可得苯甲酸的相对分子质量为:12×7+6+16×2=122;
(2)根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,可得苯甲酸中碳、氢、氧三种元素的质量比为:(12×7):6:(16×2)=42:3:16;
(3)苯甲酸中氧元素的质量分数为≈26.2%。
【解析】(1)
见答案。
(2)
见答案。
(3)
见答案。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
