鲁教版化学九年级上册 第四单元 第三节 氧气课件(共31张PPT)
文档属性
| 名称 | 鲁教版化学九年级上册 第四单元 第三节 氧气课件(共31张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 6.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-13 07:44:24 | ||
图片预览






文档简介
(共31张PPT)
第四单元 我们周围的空气
第三节 氧气
无影无形摸不着,
火焰见它跳得高。
呼吸作用它参加,
动物生长离不了。
猜猜它是谁?
回忆
工业制氧气:
H2O H2 O2
通电分解水:
分离液态空气法
通电
水
氢气 + 氧气
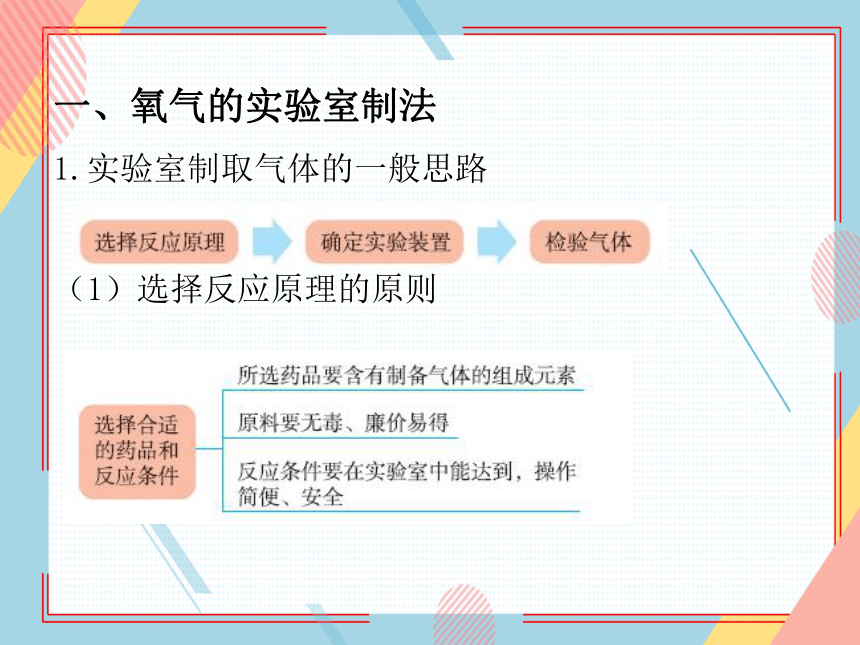
一、氧气的实验室制法
1.实验室制取气体的一般思路
(1)选择反应原理的原则
【思考】你认为下列哪些物质可作为实验室制取氧气的物质?
1.水(H2O)
2.二氧化碳(CO2)
3.食盐(主要成分为NaCl)
4.高锰酸钾(KMnO4)
5.过氧化氢(H2O2)
6.甲烷(CH4)
7.氯酸钾(KClO3)
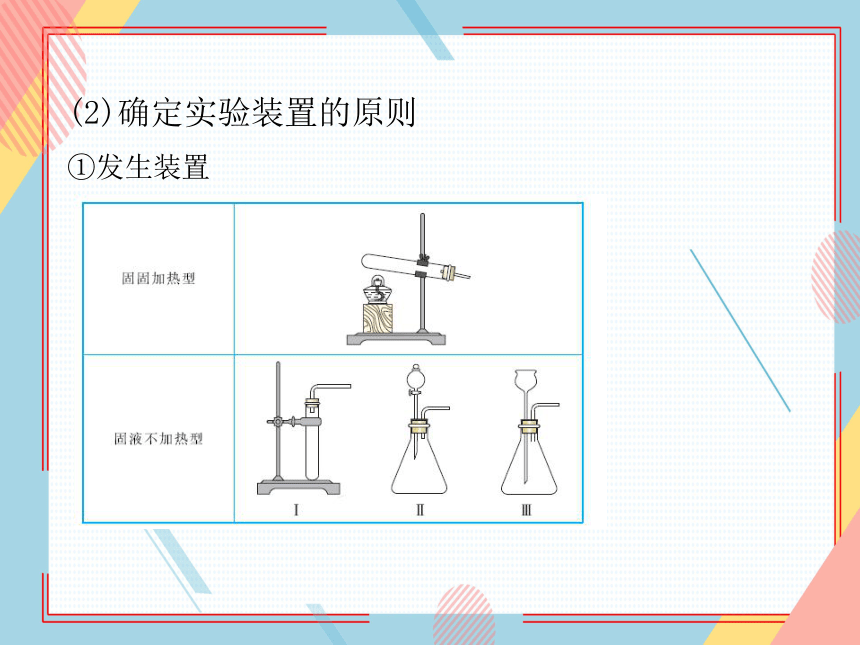
(2)确定实验装置的原则
①发生装置
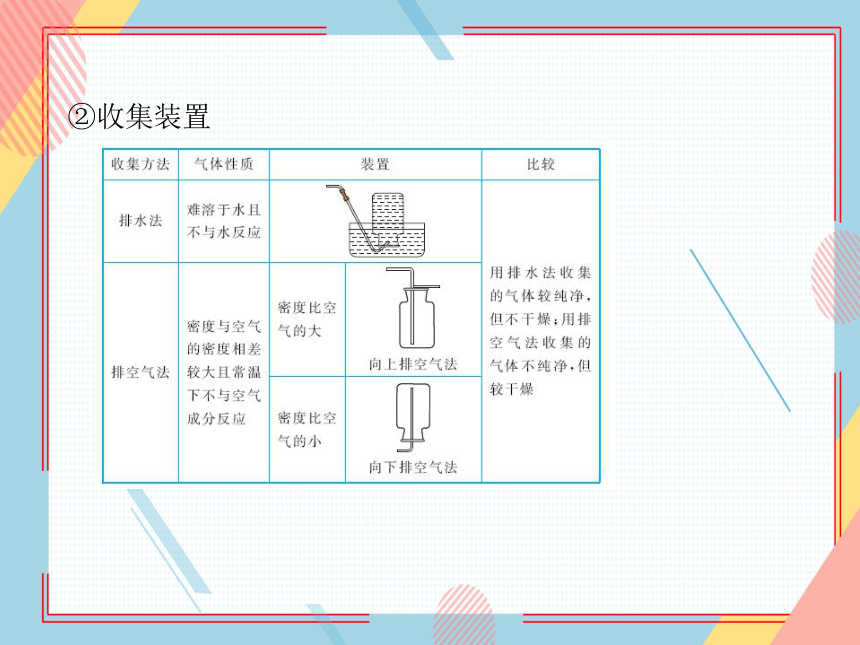
②收集装置
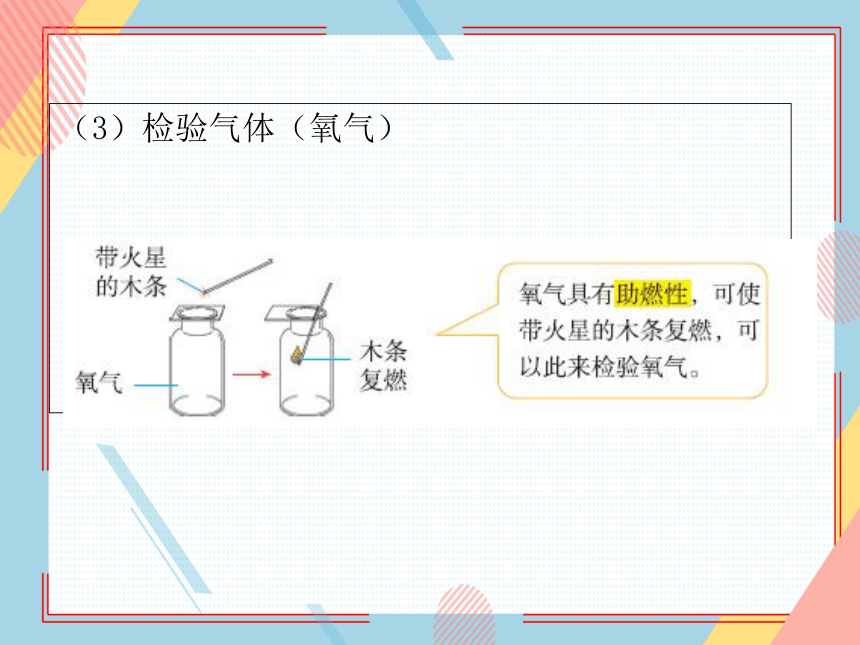
(3)检验气体(氧气)
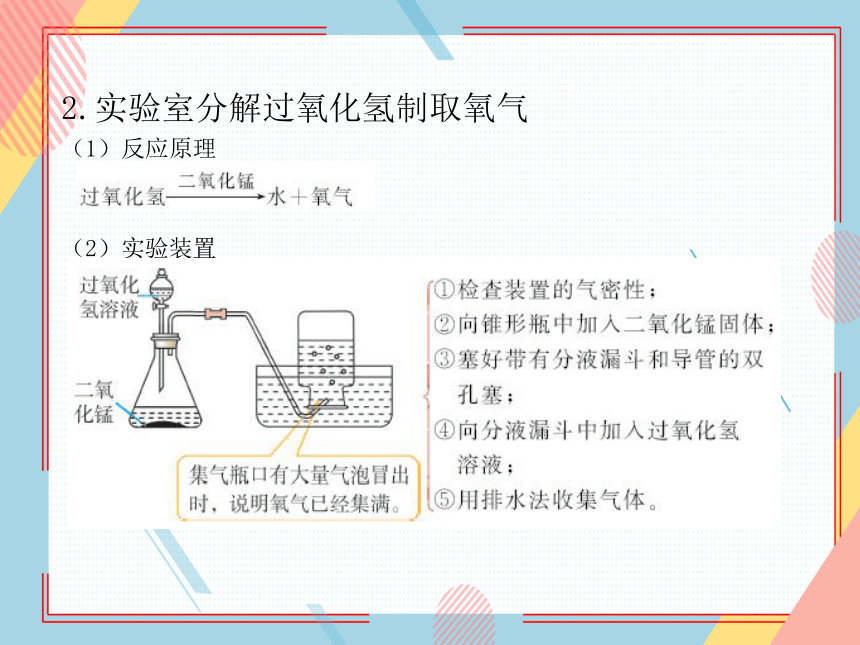
2.实验室分解过氧化氢制取氧气
(1)反应原理
(2)实验装置
(3)检验
将带火星的木条伸入集气瓶中,若带火星的木条复燃,证明瓶中气体为氧气。
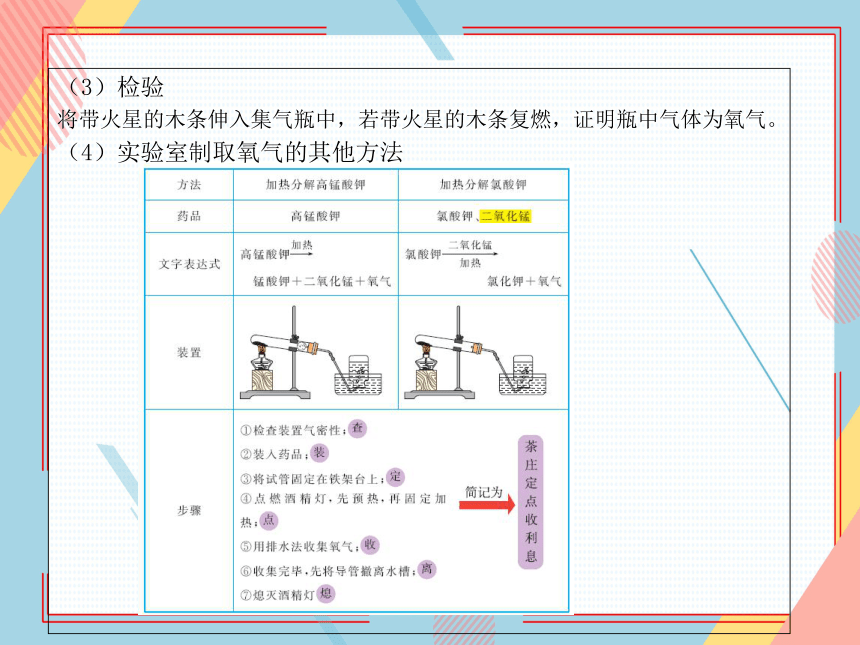
(4)实验室制取氧气的其他方法
交流反思:实验中的注意事项
1.实验前应首先检查装置的气密性;
2.导管刚露出橡皮塞即可;
3.当导管口有连续、均匀的气泡产生时,再收集气体;
4.取出后的集气瓶应正放。
发现问题:
你的猜想:
过氧化氢
水+氧气
反应速率慢
有什么办法可以让过氧化氢反应的速率加快吗?
提高过氧化氢的浓度;
提高温度;
向过氧化氢溶液中加入某物质。
过氧化氢溶液
观察:向两支试管中分别倒入过氧化氢溶液,再向其中一支试管加入少量二氧化锰粉末,将带火星的木条伸入试管口,观察现象。
实验探究:
二氧化锰
选用药品 产生气体
速率 能否使带火星的木条复燃
过氧化氢
过氧化氢
和二氧化锰
实验现象
慢
快
否
能
获得结论:最适合在实验室制取氧气的方法是在过 氧化氢溶液中加入二氧化锰。
小资料
1.将反应后的二氧化锰过滤、干燥、称量,发现二氧化锰的质量不发生改变。
2.将称量后的二氧化锰再次放入过氧化氢溶液中,发现有大量气泡冒出,该气泡能使带火星的木条复燃。
加快或减慢
二、催化剂和催化作用
1.催化剂和催化作用
能够改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后不变的物质叫催化剂。催化剂在化学反应中所起的作用叫催化作用。
汽车排气管中的催化剂
某些抗衰老化妆品中含有催化剂
2.催化剂的应用
观察与思考
(1)观察下列几幅图片,它们属于什么变化?
(2)这些变化都与哪种物质有关?
铁生锈
动植物呼吸
燃料燃烧
三、氧气的性质
1.氧气的物理性质
2.氧气的化学性质
【实验一】氧气与木炭反应
结论:木炭在氧气中燃烧比在空气中更剧烈,反应产物为二氧化碳。
【实验二】氧气与铁丝反应
结论:铁丝在空气中不燃烧,在氧气中剧烈燃烧,生成黑色的四氧化三铁。
【实验三】氧气与蜡烛反应
结论:蜡烛在氧气中燃烧比在空气中燃烧更剧烈,产物为二氧化碳。
3.氧化反应与氧化物
1.在自然界中,许多物质都能与氧气反应而消耗氧气,那么空气中的氧气是否会因此而减少呢?
2.鱼缸内养的鱼多了,鱼会因缺氧而死亡,有哪些办法可让鱼缸内的氧气增多?
?
四、自然界中氧循环
1.氧循环
2.缓慢氧化
(1)定义
有些氧化反应进行得非常缓慢。甚至不容易被察觉,这种氧化反应称为缓慢氧化。
(2)氧化反应和剧烈氧化、缓慢氧化的关系
课后练习
1.下列关于催化剂的说法正确的是( D )
A.二氧化锰是催化剂。
B.催化剂能加快化学反应速率,增加生成物的质量。
C.没有催化剂,过氧化氢就不能产生氧气。
D.在过氧化氢制氧气的反应中,二氧化锰起催化作 用
2.一氧化氮在常温下是一种难溶于水的气体,密度比空气略大;它在空气中能跟氧气迅速反应生成二氧化氮。现要收集一氧化氮气体可采用的方法是( B )
A.向上排空气法。
B.排水法。
C.排水法或向上排空气法。
D.排水法或向下排空气法。
3.实验室制取氧气的实验步骤:
(1)连接装置,检查___________ _;
(2)向锥形瓶中加入__________;
(3)塞好带有分液漏斗和导气管的橡皮塞;
(4)向分液漏斗中加入___________;
(5)等导管口有__________ _产生时,再收集氧气。
装置的气密性
二氧化锰
过氧化氢
连续均匀气泡
4.下面是实验室用双氧水和二氧化锰制取氧气及探究其化学性质的装置图:请回答:
(1)写出标号①仪器的名称是 试管 。
(2)实验室制取氧气应选用的发生装置是 B ;收集装置可选用D装置,理由是 氧气的密度比空气大 ;如果用E装置收集氧气,气体应从 b (填“a”或“b”)进入。
(3)写出实验室制取氧气的文字表达
式 。
(4)观察F装置中的实验现象:红磷在氧气中剧烈燃烧,产生大量白烟,这是因为生成了__P2O5___ (填化学式)的固体小颗粒的缘故。
第四单元 我们周围的空气
第三节 氧气
无影无形摸不着,
火焰见它跳得高。
呼吸作用它参加,
动物生长离不了。
猜猜它是谁?
回忆
工业制氧气:
H2O H2 O2
通电分解水:
分离液态空气法
通电
水
氢气 + 氧气
一、氧气的实验室制法
1.实验室制取气体的一般思路
(1)选择反应原理的原则
【思考】你认为下列哪些物质可作为实验室制取氧气的物质?
1.水(H2O)
2.二氧化碳(CO2)
3.食盐(主要成分为NaCl)
4.高锰酸钾(KMnO4)
5.过氧化氢(H2O2)
6.甲烷(CH4)
7.氯酸钾(KClO3)
(2)确定实验装置的原则
①发生装置
②收集装置
(3)检验气体(氧气)
2.实验室分解过氧化氢制取氧气
(1)反应原理
(2)实验装置
(3)检验
将带火星的木条伸入集气瓶中,若带火星的木条复燃,证明瓶中气体为氧气。
(4)实验室制取氧气的其他方法
交流反思:实验中的注意事项
1.实验前应首先检查装置的气密性;
2.导管刚露出橡皮塞即可;
3.当导管口有连续、均匀的气泡产生时,再收集气体;
4.取出后的集气瓶应正放。
发现问题:
你的猜想:
过氧化氢
水+氧气
反应速率慢
有什么办法可以让过氧化氢反应的速率加快吗?
提高过氧化氢的浓度;
提高温度;
向过氧化氢溶液中加入某物质。
过氧化氢溶液
观察:向两支试管中分别倒入过氧化氢溶液,再向其中一支试管加入少量二氧化锰粉末,将带火星的木条伸入试管口,观察现象。
实验探究:
二氧化锰
选用药品 产生气体
速率 能否使带火星的木条复燃
过氧化氢
过氧化氢
和二氧化锰
实验现象
慢
快
否
能
获得结论:最适合在实验室制取氧气的方法是在过 氧化氢溶液中加入二氧化锰。
小资料
1.将反应后的二氧化锰过滤、干燥、称量,发现二氧化锰的质量不发生改变。
2.将称量后的二氧化锰再次放入过氧化氢溶液中,发现有大量气泡冒出,该气泡能使带火星的木条复燃。
加快或减慢
二、催化剂和催化作用
1.催化剂和催化作用
能够改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后不变的物质叫催化剂。催化剂在化学反应中所起的作用叫催化作用。
汽车排气管中的催化剂
某些抗衰老化妆品中含有催化剂
2.催化剂的应用
观察与思考
(1)观察下列几幅图片,它们属于什么变化?
(2)这些变化都与哪种物质有关?
铁生锈
动植物呼吸
燃料燃烧
三、氧气的性质
1.氧气的物理性质
2.氧气的化学性质
【实验一】氧气与木炭反应
结论:木炭在氧气中燃烧比在空气中更剧烈,反应产物为二氧化碳。
【实验二】氧气与铁丝反应
结论:铁丝在空气中不燃烧,在氧气中剧烈燃烧,生成黑色的四氧化三铁。
【实验三】氧气与蜡烛反应
结论:蜡烛在氧气中燃烧比在空气中燃烧更剧烈,产物为二氧化碳。
3.氧化反应与氧化物
1.在自然界中,许多物质都能与氧气反应而消耗氧气,那么空气中的氧气是否会因此而减少呢?
2.鱼缸内养的鱼多了,鱼会因缺氧而死亡,有哪些办法可让鱼缸内的氧气增多?
?
四、自然界中氧循环
1.氧循环
2.缓慢氧化
(1)定义
有些氧化反应进行得非常缓慢。甚至不容易被察觉,这种氧化反应称为缓慢氧化。
(2)氧化反应和剧烈氧化、缓慢氧化的关系
课后练习
1.下列关于催化剂的说法正确的是( D )
A.二氧化锰是催化剂。
B.催化剂能加快化学反应速率,增加生成物的质量。
C.没有催化剂,过氧化氢就不能产生氧气。
D.在过氧化氢制氧气的反应中,二氧化锰起催化作 用
2.一氧化氮在常温下是一种难溶于水的气体,密度比空气略大;它在空气中能跟氧气迅速反应生成二氧化氮。现要收集一氧化氮气体可采用的方法是( B )
A.向上排空气法。
B.排水法。
C.排水法或向上排空气法。
D.排水法或向下排空气法。
3.实验室制取氧气的实验步骤:
(1)连接装置,检查___________ _;
(2)向锥形瓶中加入__________;
(3)塞好带有分液漏斗和导气管的橡皮塞;
(4)向分液漏斗中加入___________;
(5)等导管口有__________ _产生时,再收集氧气。
装置的气密性
二氧化锰
过氧化氢
连续均匀气泡
4.下面是实验室用双氧水和二氧化锰制取氧气及探究其化学性质的装置图:请回答:
(1)写出标号①仪器的名称是 试管 。
(2)实验室制取氧气应选用的发生装置是 B ;收集装置可选用D装置,理由是 氧气的密度比空气大 ;如果用E装置收集氧气,气体应从 b (填“a”或“b”)进入。
(3)写出实验室制取氧气的文字表达
式 。
(4)观察F装置中的实验现象:红磷在氧气中剧烈燃烧,产生大量白烟,这是因为生成了__P2O5___ (填化学式)的固体小颗粒的缘故。
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
