人教版化学九年级上册课件 第四单元课题3《水的组成》 (共28张PPT)
文档属性
| 名称 | 人教版化学九年级上册课件 第四单元课题3《水的组成》 (共28张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 8.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-15 15:33:28 | ||
图片预览







文档简介
(共28张PPT)
课题3 水的组成
人教版九年级化学 第四单元 自然界的水
掌握氢气的物理性质、化学性质、用途
观察电解水的实验,掌握实验名称、目的、仪器、反应原理、步骤、现象、检验、结论。
从化合、分解等两个角度认识物质的组成,掌握其理论依据
认识物质的简单分类。学会判断单质、化合物、氧化物、含氧化合物。
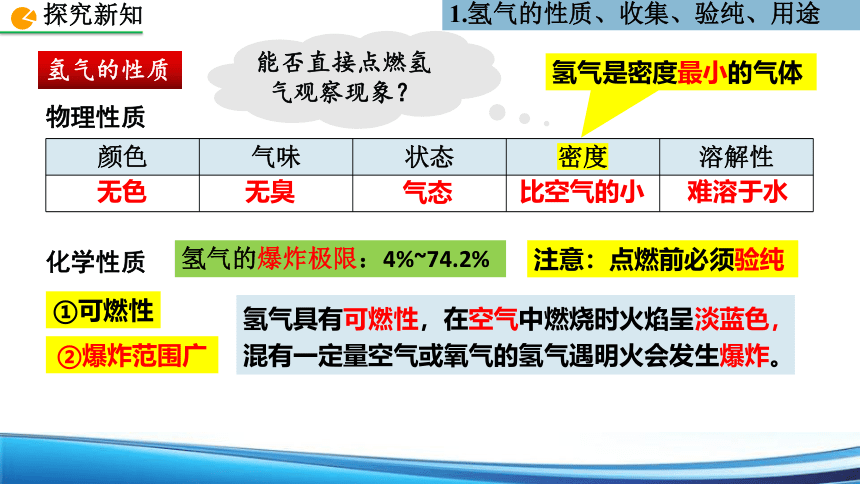
氢气的性质
颜色 气味 状态 密度 溶解性
比空气的小
无色
难溶于水
气态
无臭
物理性质
化学性质
氢气具有可燃性,在空气中燃烧时火焰呈淡蓝色,
混有一定量空气或氧气的氢气遇明火会发生爆炸。
氢气的爆炸极限:4%~74.2%
能否直接点燃氢气观察现象?
1.氢气的性质、收集、验纯、用途
注意:点燃前必须验纯
①可燃性
②爆炸范围广
氢气是密度最小的气体
家中燃气泄漏应该怎么做?
首先关闭阀门
发生燃气泄漏禁止动用明火及一切电器开关
严禁在室内拨打电话,以防产生静电火花引起爆炸
打开门窗,让室内通风降低泄漏的燃气浓度,并迅速撤离现场
到户外拨打报警电话
思考:
氢气的收集:
排水法
向下排空气法
1.氢气的性质、收集、验纯、用途
氢气的收集:
排水法,向下排空气法
用拇指堵住集满氢气的试管口,管口向下,靠近火焰,移开拇指点火。
发出尖锐的爆鸣声表明氢气不纯;声音很小则表明氢气较纯。
1.氢气的性质、收集、验纯、用途
氢气的验纯(操作+现象+结论):
氢气在空气中燃烧
操作 在带尖嘴的导管口点燃氢气,然后罩一个干而冷的烧杯。
实验现象
纯净的氢气在空气中燃烧,发出淡蓝色火焰,放出大量热,杯壁上有水雾生成。
氢气+氧气 水
点燃
文字表达式:
化学变化前后,元素种类不变
实验结论:
水是由氢元素和氧元素组成的
1.氢气的性质、收集、验纯、用途
判断依据:
实验4-5
①具有可燃性,
可以作高能燃料
②密度比空气小,
可以填充气球
氢气的用途
1.氢气的性质、收集、验纯、用途
性质决定用途
水的电解(电解水实验)
实验名称:
探究水的组成
实验目的:
直流电源、电解器
实验仪器:
实验步骤:
在电解器玻璃管里加满水,接通直流电源,观察并记录两个电极附近和玻璃管内发生的现象。
水中会加入少量硫酸钠或氢氧化钠以增强导电性。
2.电解水实验
探究水的组成
两电极 正极端的玻璃管 负极端的玻璃管
现象
比较两玻璃管中现象差异 产生气泡
产生气泡的速度慢
产生气泡的速度快
正极与负极产生的气体的体积比是1:2
实验现象:
正负极各生成了什么气体?如何进行检验?
气体检验:
正氧负氢、氢二氧一
燃着的木条
正极端玻璃管 负极端玻璃管
现象
解释
木条燃烧更旺
产生的气体是氧气
能燃烧,发出淡蓝色的火焰
产生的气体是氢气
2.电解水实验
水 氢气+氧气
通电
文字表达式:
化学变化前后,元素种类不变
实验结论:
水是由氢元素和氧元素组成的
气体检验(操作+现象+结论)
切断电源,用燃着的木条分别在两个玻璃管尖嘴口检验电解反应中生成的气体。
正极产生的气体能使木条燃烧更剧烈,说明该气体是氧气;
负极产生的气体可以燃烧,产生淡蓝色火焰,说明该气体是氢气。
判断依据:
2.电解水实验
思考:
2.电解水实验
1.上述实验中水是否发生了分解反应?生成了几种新物质?
2.分析水的生成和分解实验,说明其中的哪些现象和事实能够说明水不是一种元素,是由氢、氧两种元素组成的?
水发生了分解反应,生成了两种物质。
水是由氢、氧两种元素组成的
H2
O2
H
O
2
氢气+氧气 水
点燃
H2
O2
H
O
2
水 氢气+氧气
通电
1.实验过程中产生的氧气和氢气的体积比往往略小于1:2,可能的原因有哪些?
资料:20摄氏度时1000L水溶解氢气0.001mL; 20摄氏度时1000L水溶解氧气31mL;
①氧气在水中的溶解能力比氢气强
②氧气与电极材料发生反应
思考:
2.电解水实验
不易溶>难溶
水电解后,生成 和 :
与电源正极相连的试管内收集到的气体是 。
与电源负极相连的试管内收集到的气体是 。
V(H2)∶V(O2)= 。
与电源 相连的试管内收集到的气体可以燃烧。
氢气
氧气
氧气
氢气
2∶1
正氧负氢、氢二氧一
负极
电解水反应的微观实质
在通电的条件下水分子分解成氢原子和氧原子。
每两个氧原子结合形成一个氧分子,许多氧分子聚集成氧气;
每两个氢原子结合形成一个氢分子,许多氢分子聚集成氢气。
1.下列关于氢气在空气中燃烧的现象叙述错误的是( )
A.在火焰上方罩一个小烧杯,烧杯内壁有小液滴出现
B.放出大量的热
C.产物是水
D.产生淡蓝色火焰
C
2.下列关于电解水的叙述中错误的是( )
A.为增强水的导电性,常在水中加入一定量的氢氧化钠溶液
B.在水电解器中加满水,然后接通直流电源
C.电解水的实验证明水是由氢、氧两种元素组成的
D.与电源正极相连的玻璃管内得到的气体能在空气中燃烧
D
①符合客观事实 (空气≠氧气;烟≠雾;光≠火焰)
②不能出现产物名称
注意:
1.如何检验图一装置中正极产生的气体?
思考:
①结合具体题目作答,不可死记硬背,出现活塞、尖嘴等字眼
注意:
第一组:氢气(H2)、氧气(O2) 、氮气(N2)、铁(Fe)、碳(C)
第二组:二氧化碳(CO2)、氯化钠(NaCl) 、高锰酸钾(KMnO4)
第三组:二氧化碳(CO2)、氧化铁(Fe2O3)、水(H2O)
第一组的特点是 ;
第二组的特点是 ;
第三组的特点是 。
由同种元素组成
由两种或两种以上元素组成
由两种元素组成,其中一种是氧元素
3.物质的分类
思考:
请比较以下三组纯净物的元素组成,各有什么特点?
都是纯净物
3.物质的分类
单质
由同种元素组成的纯净物
化合物
由两种或两种以上元素组成的纯净物
举例:水(H2O)、二氧化碳(CO2)、高锰酸钾(KMnO4)
举例:氢气(H2)、氮气(N2)、氧气(O2)
氧化物
由两种元素组成的化合物,其中一种元素是氧元素的叫做氧化物。
举例:氧化铁(Fe2O3)、水(H2O)、二氧化碳( CO2 )
高锰酸钾是氧化物吗?
3.物质的分类
二氧化碳(CO2)
二氧化硫(SO2)
五氧化二磷(P2O5)
氯酸钾(KClO3 )
高锰酸钾(KMnO4)
下列化合物在元素组成上有什么共同点?
含有氧元素的化合物
既是含氧化合物,也是氧化物
是含氧化合物,但不是氧化物
思考:
含氧化合物
含氧化合物不一定是氧化物,但氧化物一定是含氧化合物。
单质中只含有一种元素,则由一种元素组成的物质一定是单质
2.化合物中含不同种元素,所以含不同种元素的物质都是化合物
3.由同种元素组成的物质可能是单质、也可能是混合物,但一定不是化合物
4.氧化物中含有氧元素,所以含有氧元素的物质一定是氧化物
5.氧化物中都含有氧元素,故含氧元素的化合物一定是氧化物
×。O2、O3的混合气体
“单质”、“化合物”的概念是建立在纯净物的基础之上的。
注意:
×。也有可能是混合物,如空气
3.物质的分类
√。
含氧化合物不一定是氧化物,但氧化物一定是含氧化合物。
注意:
×。也可能是单质(O2)、含氧化合物(KMnO4)、混合物(空气)
×。
判断正误,并说明理由。
物质
混合物:
纯净物
(由多种物质组成)
单质
化合物
氧化物
其他化合物
(注意分类标准)
金属单质(Fe、Cu、Al等)
非金属单质( O2、N2、C、S等)
稀有气体( He、Ne、Ar等)
3.物质的分类
典例1
“ ”和“ ”表示不同元素的原子,图中表示单质的是( )
C
课后习题T3、T4
练习
1.下列微观模拟图中的 和 分别表示氢原子和氧原子,则有关说法正确的是( )
A. ①②均为混合物
B. 只有③是单质
C. ①④均是化合物
D. ④在一定条件下可分解成②和⑤
D
3.物质的分类
单质 化合物
概念 由同种元素组成的纯净物 组成中含有不同种元素的纯净物
共同点 都属于纯净物 区别 宏观组成 由同种元素组成 由不同种元素组成
微观构成 单质分子:由同种元素的原子构成 化合物分子:由不同种元素的原子构成
举例 氧气(O2)、氢气(H2)、 铁(Fe) 二氧化碳(CO2)、水(H2O)、
高锰酸钾(KMnO4)
联系 二者都属于纯净物,某些单质在一定条件下发生化合反应可以生成化合物,某些化合物在一定条件下发生分解反应可以生成单质 2. 下列各组物质,按混合物、单质顺序排列的是( )
A. 海水、干冰 B. 冰水、水银
C. 食醋、黄铜 D. 煤、金刚石
D
1.下列各组物质中,前者是化合物,后者是单质的是( )
A.氮气 二氧化锰 B.二氧化碳 氧气
C.空气 硫 D.冰 水
B
3.下列物质按照单质、混合物、氧化物的顺序排列的是( )
A.水银、雨水、水 B.稀有气体、高锰酸钾、二氧化硫
C.氮气、空气、酒 D.硫磺、氧化镁、二氧化碳
A
4.化学概念在逻辑上可能存在下图所示的关系,说法正确的是( )
A.纯净物与混合物属于包含关系
B.化合物与氧化物属于并列关系
C.单质与化合物属于交叉关系
D.化合反应与分解反应属于并列关系
5.鉴别H2、O2、N2、空气四种气体最好选用( )
A.用燃着的木条分别伸入气体中 B.嗅其气味
C.用带火星木条分别伸入气体中 D.观察其颜色和状态
D
A
判断下列物质的所属类别。
1.二氧化碳2.水3.空气4.氧气5.氮气6.稀有气体7.碳8.硫9.二氧化硫10.一氧化碳 11.四氧化三铁12.磷13.五氧化二磷14.高锰酸钾15.锰酸钾16.二氧化锰17.过氧化氢18.双氧水19.氯酸钾20.氯化钾21.浓氨水22.蒸馏水23.海水24.氯化钠25.硫酸铜26.汞27.氧化汞28.碳酸钙29.铁30.铁水
混合物: 。
纯净物: 。
单质: 。
化合物: 。
含氧化合物: 。
氧化物: 。
课题3 水的组成
人教版九年级化学 第四单元 自然界的水
掌握氢气的物理性质、化学性质、用途
观察电解水的实验,掌握实验名称、目的、仪器、反应原理、步骤、现象、检验、结论。
从化合、分解等两个角度认识物质的组成,掌握其理论依据
认识物质的简单分类。学会判断单质、化合物、氧化物、含氧化合物。
氢气的性质
颜色 气味 状态 密度 溶解性
比空气的小
无色
难溶于水
气态
无臭
物理性质
化学性质
氢气具有可燃性,在空气中燃烧时火焰呈淡蓝色,
混有一定量空气或氧气的氢气遇明火会发生爆炸。
氢气的爆炸极限:4%~74.2%
能否直接点燃氢气观察现象?
1.氢气的性质、收集、验纯、用途
注意:点燃前必须验纯
①可燃性
②爆炸范围广
氢气是密度最小的气体
家中燃气泄漏应该怎么做?
首先关闭阀门
发生燃气泄漏禁止动用明火及一切电器开关
严禁在室内拨打电话,以防产生静电火花引起爆炸
打开门窗,让室内通风降低泄漏的燃气浓度,并迅速撤离现场
到户外拨打报警电话
思考:
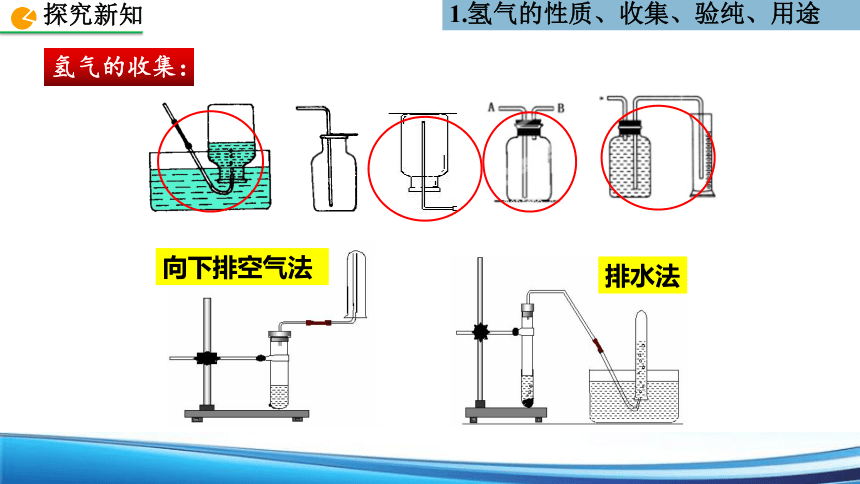
氢气的收集:
排水法
向下排空气法
1.氢气的性质、收集、验纯、用途
氢气的收集:
排水法,向下排空气法
用拇指堵住集满氢气的试管口,管口向下,靠近火焰,移开拇指点火。
发出尖锐的爆鸣声表明氢气不纯;声音很小则表明氢气较纯。
1.氢气的性质、收集、验纯、用途
氢气的验纯(操作+现象+结论):
氢气在空气中燃烧
操作 在带尖嘴的导管口点燃氢气,然后罩一个干而冷的烧杯。
实验现象
纯净的氢气在空气中燃烧,发出淡蓝色火焰,放出大量热,杯壁上有水雾生成。
氢气+氧气 水
点燃
文字表达式:
化学变化前后,元素种类不变
实验结论:
水是由氢元素和氧元素组成的
1.氢气的性质、收集、验纯、用途
判断依据:
实验4-5
①具有可燃性,
可以作高能燃料
②密度比空气小,
可以填充气球
氢气的用途
1.氢气的性质、收集、验纯、用途
性质决定用途
水的电解(电解水实验)
实验名称:
探究水的组成
实验目的:
直流电源、电解器
实验仪器:
实验步骤:
在电解器玻璃管里加满水,接通直流电源,观察并记录两个电极附近和玻璃管内发生的现象。
水中会加入少量硫酸钠或氢氧化钠以增强导电性。
2.电解水实验
探究水的组成
两电极 正极端的玻璃管 负极端的玻璃管
现象
比较两玻璃管中现象差异 产生气泡
产生气泡的速度慢
产生气泡的速度快
正极与负极产生的气体的体积比是1:2
实验现象:
正负极各生成了什么气体?如何进行检验?
气体检验:
正氧负氢、氢二氧一
燃着的木条
正极端玻璃管 负极端玻璃管
现象
解释
木条燃烧更旺
产生的气体是氧气
能燃烧,发出淡蓝色的火焰
产生的气体是氢气
2.电解水实验
水 氢气+氧气
通电
文字表达式:
化学变化前后,元素种类不变
实验结论:
水是由氢元素和氧元素组成的
气体检验(操作+现象+结论)
切断电源,用燃着的木条分别在两个玻璃管尖嘴口检验电解反应中生成的气体。
正极产生的气体能使木条燃烧更剧烈,说明该气体是氧气;
负极产生的气体可以燃烧,产生淡蓝色火焰,说明该气体是氢气。
判断依据:
2.电解水实验
思考:
2.电解水实验
1.上述实验中水是否发生了分解反应?生成了几种新物质?
2.分析水的生成和分解实验,说明其中的哪些现象和事实能够说明水不是一种元素,是由氢、氧两种元素组成的?
水发生了分解反应,生成了两种物质。
水是由氢、氧两种元素组成的
H2
O2
H
O
2
氢气+氧气 水
点燃
H2
O2
H
O
2
水 氢气+氧气
通电
1.实验过程中产生的氧气和氢气的体积比往往略小于1:2,可能的原因有哪些?
资料:20摄氏度时1000L水溶解氢气0.001mL; 20摄氏度时1000L水溶解氧气31mL;
①氧气在水中的溶解能力比氢气强
②氧气与电极材料发生反应
思考:
2.电解水实验
不易溶>难溶
水电解后,生成 和 :
与电源正极相连的试管内收集到的气体是 。
与电源负极相连的试管内收集到的气体是 。
V(H2)∶V(O2)= 。
与电源 相连的试管内收集到的气体可以燃烧。
氢气
氧气
氧气
氢气
2∶1
正氧负氢、氢二氧一
负极
电解水反应的微观实质
在通电的条件下水分子分解成氢原子和氧原子。
每两个氧原子结合形成一个氧分子,许多氧分子聚集成氧气;
每两个氢原子结合形成一个氢分子,许多氢分子聚集成氢气。
1.下列关于氢气在空气中燃烧的现象叙述错误的是( )
A.在火焰上方罩一个小烧杯,烧杯内壁有小液滴出现
B.放出大量的热
C.产物是水
D.产生淡蓝色火焰
C
2.下列关于电解水的叙述中错误的是( )
A.为增强水的导电性,常在水中加入一定量的氢氧化钠溶液
B.在水电解器中加满水,然后接通直流电源
C.电解水的实验证明水是由氢、氧两种元素组成的
D.与电源正极相连的玻璃管内得到的气体能在空气中燃烧
D
①符合客观事实 (空气≠氧气;烟≠雾;光≠火焰)
②不能出现产物名称
注意:
1.如何检验图一装置中正极产生的气体?
思考:
①结合具体题目作答,不可死记硬背,出现活塞、尖嘴等字眼
注意:
第一组:氢气(H2)、氧气(O2) 、氮气(N2)、铁(Fe)、碳(C)
第二组:二氧化碳(CO2)、氯化钠(NaCl) 、高锰酸钾(KMnO4)
第三组:二氧化碳(CO2)、氧化铁(Fe2O3)、水(H2O)
第一组的特点是 ;
第二组的特点是 ;
第三组的特点是 。
由同种元素组成
由两种或两种以上元素组成
由两种元素组成,其中一种是氧元素
3.物质的分类
思考:
请比较以下三组纯净物的元素组成,各有什么特点?
都是纯净物
3.物质的分类
单质
由同种元素组成的纯净物
化合物
由两种或两种以上元素组成的纯净物
举例:水(H2O)、二氧化碳(CO2)、高锰酸钾(KMnO4)
举例:氢气(H2)、氮气(N2)、氧气(O2)
氧化物
由两种元素组成的化合物,其中一种元素是氧元素的叫做氧化物。
举例:氧化铁(Fe2O3)、水(H2O)、二氧化碳( CO2 )
高锰酸钾是氧化物吗?
3.物质的分类
二氧化碳(CO2)
二氧化硫(SO2)
五氧化二磷(P2O5)
氯酸钾(KClO3 )
高锰酸钾(KMnO4)
下列化合物在元素组成上有什么共同点?
含有氧元素的化合物
既是含氧化合物,也是氧化物
是含氧化合物,但不是氧化物
思考:
含氧化合物
含氧化合物不一定是氧化物,但氧化物一定是含氧化合物。
单质中只含有一种元素,则由一种元素组成的物质一定是单质
2.化合物中含不同种元素,所以含不同种元素的物质都是化合物
3.由同种元素组成的物质可能是单质、也可能是混合物,但一定不是化合物
4.氧化物中含有氧元素,所以含有氧元素的物质一定是氧化物
5.氧化物中都含有氧元素,故含氧元素的化合物一定是氧化物
×。O2、O3的混合气体
“单质”、“化合物”的概念是建立在纯净物的基础之上的。
注意:
×。也有可能是混合物,如空气
3.物质的分类
√。
含氧化合物不一定是氧化物,但氧化物一定是含氧化合物。
注意:
×。也可能是单质(O2)、含氧化合物(KMnO4)、混合物(空气)
×。
判断正误,并说明理由。
物质
混合物:
纯净物
(由多种物质组成)
单质
化合物
氧化物
其他化合物
(注意分类标准)
金属单质(Fe、Cu、Al等)
非金属单质( O2、N2、C、S等)
稀有气体( He、Ne、Ar等)
3.物质的分类
典例1
“ ”和“ ”表示不同元素的原子,图中表示单质的是( )
C
课后习题T3、T4
练习
1.下列微观模拟图中的 和 分别表示氢原子和氧原子,则有关说法正确的是( )
A. ①②均为混合物
B. 只有③是单质
C. ①④均是化合物
D. ④在一定条件下可分解成②和⑤
D
3.物质的分类
单质 化合物
概念 由同种元素组成的纯净物 组成中含有不同种元素的纯净物
共同点 都属于纯净物 区别 宏观组成 由同种元素组成 由不同种元素组成
微观构成 单质分子:由同种元素的原子构成 化合物分子:由不同种元素的原子构成
举例 氧气(O2)、氢气(H2)、 铁(Fe) 二氧化碳(CO2)、水(H2O)、
高锰酸钾(KMnO4)
联系 二者都属于纯净物,某些单质在一定条件下发生化合反应可以生成化合物,某些化合物在一定条件下发生分解反应可以生成单质 2. 下列各组物质,按混合物、单质顺序排列的是( )
A. 海水、干冰 B. 冰水、水银
C. 食醋、黄铜 D. 煤、金刚石
D
1.下列各组物质中,前者是化合物,后者是单质的是( )
A.氮气 二氧化锰 B.二氧化碳 氧气
C.空气 硫 D.冰 水
B
3.下列物质按照单质、混合物、氧化物的顺序排列的是( )
A.水银、雨水、水 B.稀有气体、高锰酸钾、二氧化硫
C.氮气、空气、酒 D.硫磺、氧化镁、二氧化碳
A
4.化学概念在逻辑上可能存在下图所示的关系,说法正确的是( )
A.纯净物与混合物属于包含关系
B.化合物与氧化物属于并列关系
C.单质与化合物属于交叉关系
D.化合反应与分解反应属于并列关系
5.鉴别H2、O2、N2、空气四种气体最好选用( )
A.用燃着的木条分别伸入气体中 B.嗅其气味
C.用带火星木条分别伸入气体中 D.观察其颜色和状态
D
A
判断下列物质的所属类别。
1.二氧化碳2.水3.空气4.氧气5.氮气6.稀有气体7.碳8.硫9.二氧化硫10.一氧化碳 11.四氧化三铁12.磷13.五氧化二磷14.高锰酸钾15.锰酸钾16.二氧化锰17.过氧化氢18.双氧水19.氯酸钾20.氯化钾21.浓氨水22.蒸馏水23.海水24.氯化钠25.硫酸铜26.汞27.氧化汞28.碳酸钙29.铁30.铁水
混合物: 。
纯净物: 。
单质: 。
化合物: 。
含氧化合物: 。
氧化物: 。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
