6.2 物质的溶解性(第1课时)课件--2022-2023学年九年级化学仁爱版上册(共19张PPT)
文档属性
| 名称 | 6.2 物质的溶解性(第1课时)课件--2022-2023学年九年级化学仁爱版上册(共19张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 368.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-14 09:48:02 | ||
图片预览





文档简介
(共19张PPT)
6.2 物质的溶解性
仁爱版化学九年级(上)
1.了解溶解性的概念,理解影响溶解性的因素;
2.理解饱和溶液与不饱和溶液的概念及相互关系;
3.了解结晶现象及常用的结晶方法
4.理解固体物质溶解度的含义。
学习目标
重点
1.影响溶解性的几个因素;
2.饱和溶液的概念;
难点
溶解度的定义。
课堂引入
一杯水能溶解多少氯化钠呢 物质能不能无限制的溶解在一定量的水中呢 根据日常生活经验,思考提出的问题。
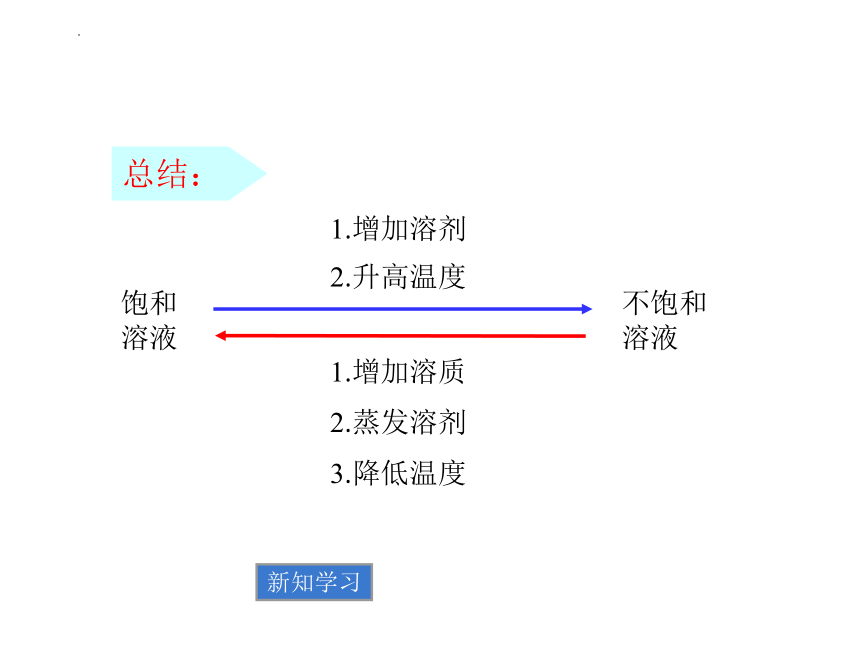
1.增加溶剂
2.升高温度
1.增加溶质
2.蒸发溶剂
3.降低温度
饱和溶液
不饱和溶液
总结:
新知学习
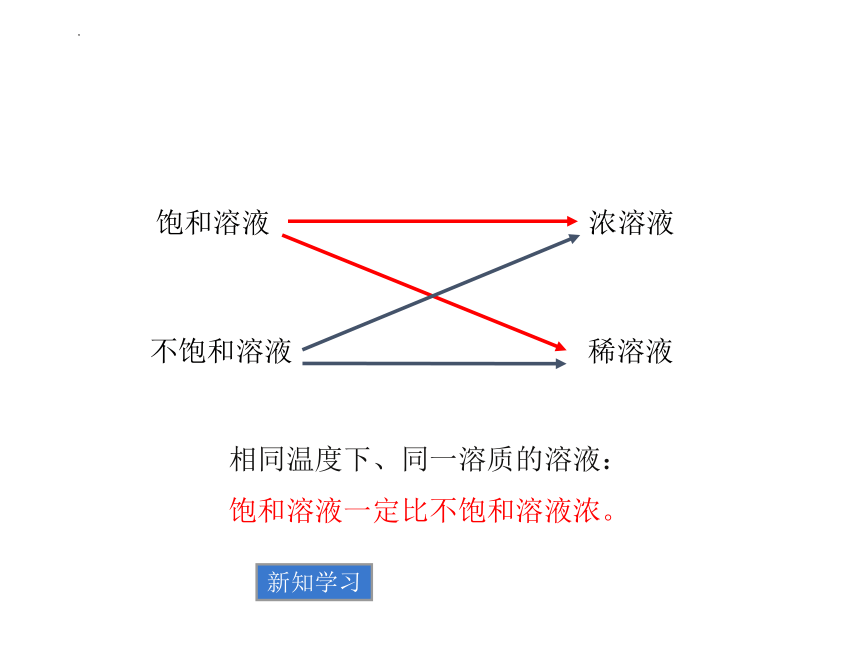
讨论:有人说饱和溶液一定就是浓溶液、稀溶液肯定是不饱和的,你认为对吗?
新知学习
饱和溶液
稀溶液
不饱和溶液
浓溶液
相同温度下、同一溶质的溶液:
饱和溶液一定比不饱和溶液浓。
新知学习
硝酸钾晶体
冷却热饱和溶液
二、溶质的析出
雪花晶体
新知学习
海水
贮水池
蒸发池
结晶池
食盐
母液
氯化钠
多种化工产品
从海水中提取食盐
蒸发溶剂
新知学习
结晶: 溶解在溶液里的溶质以晶体的形式析出,叫做结晶。
结晶的方法:
1.蒸发溶剂法
2.冷却热饱和溶液法
新知学习
三、溶解度
食盐和硝酸钾都易溶解在水中,那么,
谁溶解得更多呢?
NaCl
KNO3
新知学习
讨论:在生活中,两个人的饭量都很大,如何比较?
结论:比较两人饭量的大小必须在相同的条件下比较。(饭的品种,碗的大小相同,都要吃饱等情况下)
由此可见要比较两种不同物质的溶解能力必须在相同的条件下才能作出比较。
新知学习
溶解度: 在一定温度下,某固态物质在 100 g 溶剂里,达到饱和状态时所溶解的质量。
包含四个要素:1.在一定温度下
2.在100克溶剂里
3.达到饱和
4.溶质的质量单位是克
新知学习
溶解性只是一般地说明某种物质在某种溶剂里溶解能力的大小,是物质的一种物理性质。通常用易溶、可溶、微溶、难溶或不溶等粗略的概念表示。
溶解度和溶解性的关系:
新知学习
溶解度 大于10g 1g—10g 0.01g—1g 小于0.01g
溶解性 易溶物质 可溶物质 微溶物质 难溶物质
固体物质溶解性的分类
新知学习
课堂小结
课堂小结
物质的溶解性
饱和溶液和
不饱和溶液
溶质的析出
溶解度
概念
判断方法
相互转化
结晶概念
结晶的方法
概念
四个要素
知能训练
知能训练
1.关于饱和溶液的说法正确的是 ( )
A.饱和溶液加热时会变成不饱和溶液
B.饱和溶液加热时仍然是饱和溶液
C.大多数物质的饱和溶液加热时会变成不饱和溶液
D.饱和溶液降温时,会有晶体析出
C
知能训练
2.在10℃时,25 g水最多可溶解20 g NaNO3,另一温度下,在50 g水中加入40 g NaNO3没有形成饱和溶液,其原因可能是( )
A.温度降低了 B.温度升高了
C.溶液质量相对增加了 D.溶质的质量相对减少
B
回顾本节课程内容。
02
01
课后练习题。
课后作业
6.2 物质的溶解性
仁爱版化学九年级(上)
1.了解溶解性的概念,理解影响溶解性的因素;
2.理解饱和溶液与不饱和溶液的概念及相互关系;
3.了解结晶现象及常用的结晶方法
4.理解固体物质溶解度的含义。
学习目标
重点
1.影响溶解性的几个因素;
2.饱和溶液的概念;
难点
溶解度的定义。
课堂引入
一杯水能溶解多少氯化钠呢 物质能不能无限制的溶解在一定量的水中呢 根据日常生活经验,思考提出的问题。
1.增加溶剂
2.升高温度
1.增加溶质
2.蒸发溶剂
3.降低温度
饱和溶液
不饱和溶液
总结:
新知学习
讨论:有人说饱和溶液一定就是浓溶液、稀溶液肯定是不饱和的,你认为对吗?
新知学习
饱和溶液
稀溶液
不饱和溶液
浓溶液
相同温度下、同一溶质的溶液:
饱和溶液一定比不饱和溶液浓。
新知学习
硝酸钾晶体
冷却热饱和溶液
二、溶质的析出
雪花晶体
新知学习
海水
贮水池
蒸发池
结晶池
食盐
母液
氯化钠
多种化工产品
从海水中提取食盐
蒸发溶剂
新知学习
结晶: 溶解在溶液里的溶质以晶体的形式析出,叫做结晶。
结晶的方法:
1.蒸发溶剂法
2.冷却热饱和溶液法
新知学习
三、溶解度
食盐和硝酸钾都易溶解在水中,那么,
谁溶解得更多呢?
NaCl
KNO3
新知学习
讨论:在生活中,两个人的饭量都很大,如何比较?
结论:比较两人饭量的大小必须在相同的条件下比较。(饭的品种,碗的大小相同,都要吃饱等情况下)
由此可见要比较两种不同物质的溶解能力必须在相同的条件下才能作出比较。
新知学习
溶解度: 在一定温度下,某固态物质在 100 g 溶剂里,达到饱和状态时所溶解的质量。
包含四个要素:1.在一定温度下
2.在100克溶剂里
3.达到饱和
4.溶质的质量单位是克
新知学习
溶解性只是一般地说明某种物质在某种溶剂里溶解能力的大小,是物质的一种物理性质。通常用易溶、可溶、微溶、难溶或不溶等粗略的概念表示。
溶解度和溶解性的关系:
新知学习
溶解度 大于10g 1g—10g 0.01g—1g 小于0.01g
溶解性 易溶物质 可溶物质 微溶物质 难溶物质
固体物质溶解性的分类
新知学习
课堂小结
课堂小结
物质的溶解性
饱和溶液和
不饱和溶液
溶质的析出
溶解度
概念
判断方法
相互转化
结晶概念
结晶的方法
概念
四个要素
知能训练
知能训练
1.关于饱和溶液的说法正确的是 ( )
A.饱和溶液加热时会变成不饱和溶液
B.饱和溶液加热时仍然是饱和溶液
C.大多数物质的饱和溶液加热时会变成不饱和溶液
D.饱和溶液降温时,会有晶体析出
C
知能训练
2.在10℃时,25 g水最多可溶解20 g NaNO3,另一温度下,在50 g水中加入40 g NaNO3没有形成饱和溶液,其原因可能是( )
A.温度降低了 B.温度升高了
C.溶液质量相对增加了 D.溶质的质量相对减少
B
回顾本节课程内容。
02
01
课后练习题。
课后作业
同课章节目录
- 专题一 走进化学殿堂
- 单元1 化学使生活更美好
- 单元2 如何学习化学
- 专题二 空气和水
- 单元1 多组分的空气
- 单元2 氧气
- 单元3 自然界的水
- 专题三 物质的构成
- 单元1 构成物质的微粒
- 单元2 组成物质的元素
- 单元3 纯净物组成的表示方法
- 专题四 燃料与燃烧
- 单元1 燃烧与灭火
- 单元2 碳及其化合物
- 单元3 化石燃料的利用
- 专题五 化学变化及其表示
- 单元1 化学变化是有条件的
- 单元2 质量守恒定律
- 单元3 化学方程式
- 专题六 物质的溶解
- 单元1 物质的溶解过程
- 单元2 物质的溶解性
- 单元3 物质的溶解性的改变
- 学生实验
- 实验1 实验基本操作
- 实验2 氧气的实验室制取与性质
- 实验3 燃烧的条件
- 实验4 二氧化碳的实验室制取与性质
- 实验5 一定浓度溶液的配置
