第三单元 物质构成的奥秘单元测试卷-2022-2023学年九年级化学人教版上册(含解析)
文档属性
| 名称 | 第三单元 物质构成的奥秘单元测试卷-2022-2023学年九年级化学人教版上册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 304.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-15 06:51:28 | ||
图片预览



文档简介
第三单元 物质构成的奥秘 单元测试卷
一、单选题
1.8班某同学活泼好动,智力低下,她妈带它去医院检查,医生告知:该娃缺锌、缺铁、缺钙,建议引用补铁、补锌、补钙口服液,这里的钙、铁、锌指的是
A.离子 B.原子 C.分子 D.元素
2.如图天平右盘中“▲”为一个C﹣12原子质量的 ,据图推断A原子的相对原子质量是
A. B.7 C.12 D.84
3.已知某碳原子的实际质量为mg,其相对原子质量为12。有一种硅原子(符号Si)的实际质量ng,则此种硅原子的相对原子质量的表达式为
A.g B.g C. D.
4.中国科学院院士张青莲教授主持测定了铕、铱等近十种元素的相对原子质量,为相对原子质量测定作出了卓越贡献,下列关于铕的说法中正确的是
A.原子序数为63 B.属于非金属元素
C.原子核外电子数为152 D.相对原子质量为152.0g
5.元素观是化学学科重要观念之一。下列有关元素的说法错误的是
A.Cl 与Cl-可以相互转化
B.混合物中一定含有多种元素
C.原子的质子数不同,则元素种类不同
D.元素周期表中,元素的原子序数与该元素的质子数在数值上相同
6.国之重器东风——41 弹道导弹采用了钛合金前后接头。钛原子质子数为22,相对原子质量为48,则钛原子的核外电子数为
A.22 B.26 C.48 D.70
7.钽元素(Ta)在周期表中的信息如图。下列有关说法错误的是
A.钽属于金属元素 B.钽原子在化学反应中容易失去电子
C.钽原子质量为180.9 D.钽原子的核外电子数为73
8.根据粒子结构示意图给出的信息,下列说法错误的是
A.①④是原子 B.②③具有相对稳定结构
C.②是阴离子 D.②④属于同种元素
9.航天员专用的小分子团水具有饮用量少、在人体内储留时间长、排放量少等特点。航天员一次饮用小分子团水,可维持人体正常需水量。下列关于小分子团水的说法中正确的是
A.水分子的化学性质被改变了
B.小分子团水的部分物理性质与普通水有所不同
C.小分子团水中水分子停止了运动
D.小分子团水中水分子间没有间隙
10.推理是研究和学习化学的一种重要方法。正电子、负质子都是反粒子,它们跟通常所说的电子、质子相比较,质量相等,但电性相反。科学家已发现反氢原子。你推测反氢原子的结构可能是
A.由一个带负电的质子和一个带正电的电子构成
B.由一个质子和一个电子构成
C.由一个带负电的质子和一个电子构成
D.由一个质子和一个带正电的电子构成
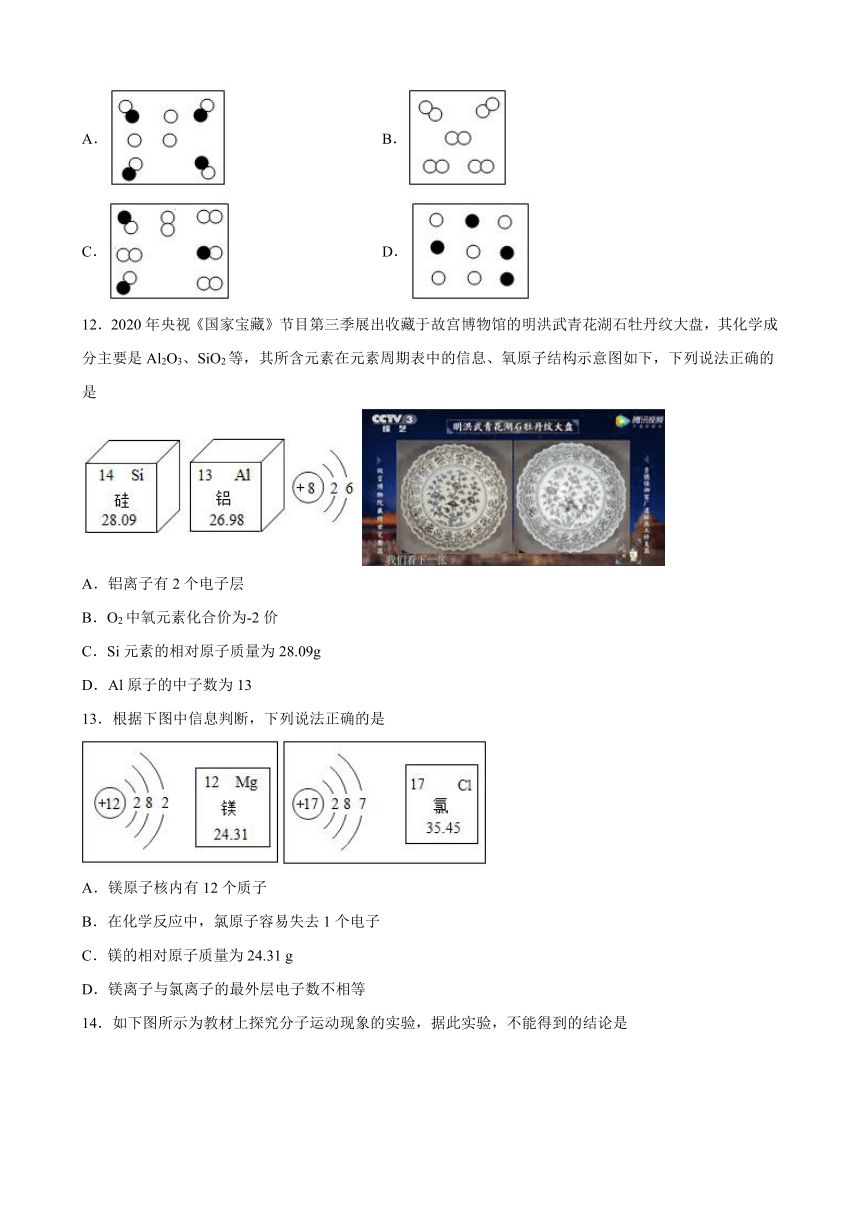
11.如图是表示气体粒子的示意图,“”和“”分别表示两种不同元素的原子,其中表示纯净物的是
A. B.
C. D.
12.2020年央视《国家宝藏》节目第三季展出收藏于故宫博物馆的明洪武青花湖石牡丹纹大盘,其化学成分主要是Al2O3、SiO2等,其所含元素在元素周期表中的信息、氧原子结构示意图如下,下列说法正确的是
A.铝离子有2个电子层
B.O2中氧元素化合价为-2价
C.Si元素的相对原子质量为28.09g
D.Al原子的中子数为13
13.根据下图中信息判断,下列说法正确的是
A.镁原子核内有12个质子
B.在化学反应中,氯原子容易失去1个电子
C.镁的相对原子质量为24.31 g
D.镁离子与氯离子的最外层电子数不相等
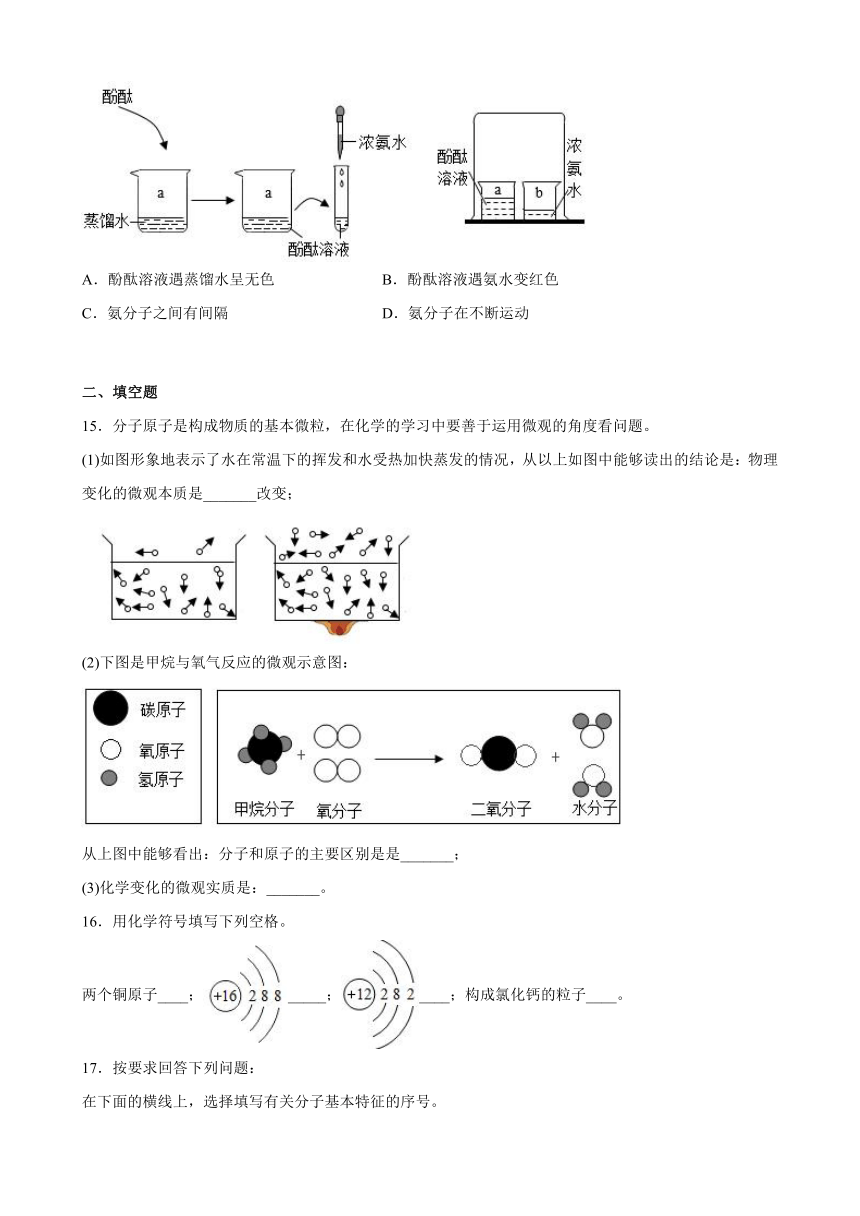
14.如下图所示为教材上探究分子运动现象的实验,据此实验,不能得到的结论是
A.酚酞溶液遇蒸馏水呈无色 B.酚酞溶液遇氨水变红色
C.氨分子之间有间隔 D.氨分子在不断运动
二、填空题
15.分子原子是构成物质的基本微粒,在化学的学习中要善于运用微观的角度看问题。
(1)如图形象地表示了水在常温下的挥发和水受热加快蒸发的情况,从以上如图中能够读出的结论是:物理变化的微观本质是_______改变;
(2)下图是甲烷与氧气反应的微观示意图:
从上图中能够看出:分子和原子的主要区别是是_______;
(3)化学变化的微观实质是:_______。
16.用化学符号填写下列空格。
两个铜原子____;_____;____;构成氯化钙的粒子____。
17.按要求回答下列问题:
在下面的横线上,选择填写有关分子基本特征的序号。
A、分子很小
B、分子之间有间隔
C、分子在不停运动
D、同种分子化学性质相同
(1)一滴水中约含有1.67×1021个水分子:____。
(2)湿衣服经晾晒一段时间后,衣服变干:_____。
(3)液氧和氧气都能助燃,支持燃烧:_____。
(4)气体可压缩储存于钢瓶中:_____。
18.下图是过氧化氢分子分解的示意图,请你从观察到的信息写出你所获得的化学知识。
(1)微观上:过氧化氢是由______构成的,一个过氧化氢分子是由________构成的;在化学反应前后分子的种类______(填“改变”或“不变”,下同),原子的种类_____________。
(2)宏观上:过氧化氢是由__________组成的,在化学反应前后,物质的种类 _________(填“改变”或“不变”,下同) ,元素的种类__________。
19.元素周期表是学习化学的重要工具。下表是元素周期表的一部分,请回答下列问题:
(1)原子序数为11的元素属于______(填“金属”或“非金属”)元素。
(2)原子序数为9的元素的原子结构示意图为______。
(3)地壳中含量最多的元素是______(填元素符号)。
(4)化学符号2OH-表示的意义为______。
三、计算题
20.已知一个碳12原子的质量为1.993×10-26kg,而一个氧原子质量为2.657× 10-26kg,镁原子的相对原子质量为24,求:
(1)该氧原子的相对原子质量_____。(列出计算过程,不需要计算结果)
(2)一个镁原子的实际质量_____。(列出计算过程,需要计算结果)
21.(1)已知一个碳-12原子的质量为1.993×10-26kg,一个镁原子的质量为3.986×10-26kg,试计算镁原子的相对原子质量。
(2)已知铁的相对原子质量为56,铜的相对原子质量为64,现有等质量的铁和铜,它们所含的原子个数比为多少?
22.某一个X原子的相对质量为56,一个C-12原子的质量1.993×10-26kg,该原子所形成离子X3+的核外电子数为23。
(1)该X原子质量(计算结果保留1位小数)
(2)该X原子的中子数。
参考答案:
1.D
【详解】“补钙”、“补铁”、“补锌”等字样的食品和保健品,这里的“钙、铁、锌”不是以单质、分子、原子等形式存在,这里所指的“钙、铁、锌、硒”是强调存在的元素,与具体形态无关。
故选:D。
2.B
【详解】相对原子质量的概念是以一种碳原子(即碳﹣12原子)质量的1/12作为标准,其它原子的质量(实际质量)跟它相比较所得的值,就称为该原子的相对原子质量。由图可知,天平平衡,故右盘中7个小块的总质量等于一个A原子的质量,而这个小块对应的是一个碳原子质量的1/12,则A原子的相对原子质量=。
故选:B。
3.D
【详解】相对原子质量是以一个碳﹣12原子质量的 作为标准,任何一个原子的真实质量跟一个碳﹣12原子质量的的比值,即 。
根据题意碳﹣12原子的实际质量的为,则此种硅原子的相对原子质量为 。
故选:D。
4.A
【详解】A、在元素周期表中,元素名称左上角的数字表示原子序数,故铕的原子序数为63,正确;
B、由铕元素的汉字名称中含有“钅”字旁可知,铕属于金属元素,错误;
C、在原子中,质子数=原子序数=核外电子数=63,错误;
D、在元素周期表中,元素名称下方的数字表示相对原子质量,相对原子质量是一个比值,单位为“1”,常省略不写,故铕的相对原子质量为152.0,错误。
故选A。
5.B
【详解】A、原子和离子可以相互转化,Cl得到电子变成氯离子,Cl-失去电子可以变成氯原子,Cl与Cl-可以相互转化;正确;
B、混合物是多种物质组成的,如氧气和臭氧在一起是混合物,但是它们都只含有氧元素一种元素,则混合物中不一定含有多种元素;错误;
C、元素是质子数(即核电荷数)相同的一类原子的总称,原子的质子数不同,则元素种类不同;正确;
D、元素周期表是按照原子序数依次增多的顺序排列起来的,原子序数与该元素的质子数在数值上相同;正确;
故选B。
6.A
【详解】原子中核电荷数=核内质子数=核外电子数,由题意钛原子的质子数为22,则钛原子的核外电子数为22。
故选A。
7.C
【详解】A、钽的偏旁部首是“钅”,因此属于金属元素,选项正确;
B、根据金属元素的最外层电子数一般小于4,在化学反应中容易失去电子,钽属于金属元素故钽原子在化学反应中容易失去电子,选项正确;
C、根据元素周期表最下面数字表示相对原子质量,如图所示,钽元素的相对原子质量为180.9,但相对原子质量不是原子的实际质量,因此选项错误;
D、根据元素周期表左上角数字表示原子序数,原子序数等于质子数,如图所示,钽元素的原子序数是73,因此钽原子的质子数是73,根据原子里质子数等于核外电子数,因此其核外电子数为73,选项正确;
故选:C。
8.C
【详解】A、根据原子中核电荷数=核内质子数=核外电子数,①质子数=8=2+6=核外电子数,表示原子;④质子数=11=2+8+1=核外电子数,表示原子;故A说法正确,不符合题意;
B、②③的最外层电子数均为8 ,具有相对稳定结构,故B说法正确,不符合题意;
C、②质子数=11大于核外电子数(2+8=10),表示阳离子,故C说法错误,符合题意;
D、元素是具有相同核电荷数(核内质子数)的一类原子的总称,②④质子数相同都是11,属于同种元素,故D说法正确,不符合题意。
故选C。
9.B
【分析】小分子团水和水一样都是由水分子构成的,也具有分子的基本特征:体积和质量都很小、分子之间存在间隔、分子是在不断运动的。
【详解】A、分子是保持物质化学性质的最小微粒,小分子团水也是由水分子构成的,其化学性质不变,故A不正确;
B、小分子团水具有普通水没有的特点,如“小分子团水具有饮用量少、在人体内储留时间长、排放量少等特点”,故其物理性质有部分与普通水有所不同,故B正确;
C、构成小分子团水的水分子是在不停地运动的,故C不正确;
D、小分子团水和水一样都是由水分子构成的,其分子之间存在一定的间隙,故D不正确。
故选B。
10.A
【详解】A、氢原子内有一个质子和一个电子,且带的电荷与一般说的质子和电子电荷正好相反,此选项正确;
B、该粒子由一个质子和一个电子构成,但没说明电荷种类,因为反粒子与正常的质子和电子不同,此选项错误;
C、该粒子由一个带负电的质子和一个带正电的电子构成,此选项错误;
D、质子没说带的电荷种类,此选项错误。
故选A。
11.B
【详解】A、A中含有一种分子构成的物质、一种原子构成的物质,是由两种物质组成的,属于混合物,故A不符合题意;
B、B中只含有一种分子,是由一种物质组成的物质,属于纯净物,故B符合题意;
C、C中含有两种分子,是由两种物质组成的,属于混合物,故C不符合题意;
D、D中含有两种原子直接构成的两种物质,属于混合物,故D不符合题意。
故选B。
12.A
【详解】A、铝原子有3个电子层,最外层核外电子数为3,小于4,容易失去最外层电子形成铝离子,故铝离子有2个电子层,此选项正确;
B、O2是单质,故O2中氧元素化合价为零,此选项错误;
C、相对原子质量没有单位,故应去掉质量单位“g”,此选项错误;
D、由元素周期表信息可知,Al原子的原子序数为13,即质子数为13,不是中子数,此选项错误。
故选A。
【点睛】本题考查学生的微观探析化学学科核心素养,能从原子水平认识物质的组成、结构。
13.A
【详解】A、由镁原子的结构示意图可知,镁原子核内有12个质子,说法正确;
B、由于氯原子的最外层电子数=7>4,在化学反应中,易得1个电子,说法不正确;
C、由镁元素周期表信息可知,镁的相对原子质量为24.31,相对原子质量单位是1,不是g,说法不正确;
D、镁原子失去两个电子变成镁离子,最外层电子数变成8,氯原子的最外层电子数=7>4,在化学反应中,易得1个电子变成氯离子,最外层电子数为8,所以二者的最外层电子数相同,都是8,说法不正确。
故选A。
14.C
【详解】A、蒸馏水呈中性,不能使酚酞变色,选项正确;
B、氨水显碱性,所以酚酞遇氨水变红色,选项正确;
C、浓氨水能挥发出氨气,氨气溶于水形成氨水呈碱性,遇到酚酞变红,但不能证明氨分子之间有间隔,选项错误;
D、浓氨水能挥发出氨气,氨分子不断运动,当运动到酚酞溶液中时,氨气溶于水形成氨水呈碱性,遇到酚酞变红,所以可证明氨分子在不断运动,选项正确。
故选:C。
15.(1)分子之间的间隔
(2)在化学反应中分子可以再分,原子不能再分
(3)分子分裂为原子,原子重新结合为新的分子的过程
【详解】(1)由分子构成的物质,在发生物理变化时,分子本身没有发生变化,只是分子之间的间隔改变了;
(2)从上图中能够看出:分子和原子的主要区别是:在化学反应中分子可以再分,原子不能再分;
(3)化学变化的微观实质是:分子分裂为原子,原子重新结合为新的分子的过程。
16. 2Cu S2- Mg Ca2+、Cl- Cl-、Ca2+
【详解】由原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,两个铜原子表示为2Cu;
核内质子数≠核外电子数的粒子是离子,由于该离子核内有16个质子,所以该离子是硫离子,则表示为S2-;
核内质子数=核外电子数的粒子是原子,该原子核内有12个质子,所以该原子是镁原子,则表示为Mg;
构成氯化钙的粒子有钙离子、氯离子,则分别表示为Ca2+、Cl-。
17.(1)A
(2)C
(3)D
(4)B
【解析】(1)
一滴水中约含有1.67×1021个水分子,说明分子很小,故选:A。
(2)
湿衣服经晾晒一段时间后,衣服变干是水分子在不断运动,不断向空气中扩散,所以衣服干了,故选:C。
(3)
液氧和氧气都能助燃,支持燃烧,是液氧和氧气都是由氧分子构成的,同种分子性质相同,不同分子性质不同,故选:D。
(4)
气体可压缩储存于钢瓶中:是因为分子之间有间隔,分子之间间隔变小,气体被压缩,故选:B。
18.(1) 过氧化氢分子 两个氢原子和两个氧原子 改变 不变
(2) 氢元素和氧元素 改变 不变
【解析】(1)
从微观上看,过氧化氢由过氧化氢分子构成;一个过氧化氢分子由两个氢原子和两个氧原子构成;
比较反应前后,各粒子的示意图不难发现,从微观上看,在化学变化前后,分子的种类发生了改变,由过氧化氢分子变成了水分子和氧分子,但原子的种类不变,仍然是氢原子和氧原子;
(2)
宏观上,过氧化氢由氢元素和氧元素组成;
从宏观上分析,物质的种类发生了改变,由过氧化氢变成了水和氧气,但元素的种类不变,仍然是氢元素和氧元素。
19.(1)金属
(2)
(3)O
(4)2个氢氧根离子
【解析】(1)原子序数为11的元素为11号钠元素,钠的偏旁部首是“钅”属于金属元素,故填:金属;
(2)原子中质子数等于原子序数等于核外电子数,原子序数为9的元素为9号元素氟元素,原子核外有2个电子层,每层电子数分别为2、7,原子结构示意图为:
(3)地壳中含量最多的元素是氧元素,元素符号是:;
(4)表示微粒的个数在微粒前面加对应数字;表示的意义为2个氢氧根离子。
20.(1)由相对原子质量的计算公式可知,
(2)由相对原子质量的计算公式可知,一个镁原子的实际质量=镁原子的相对原子质量×碳12原子的质量×1/12=24×1.993×10-26kg×=3.986×10-26kg
答:一个镁原子的实际质量为3.986×10-26kg。
【解析】(1)
见答案
(2)
见答案
21.(1)相对原子质量是原子质量与碳12原子质量的十二分之一的比值;
故镁原子的相对原子质量为:
答:镁原子的相对原子质量为24
(2)解:设铁原子、铜原子个数分别为x、y,则:
56x=64y
答:铁和铜的原子个数比为8:7
【详解】见答案。
22.(1)解:设该X原子质量为x
x≈9.3×10-26kg
答:该X原子质量为9.3×10-26kg。
(2)相对原子质量=质子数+中子数;对原子来说,质子数=核外电子数
X3+的核外电子数为23,X3+为X原子失去3个电子后得到的,说明原子原来电子数为23+3=26;所以中子数为56-26=30。
【分析】相对原子质量是原子质量与碳12原子质量的十二分之一的比值。
【详解】(1)见答案。
(2)见答案。
一、单选题
1.8班某同学活泼好动,智力低下,她妈带它去医院检查,医生告知:该娃缺锌、缺铁、缺钙,建议引用补铁、补锌、补钙口服液,这里的钙、铁、锌指的是
A.离子 B.原子 C.分子 D.元素
2.如图天平右盘中“▲”为一个C﹣12原子质量的 ,据图推断A原子的相对原子质量是
A. B.7 C.12 D.84
3.已知某碳原子的实际质量为mg,其相对原子质量为12。有一种硅原子(符号Si)的实际质量ng,则此种硅原子的相对原子质量的表达式为
A.g B.g C. D.
4.中国科学院院士张青莲教授主持测定了铕、铱等近十种元素的相对原子质量,为相对原子质量测定作出了卓越贡献,下列关于铕的说法中正确的是
A.原子序数为63 B.属于非金属元素
C.原子核外电子数为152 D.相对原子质量为152.0g
5.元素观是化学学科重要观念之一。下列有关元素的说法错误的是
A.Cl 与Cl-可以相互转化
B.混合物中一定含有多种元素
C.原子的质子数不同,则元素种类不同
D.元素周期表中,元素的原子序数与该元素的质子数在数值上相同
6.国之重器东风——41 弹道导弹采用了钛合金前后接头。钛原子质子数为22,相对原子质量为48,则钛原子的核外电子数为
A.22 B.26 C.48 D.70
7.钽元素(Ta)在周期表中的信息如图。下列有关说法错误的是
A.钽属于金属元素 B.钽原子在化学反应中容易失去电子
C.钽原子质量为180.9 D.钽原子的核外电子数为73
8.根据粒子结构示意图给出的信息,下列说法错误的是
A.①④是原子 B.②③具有相对稳定结构
C.②是阴离子 D.②④属于同种元素
9.航天员专用的小分子团水具有饮用量少、在人体内储留时间长、排放量少等特点。航天员一次饮用小分子团水,可维持人体正常需水量。下列关于小分子团水的说法中正确的是
A.水分子的化学性质被改变了
B.小分子团水的部分物理性质与普通水有所不同
C.小分子团水中水分子停止了运动
D.小分子团水中水分子间没有间隙
10.推理是研究和学习化学的一种重要方法。正电子、负质子都是反粒子,它们跟通常所说的电子、质子相比较,质量相等,但电性相反。科学家已发现反氢原子。你推测反氢原子的结构可能是
A.由一个带负电的质子和一个带正电的电子构成
B.由一个质子和一个电子构成
C.由一个带负电的质子和一个电子构成
D.由一个质子和一个带正电的电子构成
11.如图是表示气体粒子的示意图,“”和“”分别表示两种不同元素的原子,其中表示纯净物的是
A. B.
C. D.
12.2020年央视《国家宝藏》节目第三季展出收藏于故宫博物馆的明洪武青花湖石牡丹纹大盘,其化学成分主要是Al2O3、SiO2等,其所含元素在元素周期表中的信息、氧原子结构示意图如下,下列说法正确的是
A.铝离子有2个电子层
B.O2中氧元素化合价为-2价
C.Si元素的相对原子质量为28.09g
D.Al原子的中子数为13
13.根据下图中信息判断,下列说法正确的是
A.镁原子核内有12个质子
B.在化学反应中,氯原子容易失去1个电子
C.镁的相对原子质量为24.31 g
D.镁离子与氯离子的最外层电子数不相等
14.如下图所示为教材上探究分子运动现象的实验,据此实验,不能得到的结论是
A.酚酞溶液遇蒸馏水呈无色 B.酚酞溶液遇氨水变红色
C.氨分子之间有间隔 D.氨分子在不断运动
二、填空题
15.分子原子是构成物质的基本微粒,在化学的学习中要善于运用微观的角度看问题。
(1)如图形象地表示了水在常温下的挥发和水受热加快蒸发的情况,从以上如图中能够读出的结论是:物理变化的微观本质是_______改变;
(2)下图是甲烷与氧气反应的微观示意图:
从上图中能够看出:分子和原子的主要区别是是_______;
(3)化学变化的微观实质是:_______。
16.用化学符号填写下列空格。
两个铜原子____;_____;____;构成氯化钙的粒子____。
17.按要求回答下列问题:
在下面的横线上,选择填写有关分子基本特征的序号。
A、分子很小
B、分子之间有间隔
C、分子在不停运动
D、同种分子化学性质相同
(1)一滴水中约含有1.67×1021个水分子:____。
(2)湿衣服经晾晒一段时间后,衣服变干:_____。
(3)液氧和氧气都能助燃,支持燃烧:_____。
(4)气体可压缩储存于钢瓶中:_____。
18.下图是过氧化氢分子分解的示意图,请你从观察到的信息写出你所获得的化学知识。
(1)微观上:过氧化氢是由______构成的,一个过氧化氢分子是由________构成的;在化学反应前后分子的种类______(填“改变”或“不变”,下同),原子的种类_____________。
(2)宏观上:过氧化氢是由__________组成的,在化学反应前后,物质的种类 _________(填“改变”或“不变”,下同) ,元素的种类__________。
19.元素周期表是学习化学的重要工具。下表是元素周期表的一部分,请回答下列问题:
(1)原子序数为11的元素属于______(填“金属”或“非金属”)元素。
(2)原子序数为9的元素的原子结构示意图为______。
(3)地壳中含量最多的元素是______(填元素符号)。
(4)化学符号2OH-表示的意义为______。
三、计算题
20.已知一个碳12原子的质量为1.993×10-26kg,而一个氧原子质量为2.657× 10-26kg,镁原子的相对原子质量为24,求:
(1)该氧原子的相对原子质量_____。(列出计算过程,不需要计算结果)
(2)一个镁原子的实际质量_____。(列出计算过程,需要计算结果)
21.(1)已知一个碳-12原子的质量为1.993×10-26kg,一个镁原子的质量为3.986×10-26kg,试计算镁原子的相对原子质量。
(2)已知铁的相对原子质量为56,铜的相对原子质量为64,现有等质量的铁和铜,它们所含的原子个数比为多少?
22.某一个X原子的相对质量为56,一个C-12原子的质量1.993×10-26kg,该原子所形成离子X3+的核外电子数为23。
(1)该X原子质量(计算结果保留1位小数)
(2)该X原子的中子数。
参考答案:
1.D
【详解】“补钙”、“补铁”、“补锌”等字样的食品和保健品,这里的“钙、铁、锌”不是以单质、分子、原子等形式存在,这里所指的“钙、铁、锌、硒”是强调存在的元素,与具体形态无关。
故选:D。
2.B
【详解】相对原子质量的概念是以一种碳原子(即碳﹣12原子)质量的1/12作为标准,其它原子的质量(实际质量)跟它相比较所得的值,就称为该原子的相对原子质量。由图可知,天平平衡,故右盘中7个小块的总质量等于一个A原子的质量,而这个小块对应的是一个碳原子质量的1/12,则A原子的相对原子质量=。
故选:B。
3.D
【详解】相对原子质量是以一个碳﹣12原子质量的 作为标准,任何一个原子的真实质量跟一个碳﹣12原子质量的的比值,即 。
根据题意碳﹣12原子的实际质量的为,则此种硅原子的相对原子质量为 。
故选:D。
4.A
【详解】A、在元素周期表中,元素名称左上角的数字表示原子序数,故铕的原子序数为63,正确;
B、由铕元素的汉字名称中含有“钅”字旁可知,铕属于金属元素,错误;
C、在原子中,质子数=原子序数=核外电子数=63,错误;
D、在元素周期表中,元素名称下方的数字表示相对原子质量,相对原子质量是一个比值,单位为“1”,常省略不写,故铕的相对原子质量为152.0,错误。
故选A。
5.B
【详解】A、原子和离子可以相互转化,Cl得到电子变成氯离子,Cl-失去电子可以变成氯原子,Cl与Cl-可以相互转化;正确;
B、混合物是多种物质组成的,如氧气和臭氧在一起是混合物,但是它们都只含有氧元素一种元素,则混合物中不一定含有多种元素;错误;
C、元素是质子数(即核电荷数)相同的一类原子的总称,原子的质子数不同,则元素种类不同;正确;
D、元素周期表是按照原子序数依次增多的顺序排列起来的,原子序数与该元素的质子数在数值上相同;正确;
故选B。
6.A
【详解】原子中核电荷数=核内质子数=核外电子数,由题意钛原子的质子数为22,则钛原子的核外电子数为22。
故选A。
7.C
【详解】A、钽的偏旁部首是“钅”,因此属于金属元素,选项正确;
B、根据金属元素的最外层电子数一般小于4,在化学反应中容易失去电子,钽属于金属元素故钽原子在化学反应中容易失去电子,选项正确;
C、根据元素周期表最下面数字表示相对原子质量,如图所示,钽元素的相对原子质量为180.9,但相对原子质量不是原子的实际质量,因此选项错误;
D、根据元素周期表左上角数字表示原子序数,原子序数等于质子数,如图所示,钽元素的原子序数是73,因此钽原子的质子数是73,根据原子里质子数等于核外电子数,因此其核外电子数为73,选项正确;
故选:C。
8.C
【详解】A、根据原子中核电荷数=核内质子数=核外电子数,①质子数=8=2+6=核外电子数,表示原子;④质子数=11=2+8+1=核外电子数,表示原子;故A说法正确,不符合题意;
B、②③的最外层电子数均为8 ,具有相对稳定结构,故B说法正确,不符合题意;
C、②质子数=11大于核外电子数(2+8=10),表示阳离子,故C说法错误,符合题意;
D、元素是具有相同核电荷数(核内质子数)的一类原子的总称,②④质子数相同都是11,属于同种元素,故D说法正确,不符合题意。
故选C。
9.B
【分析】小分子团水和水一样都是由水分子构成的,也具有分子的基本特征:体积和质量都很小、分子之间存在间隔、分子是在不断运动的。
【详解】A、分子是保持物质化学性质的最小微粒,小分子团水也是由水分子构成的,其化学性质不变,故A不正确;
B、小分子团水具有普通水没有的特点,如“小分子团水具有饮用量少、在人体内储留时间长、排放量少等特点”,故其物理性质有部分与普通水有所不同,故B正确;
C、构成小分子团水的水分子是在不停地运动的,故C不正确;
D、小分子团水和水一样都是由水分子构成的,其分子之间存在一定的间隙,故D不正确。
故选B。
10.A
【详解】A、氢原子内有一个质子和一个电子,且带的电荷与一般说的质子和电子电荷正好相反,此选项正确;
B、该粒子由一个质子和一个电子构成,但没说明电荷种类,因为反粒子与正常的质子和电子不同,此选项错误;
C、该粒子由一个带负电的质子和一个带正电的电子构成,此选项错误;
D、质子没说带的电荷种类,此选项错误。
故选A。
11.B
【详解】A、A中含有一种分子构成的物质、一种原子构成的物质,是由两种物质组成的,属于混合物,故A不符合题意;
B、B中只含有一种分子,是由一种物质组成的物质,属于纯净物,故B符合题意;
C、C中含有两种分子,是由两种物质组成的,属于混合物,故C不符合题意;
D、D中含有两种原子直接构成的两种物质,属于混合物,故D不符合题意。
故选B。
12.A
【详解】A、铝原子有3个电子层,最外层核外电子数为3,小于4,容易失去最外层电子形成铝离子,故铝离子有2个电子层,此选项正确;
B、O2是单质,故O2中氧元素化合价为零,此选项错误;
C、相对原子质量没有单位,故应去掉质量单位“g”,此选项错误;
D、由元素周期表信息可知,Al原子的原子序数为13,即质子数为13,不是中子数,此选项错误。
故选A。
【点睛】本题考查学生的微观探析化学学科核心素养,能从原子水平认识物质的组成、结构。
13.A
【详解】A、由镁原子的结构示意图可知,镁原子核内有12个质子,说法正确;
B、由于氯原子的最外层电子数=7>4,在化学反应中,易得1个电子,说法不正确;
C、由镁元素周期表信息可知,镁的相对原子质量为24.31,相对原子质量单位是1,不是g,说法不正确;
D、镁原子失去两个电子变成镁离子,最外层电子数变成8,氯原子的最外层电子数=7>4,在化学反应中,易得1个电子变成氯离子,最外层电子数为8,所以二者的最外层电子数相同,都是8,说法不正确。
故选A。
14.C
【详解】A、蒸馏水呈中性,不能使酚酞变色,选项正确;
B、氨水显碱性,所以酚酞遇氨水变红色,选项正确;
C、浓氨水能挥发出氨气,氨气溶于水形成氨水呈碱性,遇到酚酞变红,但不能证明氨分子之间有间隔,选项错误;
D、浓氨水能挥发出氨气,氨分子不断运动,当运动到酚酞溶液中时,氨气溶于水形成氨水呈碱性,遇到酚酞变红,所以可证明氨分子在不断运动,选项正确。
故选:C。
15.(1)分子之间的间隔
(2)在化学反应中分子可以再分,原子不能再分
(3)分子分裂为原子,原子重新结合为新的分子的过程
【详解】(1)由分子构成的物质,在发生物理变化时,分子本身没有发生变化,只是分子之间的间隔改变了;
(2)从上图中能够看出:分子和原子的主要区别是:在化学反应中分子可以再分,原子不能再分;
(3)化学变化的微观实质是:分子分裂为原子,原子重新结合为新的分子的过程。
16. 2Cu S2- Mg Ca2+、Cl- Cl-、Ca2+
【详解】由原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,两个铜原子表示为2Cu;
核内质子数≠核外电子数的粒子是离子,由于该离子核内有16个质子,所以该离子是硫离子,则表示为S2-;
核内质子数=核外电子数的粒子是原子,该原子核内有12个质子,所以该原子是镁原子,则表示为Mg;
构成氯化钙的粒子有钙离子、氯离子,则分别表示为Ca2+、Cl-。
17.(1)A
(2)C
(3)D
(4)B
【解析】(1)
一滴水中约含有1.67×1021个水分子,说明分子很小,故选:A。
(2)
湿衣服经晾晒一段时间后,衣服变干是水分子在不断运动,不断向空气中扩散,所以衣服干了,故选:C。
(3)
液氧和氧气都能助燃,支持燃烧,是液氧和氧气都是由氧分子构成的,同种分子性质相同,不同分子性质不同,故选:D。
(4)
气体可压缩储存于钢瓶中:是因为分子之间有间隔,分子之间间隔变小,气体被压缩,故选:B。
18.(1) 过氧化氢分子 两个氢原子和两个氧原子 改变 不变
(2) 氢元素和氧元素 改变 不变
【解析】(1)
从微观上看,过氧化氢由过氧化氢分子构成;一个过氧化氢分子由两个氢原子和两个氧原子构成;
比较反应前后,各粒子的示意图不难发现,从微观上看,在化学变化前后,分子的种类发生了改变,由过氧化氢分子变成了水分子和氧分子,但原子的种类不变,仍然是氢原子和氧原子;
(2)
宏观上,过氧化氢由氢元素和氧元素组成;
从宏观上分析,物质的种类发生了改变,由过氧化氢变成了水和氧气,但元素的种类不变,仍然是氢元素和氧元素。
19.(1)金属
(2)
(3)O
(4)2个氢氧根离子
【解析】(1)原子序数为11的元素为11号钠元素,钠的偏旁部首是“钅”属于金属元素,故填:金属;
(2)原子中质子数等于原子序数等于核外电子数,原子序数为9的元素为9号元素氟元素,原子核外有2个电子层,每层电子数分别为2、7,原子结构示意图为:
(3)地壳中含量最多的元素是氧元素,元素符号是:;
(4)表示微粒的个数在微粒前面加对应数字;表示的意义为2个氢氧根离子。
20.(1)由相对原子质量的计算公式可知,
(2)由相对原子质量的计算公式可知,一个镁原子的实际质量=镁原子的相对原子质量×碳12原子的质量×1/12=24×1.993×10-26kg×=3.986×10-26kg
答:一个镁原子的实际质量为3.986×10-26kg。
【解析】(1)
见答案
(2)
见答案
21.(1)相对原子质量是原子质量与碳12原子质量的十二分之一的比值;
故镁原子的相对原子质量为:
答:镁原子的相对原子质量为24
(2)解:设铁原子、铜原子个数分别为x、y,则:
56x=64y
答:铁和铜的原子个数比为8:7
【详解】见答案。
22.(1)解:设该X原子质量为x
x≈9.3×10-26kg
答:该X原子质量为9.3×10-26kg。
(2)相对原子质量=质子数+中子数;对原子来说,质子数=核外电子数
X3+的核外电子数为23,X3+为X原子失去3个电子后得到的,说明原子原来电子数为23+3=26;所以中子数为56-26=30。
【分析】相对原子质量是原子质量与碳12原子质量的十二分之一的比值。
【详解】(1)见答案。
(2)见答案。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
