化学计量在实验中的应用第一课时
文档属性
| 名称 | 化学计量在实验中的应用第一课时 |  | |
| 格式 | zip | ||
| 文件大小 | 5.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-10-15 22:02:34 | ||
图片预览








文档简介
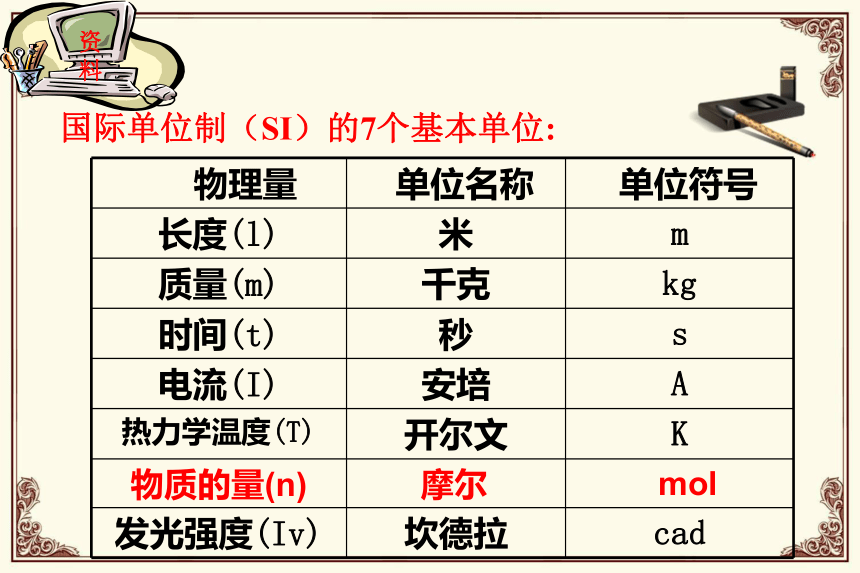
课件25张PPT。1、生活中,大米为什么通常用千克作为单位,而不用米粒来计量?约17万亿亿个!“一滴水中有多少个分子啊?”物质的量资料国际单位制(SI)的7个基本单位:{分子、原子、离子、电子、质子、中子或这些粒子的特定组合。一、物质的量及其单位——摩尔1.物质的量 ①是国际单位制七个基本物理量之一,符号为n 。 ②是表示含有一定数目微观粒子的集合体。③单位:摩尔 简称:摩 符号:mol注意②摩尔作为物质的量的单位,这一单位只适用于微观粒子,不适用于宏观物质。③使用摩尔作为单位表示物质的量时,必须指明微粒的种类,如原子、分子、离子等为:
1mol Na+
①“物质的量”是一个统一、不可分割的整体,这四个字缺一不可,不能把它理解为“物质的质量”或“物质的数量”错误。没有指明微粒的种类。改成1molO,1molO2都是正确的。因此使用摩尔作单位时,所指微粒必须十分明确,且微粒的种类一般用化学符号表示。 正确。 不能,因为物质的量及其单位的使用对象只能是微观粒子,不能用来描述宏观物质.
学以致用1mol任何微粒所含的微粒数与0.012kg12C
中所含的碳原子数相同已知:一个碳-12原子的质量为 1.993 × 10-23g
求: 0.012kg 碳-12 中所含的碳原子数?解:2.阿伏加徳罗常数① 符号:NA ② NA 近似等于6.02 ×1023mol-1③单位: mol-1 (每摩尔)④物质的量(n)、阿伏加德罗常数( NA )、 微粒数(N)之间的关系式 小试牛刀1个水分子中有2个氢原子和1个氧原子,有如下关系:
H2O——2H—— O
1 2 1
分子中原子的物质的量之比==分子中原子个数之比启示2NANANA即H2O——2H——O1mol 2mol 1mol1.1molCO2分子中有 molC, molO,共有 mol原子.3.1mol CO2与 molO2所含原子数相等。 121.52. 0.3 mol H2SO4含有 个硫酸分子, molO,
molS molH1.806×10231.20.30.63 巩固提高阿伏加德罗常数微粒个数物质的量NNA n=归纳整合 1mol任何微观物质都约含6.02X1023个粒子,那么这1mol物质的质量到底有多大?(1)定义:单位物质的量的物质所具有的质量。(2)单位:g/mol(4)数值:等于相对原子(分子)质量。 nm(3)公式: M=3、摩尔质量CO2:
C:
S:
O2
Cl244 g·mol-1
12 g·mol-1
32 g·mol-1
32 g·mol-1
71 g·mol-144
12
32
32
71相对分子质量相对分子质量相对分子质量相对原子质量相对原子质量(1)定义:单位物质的量的物质所具有的质量。(2)单位:g/mol(4)数值:等于相对原子(分子)质量。 nm(3)公式: M=3、摩尔质量 O2 的相对分子质量为 ,O2的摩尔质量为 ______,1molO2的质量是______. 概念辨析【例题】 求0.3molH2O的质量?
其中所含O原子个数?m(H2O)=n(H2O)M(H2O)×=0.3mol18g·mol-1×=5.4gN(O)=n(O)NA×=0.3mol6.02 ×1023mol-1×=1.806 ×1023N,n,m之间的相互转化Nnm÷NA×M×NA÷M联系微观和宏观物质的桥梁小结阿伏加德罗常数 表示含有一定数目粒子集合体的物理量物质的量的单位,符号为mol0.012 千克12c 所含的碳原子数. 6.02 × 1023mol-1
单位物质的量的物质所具有的质量。摩尔质量求28gFe的物质的量?Fe原子的个数?n(Fe)=N(Fe)NA×===NAm(Fe)M(Fe)28g56g·mol-1moln(Fe)=28g56g/mol公式套用0.5=0.5NA
1mol Na+
①“物质的量”是一个统一、不可分割的整体,这四个字缺一不可,不能把它理解为“物质的质量”或“物质的数量”错误。没有指明微粒的种类。改成1molO,1molO2都是正确的。因此使用摩尔作单位时,所指微粒必须十分明确,且微粒的种类一般用化学符号表示。 正确。 不能,因为物质的量及其单位的使用对象只能是微观粒子,不能用来描述宏观物质.
学以致用1mol任何微粒所含的微粒数与0.012kg12C
中所含的碳原子数相同已知:一个碳-12原子的质量为 1.993 × 10-23g
求: 0.012kg 碳-12 中所含的碳原子数?解:2.阿伏加徳罗常数① 符号:NA ② NA 近似等于6.02 ×1023mol-1③单位: mol-1 (每摩尔)④物质的量(n)、阿伏加德罗常数( NA )、 微粒数(N)之间的关系式 小试牛刀1个水分子中有2个氢原子和1个氧原子,有如下关系:
H2O——2H—— O
1 2 1
分子中原子的物质的量之比==分子中原子个数之比启示2NANANA即H2O——2H——O1mol 2mol 1mol1.1molCO2分子中有 molC, molO,共有 mol原子.3.1mol CO2与 molO2所含原子数相等。 121.52. 0.3 mol H2SO4含有 个硫酸分子, molO,
molS molH1.806×10231.20.30.63 巩固提高阿伏加德罗常数微粒个数物质的量NNA n=归纳整合 1mol任何微观物质都约含6.02X1023个粒子,那么这1mol物质的质量到底有多大?(1)定义:单位物质的量的物质所具有的质量。(2)单位:g/mol(4)数值:等于相对原子(分子)质量。 nm(3)公式: M=3、摩尔质量CO2:
C:
S:
O2
Cl244 g·mol-1
12 g·mol-1
32 g·mol-1
32 g·mol-1
71 g·mol-144
12
32
32
71相对分子质量相对分子质量相对分子质量相对原子质量相对原子质量(1)定义:单位物质的量的物质所具有的质量。(2)单位:g/mol(4)数值:等于相对原子(分子)质量。 nm(3)公式: M=3、摩尔质量 O2 的相对分子质量为 ,O2的摩尔质量为 ______,1molO2的质量是______. 概念辨析【例题】 求0.3molH2O的质量?
其中所含O原子个数?m(H2O)=n(H2O)M(H2O)×=0.3mol18g·mol-1×=5.4gN(O)=n(O)NA×=0.3mol6.02 ×1023mol-1×=1.806 ×1023N,n,m之间的相互转化Nnm÷NA×M×NA÷M联系微观和宏观物质的桥梁小结阿伏加德罗常数 表示含有一定数目粒子集合体的物理量物质的量的单位,符号为mol0.012 千克12c 所含的碳原子数. 6.02 × 1023mol-1
单位物质的量的物质所具有的质量。摩尔质量求28gFe的物质的量?Fe原子的个数?n(Fe)=N(Fe)NA×===NAm(Fe)M(Fe)28g56g·mol-1moln(Fe)=28g56g/mol公式套用0.5=0.5NA
