第二单元 课题1空气 课件 -2022-2023学年九年级化学人教版上册(共17张PPT)
文档属性
| 名称 | 第二单元 课题1空气 课件 -2022-2023学年九年级化学人教版上册(共17张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 12.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-15 12:12:34 | ||
图片预览



文档简介
(共17张PPT)
【猜谜语】有一种物质:“看不见,摸不着,不香不臭没味道。说它宝贵到处有,动物植物离不了。” 这是什么呢?
空气除了谜语中提到的性质,还有哪些?今天,我们就来学习人类宝贵的自然资源——空气。
【答案】空气。
导入新知
第二单元 我们周围的空气
课 题 1 空 气
素养目标
1.阐述探究空气中氧气含量的实验原理。
3.会分辨混合物和纯净物(常见物质)
2.说出空气中氮气、氧气、二氧化碳的体积分数。
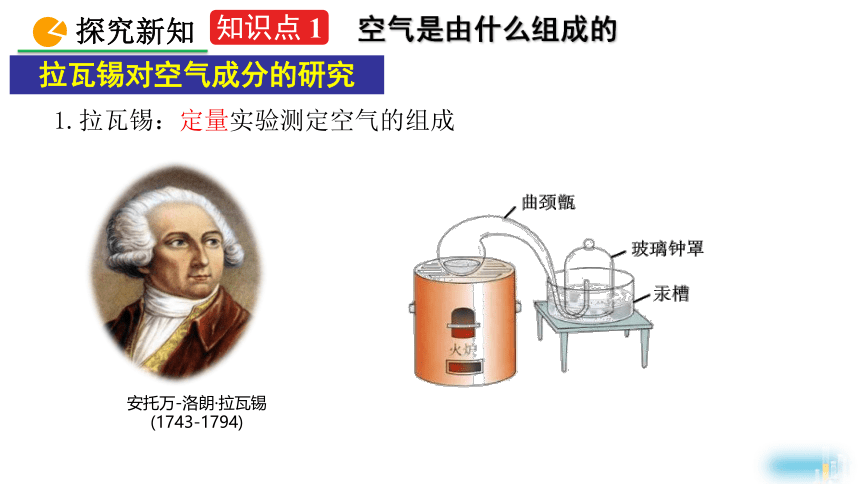
1.拉瓦锡:定量实验测定空气的组成
安托万-洛朗·拉瓦锡
(1743-1794)
探究新知
知识点 1
空气是由什么组成的
拉瓦锡对空气成分的研究
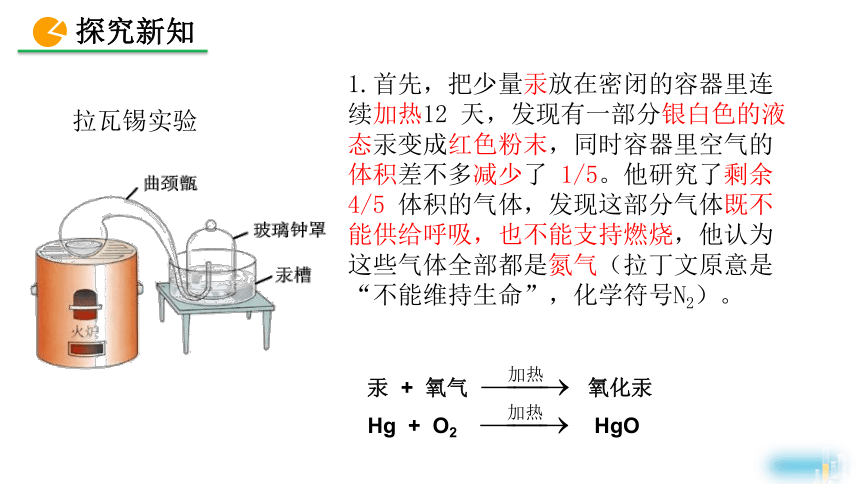
1.首先,把少量汞放在密闭的容器里连续加热12 天,发现有一部分银白色的液态汞变成红色粉末,同时容器里空气的体积差不多减少了 1/5。他研究了剩余4/5 体积的气体,发现这部分气体既不能供给呼吸,也不能支持燃烧,他认为这些气体全部都是氮气(拉丁文原意是“不能维持生命”,化学符号N2)。
汞 + 氧气 氧化汞
Hg + O2 HgO
拉瓦锡实验
探究新知
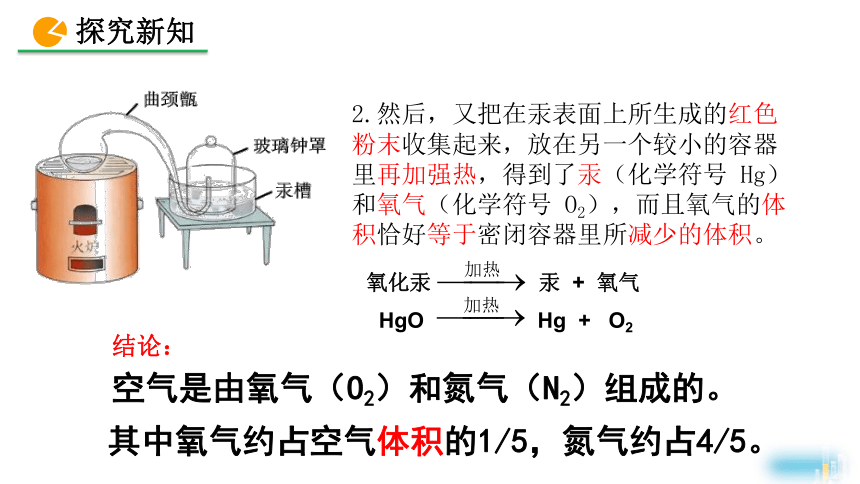
2.然后,又把在汞表面上所生成的红色粉末收集起来,放在另一个较小的容器里再加强热,得到了汞(化学符号 Hg)和氧气(化学符号 O2),而且氧气的体积恰好等于密闭容器里所减少的体积。
氧化汞 汞 + 氧气
HgO Hg + O2
结论:
空气是由氧气(O2)和氮气(N2)组成的。
其中氧气约占空气体积的1/5,氮气约占4/5。
探究新知
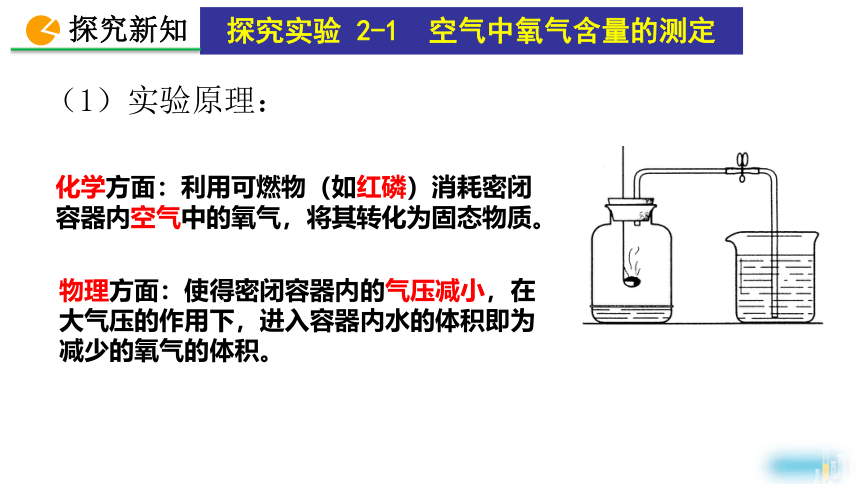
(1)实验原理:
化学方面:利用可燃物(如红磷)消耗密闭容器内空气中的氧气,将其转化为固态物质。
物理方面:使得密闭容器内的气压减小,在大气压的作用下,进入容器内水的体积即为减少的氧气的体积。
探究实验 2-1 空气中氧气含量的测定
探究新知
(2)实验仪器和药品:
(3)实验步骤
①组装装置,检查装置气密性;
②集气瓶内装入少量的水,再把剩余的容积分成五等份;
③点燃燃烧匙内的红磷,立即伸入瓶中,并把塞子塞紧;
④红磷燃烧停止后,瓶内温度冷却至室温,白烟消失后,打开弹簧夹。
集气瓶、燃烧匙、橡胶塞、弹簧夹、乳胶管、玻璃导管、烧杯、红磷
探究新知
②温度冷却至室温后,打开止水夹,水沿导管进入集气瓶并约占集气瓶液面以上容积的1/5。
①燃烧匙中的红磷燃烧,发出黄光,产生大量白烟,并放出大量的热;
(4)实验现象:
点燃
文字表达式:
+
符号表达式 :
点燃
+
白色固体
磷
氧气
五氧化二磷
P
O2
P2O5
探究新知
(5)实验结论:
主:空气中氧气约占空气体积分数1/5。
副:氮气约占空气总体积的 4/5,不燃烧,也不支持燃烧,难溶于水。
(6)实验注意事项:
①红磷要过量,目的是将瓶内氧气完全反应掉;
②瓶内预先加少量的水,作用是吸收白烟,防止污染空气;
③燃烧后,要冷却至室温后,再打开弹簧夹,减少误差。
探究新知
【分析】集气瓶中水上升至约1/5后,不再上升说明剩余的气体不能燃烧也不支持燃烧,且不溶于水。
【思考1】集气瓶中的水上升到约1/5后,不能继续上升,说明剩余气体有什么性质?
探究新知
【分析】(1)装置漏气;
(2)红磷的量不足;
(3)红磷熄灭后未冷却到室温就打开止水夹;
(4)有部分水留在导管中未进入集气瓶
【思考 2】在实验中,进入集气瓶内的水的体积常小于集气瓶空气总容积的1/5,可能的原因是什么呢?
探究新知
一百份体积的空气
氧气(O2)
21%
氮气(N2)
78%
其他气体和杂质
0.03%
稀有气体
0.94%
二氧化碳(CO2)
0.03%
探究新知
二、空气的成分
体积分数
纯净物:由一种物质组成的物质,可以用专门的化学符号来表示。
如氧气(O2)、氮气(N2)、二氧化碳(CO2)等。
混合物:由两种或两种以上的物质混合而成的物质,其中各成分各自保持着原来的性质。如:空气,海水等。
探究新知
三、 混合物与纯净物
练一练:
下列物质哪些属于纯净物?
A.海水 B.医用酒精 C.二氧化碳
D.食醋 E.自来水 F.纯牛奶
G.矿泉水 H.冰水混合物 I.液氮
K.纯净的空气 L.纯咖啡
空气
氧气含量测定
主要成分
氧气
其他
稀有气体
氮气
实验原理
实验现象
实验结论
污染与防治
课堂小结
化学课堂 伴你成长
【猜谜语】有一种物质:“看不见,摸不着,不香不臭没味道。说它宝贵到处有,动物植物离不了。” 这是什么呢?
空气除了谜语中提到的性质,还有哪些?今天,我们就来学习人类宝贵的自然资源——空气。
【答案】空气。
导入新知
第二单元 我们周围的空气
课 题 1 空 气
素养目标
1.阐述探究空气中氧气含量的实验原理。
3.会分辨混合物和纯净物(常见物质)
2.说出空气中氮气、氧气、二氧化碳的体积分数。
1.拉瓦锡:定量实验测定空气的组成
安托万-洛朗·拉瓦锡
(1743-1794)
探究新知
知识点 1
空气是由什么组成的
拉瓦锡对空气成分的研究
1.首先,把少量汞放在密闭的容器里连续加热12 天,发现有一部分银白色的液态汞变成红色粉末,同时容器里空气的体积差不多减少了 1/5。他研究了剩余4/5 体积的气体,发现这部分气体既不能供给呼吸,也不能支持燃烧,他认为这些气体全部都是氮气(拉丁文原意是“不能维持生命”,化学符号N2)。
汞 + 氧气 氧化汞
Hg + O2 HgO
拉瓦锡实验
探究新知
2.然后,又把在汞表面上所生成的红色粉末收集起来,放在另一个较小的容器里再加强热,得到了汞(化学符号 Hg)和氧气(化学符号 O2),而且氧气的体积恰好等于密闭容器里所减少的体积。
氧化汞 汞 + 氧气
HgO Hg + O2
结论:
空气是由氧气(O2)和氮气(N2)组成的。
其中氧气约占空气体积的1/5,氮气约占4/5。
探究新知
(1)实验原理:
化学方面:利用可燃物(如红磷)消耗密闭容器内空气中的氧气,将其转化为固态物质。
物理方面:使得密闭容器内的气压减小,在大气压的作用下,进入容器内水的体积即为减少的氧气的体积。
探究实验 2-1 空气中氧气含量的测定
探究新知
(2)实验仪器和药品:
(3)实验步骤
①组装装置,检查装置气密性;
②集气瓶内装入少量的水,再把剩余的容积分成五等份;
③点燃燃烧匙内的红磷,立即伸入瓶中,并把塞子塞紧;
④红磷燃烧停止后,瓶内温度冷却至室温,白烟消失后,打开弹簧夹。
集气瓶、燃烧匙、橡胶塞、弹簧夹、乳胶管、玻璃导管、烧杯、红磷
探究新知
②温度冷却至室温后,打开止水夹,水沿导管进入集气瓶并约占集气瓶液面以上容积的1/5。
①燃烧匙中的红磷燃烧,发出黄光,产生大量白烟,并放出大量的热;
(4)实验现象:
点燃
文字表达式:
+
符号表达式 :
点燃
+
白色固体
磷
氧气
五氧化二磷
P
O2
P2O5
探究新知
(5)实验结论:
主:空气中氧气约占空气体积分数1/5。
副:氮气约占空气总体积的 4/5,不燃烧,也不支持燃烧,难溶于水。
(6)实验注意事项:
①红磷要过量,目的是将瓶内氧气完全反应掉;
②瓶内预先加少量的水,作用是吸收白烟,防止污染空气;
③燃烧后,要冷却至室温后,再打开弹簧夹,减少误差。
探究新知
【分析】集气瓶中水上升至约1/5后,不再上升说明剩余的气体不能燃烧也不支持燃烧,且不溶于水。
【思考1】集气瓶中的水上升到约1/5后,不能继续上升,说明剩余气体有什么性质?
探究新知
【分析】(1)装置漏气;
(2)红磷的量不足;
(3)红磷熄灭后未冷却到室温就打开止水夹;
(4)有部分水留在导管中未进入集气瓶
【思考 2】在实验中,进入集气瓶内的水的体积常小于集气瓶空气总容积的1/5,可能的原因是什么呢?
探究新知
一百份体积的空气
氧气(O2)
21%
氮气(N2)
78%
其他气体和杂质
0.03%
稀有气体
0.94%
二氧化碳(CO2)
0.03%
探究新知
二、空气的成分
体积分数
纯净物:由一种物质组成的物质,可以用专门的化学符号来表示。
如氧气(O2)、氮气(N2)、二氧化碳(CO2)等。
混合物:由两种或两种以上的物质混合而成的物质,其中各成分各自保持着原来的性质。如:空气,海水等。
探究新知
三、 混合物与纯净物
练一练:
下列物质哪些属于纯净物?
A.海水 B.医用酒精 C.二氧化碳
D.食醋 E.自来水 F.纯牛奶
G.矿泉水 H.冰水混合物 I.液氮
K.纯净的空气 L.纯咖啡
空气
氧气含量测定
主要成分
氧气
其他
稀有气体
氮气
实验原理
实验现象
实验结论
污染与防治
课堂小结
化学课堂 伴你成长
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
