【2022-2023沪教版九上化学精优课件含视频】第3章 构成物质的奥秘(章末复习课件)(35页)
文档属性
| 名称 | 【2022-2023沪教版九上化学精优课件含视频】第3章 构成物质的奥秘(章末复习课件)(35页) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-16 09:27:12 | ||
图片预览







文档简介
(共35张PPT)
沪教版九上化学精品课件
3.4 章末复习
绪言
第三章 物质构成的奥秘
学习目标
重点难点
1.认识物质的微粒性,知道分子的有关性质;能用微粒的观点解释某些常见的现象。
2.能说出原子核外电子分层排布的规律,学会原子结构的表示方法;
3.认识一些常见元素,会书写它们的名称与符号;知道元素符号的意义;掌握有关
单质和化合物的概念。
4.会写出单质及简单化合物的化学式;归纳书写化学式的方法及一些简单计算。
1.用微粒的观点解释某些常见的现象;
2.原子的内部结构及原子核外电子分层排布的规律。
3.离子形成的过程。
4.能利用相对原子质量和相对分子质量来计算物质的组成。
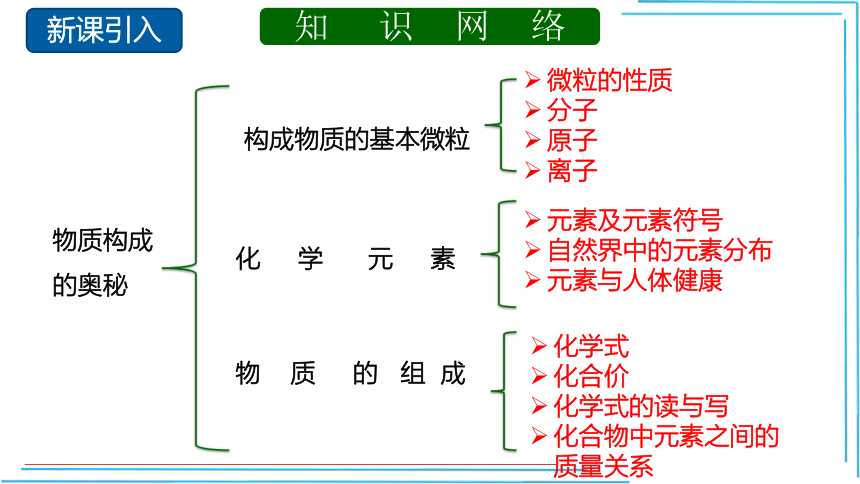
知 识 网 络
物质构成
的奥秘
构成物质的基本微粒
微粒的性质
分子
原子
离子
元素及元素符号
自然界中的元素分布
元素与人体健康
化 学 元 素
化学式
化合价
化学式的读与写
化合物中元素之间的质量关系
物 质 的 组 成
新课引入
性质
“小”——微粒的体积和_______都很小
“动”——微粒总是在___________
“间”——微粒之间都有一定的________
“同”——同种物质分子的化学性质_______,不同种物质分子的化学性质不同
应用
区别物理变化和化学变化:从微观角度来分析,对于由分子构成的物质,当发生______(填“物理”或“化学”,下同)变化时,物质的分子本身没有发生变化,当发生_____变化时,原物质的分子发生了变化,生成了新物质的分子
质量
不断地运动
空隙
相同
物理
化学
新课讲解
构成物质的基本微粒
解释常见现象:
根据分子在 中,可解释物质的扩散(如气体的扩散、液体的蒸发、固体的溶解等);根据分子之间有______可解释热胀冷缩,气体易被压缩等现象
不断地运动
空隙
新课讲解
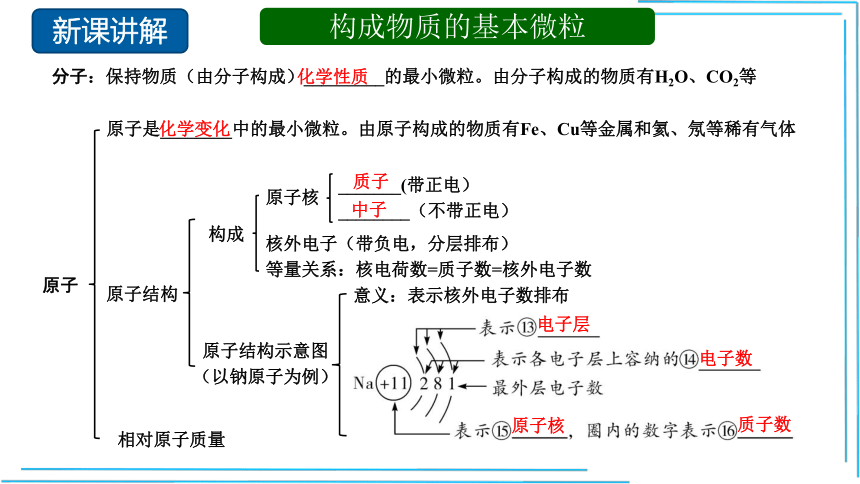
构成物质的基本微粒
分子:保持物质(由分子构成)_________的最小微粒。由分子构成的物质有H2O、CO2等
原子
原子是________中的最小微粒。由原子构成的物质有Fe、Cu等金属和氦、氖等稀有气体
原子结构
构成
原子核
_______(带正电)
________(不带正电)
核外电子(带负电,分层排布)
等量关系:核电荷数=质子数=核外电子数
原子结构示意图(以钠原子为例)
意义:表示核外电子数排布
化学性质
化学变化
质子
中子
电子层
电子数
原子核
质子数
相对原子质量
新课讲解
构成物质的基本微粒
构成原子的各粒子间的关系
①构成原子的粒子有三种:_________________。但并不是所有的原子都是由这三种粒子构成的,如氢原子中只有一个质子和一个电子,没有中子。
②原子核内质子所带电荷与核外电子的电荷数____,电性________,所以原子___________。
③原子核所带电荷数叫做核电荷数。
核电荷数=_________=______________
质子、中子、电子
相等
相反
不显电性
质子数
核外电子数
新课讲解
构成物质的基本微粒
相对原子质量
定义:以一种碳原子的质量的 作为基准,其他原子的质量与这一基准的比
表达式:某原子的相对原子质量=
近似计算式:相对原子质量≈____________+中子数
单位:相对原子质量单位为“1”,通常省略不写
注意:相对分子质量(Mr)等于构成分子的各原子的相对原子质量(Ar)的总和
质子数
新课讲解
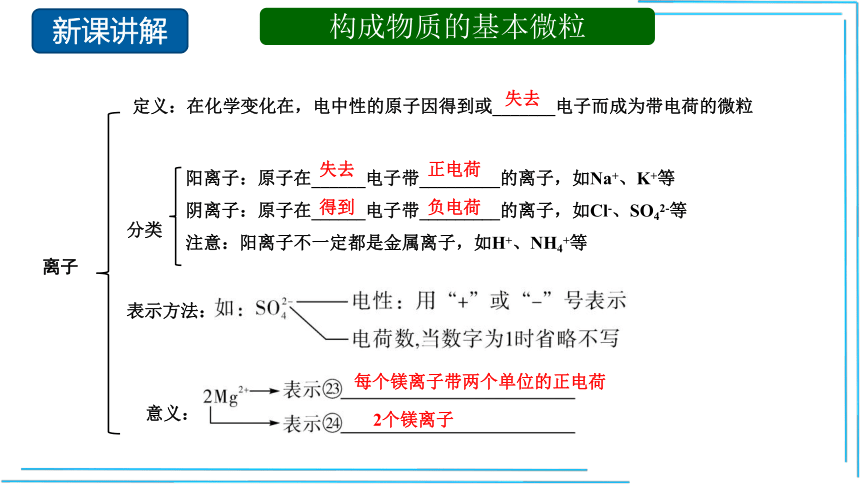
构成物质的基本微粒
阳离子:原子在______电子带_________的离子,如Na+、K+等
阴离子:原子在______电子带_________的离子,如Cl-、SO42-等
注意:阳离子不一定都是金属离子,如H+、NH4+等
离子
分类
表示方法:
失去
失去
正电荷
得到
负电荷
意义:
每个镁离子带两个单位的正电荷
2个镁离子
定义:在化学变化在,电中性的原子因得到或_______电子而成为带电荷的微粒
新课讲解
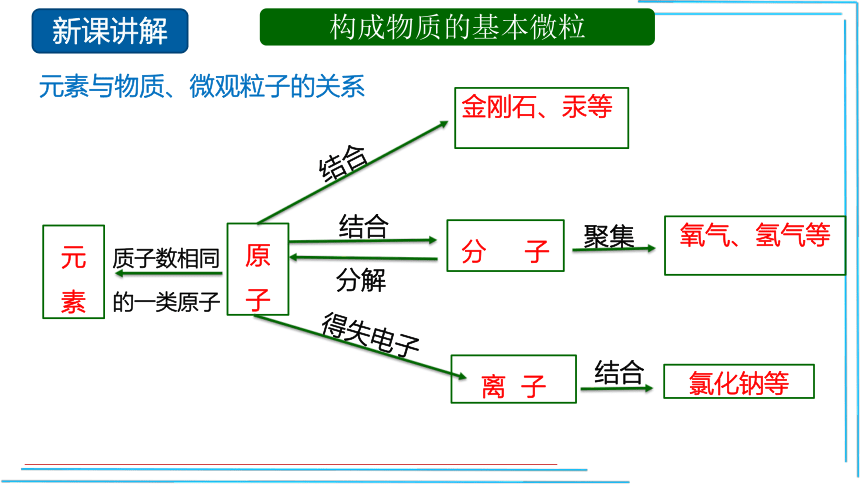
构成物质的基本微粒
元素与物质、微观粒子的关系
原子
元素
质子数相同
的一类原子
金刚石、汞等
分 子
氧气、氢气等
离 子
氯化钠等
结合
结合
分解
聚集
得失电子
结合
构成物质的基本微粒
新课讲解
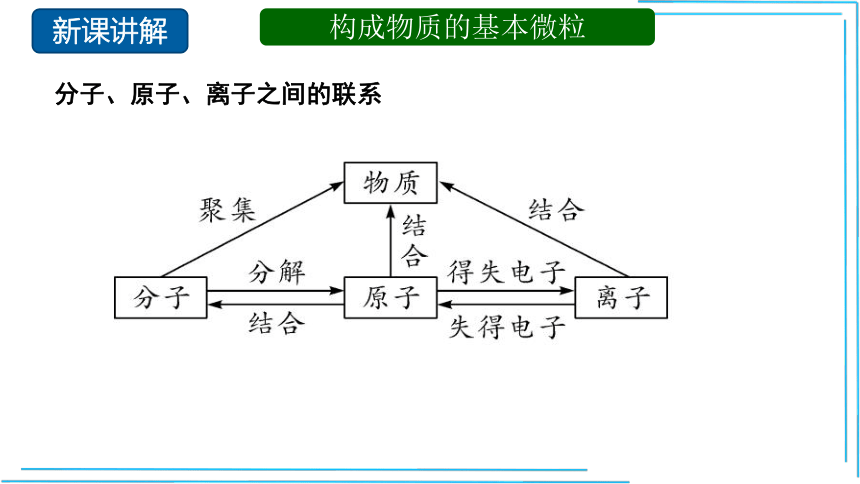
分子、原子、离子之间的联系
新课讲解
构成物质的基本微粒
金属元素:“ ”(汞除外),最外层电子数<4(H、He、B除外),
易____电子
非金属元素:“ ”、“ ”、“气”字旁,最外层电子数>4,易______电子,
稀有气体元素最外层有8个电子(He)有两个,相对稳定
元素与
元素符号
分类
元素
元素符号
书写原则:元素符号用1个或2个拉丁字母表示,第一个字母_____,第二个字
母____
宏观:表示一种元素(如H:宏观表示_______),若物质的化学式与元
素符号相同时,则还表示这种物质
微观:表示这种元素的一个原子(如H:微观表示__________),元素符
号前面加上化学计量数,该符号只具有微观意义
(如2H:表示__________)
意义
核电荷数
失去
得到
大写
小写
氢元素
1个氢原子
2个氢原子
定义:具有相同的________(即质子数)的同一类原子总称
新课讲解
组成物质的化学元素
元素周期表最早由俄国科学家门捷列夫编制的
横行(周期):每一个横行叫周期,共有七个周期
纵行(族):每一个纵行叫一个族,共有18个纵行16个族,其中8、9、10
三个纵行共同组成一个族
元素周期表中元素信息:
(以氮元素为例)
元素
周期表
原子序数
元素符号
元素与
元素符号
相对原子质量
新课讲解
组成物质的化学元素
自然界中
元素的存在
地壳:含量居于前四位的依次是_________________,其中含量最多的金属元
素是_____,含量最多的非金属元素是_______
氧、硅、铝、铁
铝
氧
氧
氧
太阳:含量最多的是氢,其次是氦,还含有碳、氮、氧和多种金属元素
人体:含量最多的是_______,其次是碳、氢、氮
海水:含量最多的是_______,其次是氢
新课讲解
组成物质的化学元素
元素分类
常量元素:碳(C)、氢(H)、氮(N)、钙(Ga)等
微量元素:铁(Fe)、铜(Cu)、锰(Mn)、锌(Zn)、钴(Co)、碘(I)、硒(Se)等
一些元素对人体健康的影响
钙:主要存在于骨骼、牙齿中,缺钙有可能导致________、畸形,易得佝偻
病,主要食物来源:高钙奶、钙片、虾皮等
铁:血红蛋白的主要成分,能帮助运输氧气,缺铁易得________
主要食物来源:动物肝脏、瘦肉、蛋、鱼等
锌:影响人体发育,缺锌会使儿童发育停滞,智力低下,严重时会得_______
主要食物来源:动物肝脏、瘦肉、蛋、鱼等
碘:甲状腺激素的重要成分,缺碘或碘过量均会导致___________
主要食物来源:海产品、加碘盐等
硒:微量的硒可以防晒,过量的硒则是致癌的因素之一
主要食物来源:富硒大米、富硒茶叶等
氟:预防______
主要食物来源:茶叶、海虾等
骨质疏松
贫血症
侏儒症
甲状腺疾病
龋齿
元素与
人体健康
新课讲解
组成物质的化学元素
混合物:由两种或两种以上物质混合而成的物质,如石油、食醋等
纯净物
定义:由__________组成的纯净物
单质
金属单质:如铜、铁等
非金属单质(包括稀有气体单质),如氮气、氧气、氩气等
按性质分
化合物
定义:由____________________组成的纯净物
分类————
按组成和性质分
无机
化合物
氧化物:由______种元素组成,其中有一种元素是
氧的化合物,如H2O、Fe3O4等
酸:解离时产生的阳离子全为H+的化合物,如硫酸、
盐酸等
碱:解离时产生的阴离子全部为OH—的化合物,如
氢氧化钠、氢氧化钙等
盐:解离时生成金属离子(或铵根离子)和酸根离子
的化合物,如氯化钠、硫酸钠等
同种元素
两种或两种以上元素
两(或2)
混合
分离
有机化合物:含碳元素的化合物(CO、CO2、碳酸、碳酸
盐等少数含碳化合物除外),如甲烷、乙醇等
分类 ————
新课讲解
组成物质的化学元素
定义:用___________和数字组合表示纯净物组成的式子
意义
宏观
表示一种物质,如CH4表示_________________
表示这种物质的元素组成,如CH4表示甲烷由_________________组成
表示该物质的一个分子,如CH4表示_______________________
表示物质的分子构成,如CH4表示____________________________________________
________
稀有气体、金属和固态非金属:用组成元素的元素符号表示(碘除外),如氖写为
Ne、铁写为Fe
气态非金属:用元素符号和数字的组合表示,如氧气写为O2
单质
化合物:通常为正左负右,标价交叉,化简复查,如
书写
元素符号
甲烷这种物质
碳元素和氢元素
一个甲烷分子
一个甲烷分子由一个碳原子和四个氢原子构成(合理即可)
微观
新课讲解
物质的组成
注意事项
表示方法:在元素符号或原子团的正上方用符号和数字表示,如 等
a.符号在前,数字在后
b.表示某物质中某元素化合价时,需将整个化学式写出再标该元素的化合价
常见元素及原子团的化合价
常见元素的化合价记忆口诀:一价钾钠氯氢银,二价氧钙钡镁锌,三氯四硅五价磷,
二三铁,二四碳,二四六硫都齐全,铜汞二价最常见,
单质为零永不变(带点显负价)
.
.
常见原子团的化合价
原子团化合价的数值等于所带电荷数
名称 氢氧根 硝酸根 铵根 硫酸根 碳酸根
离子符号 OH- NO3- NH4+ SO42- CO32-
化合价 -1 ______ +1 -2 _______
-1
-2
新课讲解
物质的组成
一般规律
a.在单质种,任何元素的化合价均为_________
b.在金属化合物种,金属元素一般呈____价,非金属元素一般呈_____价,在非金属氧化物种,该非金属元素一般呈______价
c.在化合物中各元素正负化合价代数和为_______
d.在不同的物质中同种元素化合价可能不同
计算
计算原则:化合物中各元素正负化合价的代数和为______
计算步骤
(以Na2FeO4为例)
零
正
负
正
零
零
新课讲解
物质的组成
化学式的相关计算
新课讲解
物质的组成
典例精讲
例1.(2022年山东省泰安市中考)宏观辨识与微观探析是化学学科的核心素养之一、下列宏观事实的微观解释错误的是( )
A.自然界中水的天然循环一水分子不断运动的结果
B.氧气经压缩储存在钢瓶中一氧气分子体积变小了
C.一滴水中大约含有1.67×1021个水分子一水分子很小
D.氧气和液氧都能支持燃烧一物质的分子相同,其化学性质相同
B
典例精讲
例2.(2022年云南省中考)幼儿及青少年缺钙会患佝偻病。因此,每日必须摄入足够量的钙。这里的“钙”指的是( )
A.原子 B.分子
C.元素 D.单质
C
典例精讲
例3.(2022年重庆市中考)缺锌会导致生长迟缓。下图为锌元素的信息,下列说法不正确的是( )
A.锌原子的质量为68.38g
B.锌的原子序数为30
C.锌原子核外有四层电子
D.锌在反应中易失去电子
A
典例精讲
例4.(2022湖南衡阳一模)某同学从衡阳到西藏旅游,
到达西藏后,发现从衡阳带来的密封饼干包装袋鼓起了。
包装袋鼓起的原因是( )
A.袋内饼干的体积变大
B.袋内气体分子的体积变大
C.袋内气体分子个数增多
D.袋内气体分子间的间隙变大
D
C
典例精讲
例5.(2022年湖南省衡阳市中考)我国著名科学家、中国科学院院士张青莲教授主持测定了铟、铱、锑、铕等近十种元素的相对原子质量,为相对原子质量测定作出了卓越贡献。关于钢元素在元素周期表中的部分信息及原了结构示意图如图所示。下列说法正确的是( )
A.铟元素属于非金属元素 B.铟元素的相对原子质量是114.8g
C.铟原子的质子数为49 D.铟的原子结构示意图中X=18
例6. 某物质的化学式为HnMO2n,其相对分子质量是A,则M的相对原子质量是____________,M的化合价是______,当M的化合价不变时,其氧化物化学式为_________,其氧化物的相对分子质量是_______。
A-33n
+3n
M2O3n
2A-18n
典例精讲
C
例7. (2021湖南常德)如图是五种微粒的结构示意图,下列说法不
正确的是( )
A.上述五种微粒只涉及四种元素
B.②③⑤表示的微粒性质较稳定
C.①②④属于原子,③⑤属于阴离子
D.①④对应元素组成化合物的化学式为NaF
-
典例精讲
例8.列对几种有机物的有关叙述中正确的是( )
A. 甲醛(CH2O)分子由碳原子和水分子构成
B. 丙烷(C3H8)由3个碳元素、8个氢元素组成
C. 乙酸(C2H4O2)中碳元素的质量分数为40%
D. 维生素C(C6H8O6)中C、H、O的质量比为3∶4∶3
例9. (2022江苏徐州一模)下列关于青蒿素(化学式为C15H22O5)的说法正确的是( )
A. 青蒿素中含有42个原子
B. 青蒿素是由三种元素组成的有机化合物
C. 青蒿素中氢元素的质量分数最大
D. 青蒿素中C、H元素的质量比为15∶22
C
B
典例精讲
1.(2022四川省成都市青白江中学校二模)下列关于分子的叙述中,正确的是( )
A.一切物质都是由分子构成的
B.分子是化学变化中的最小粒子
C.分子是不能再分的一种粒子
D.分子是保持物质化学性质的最小粒子
D
达标检测
2.(2022成都市通锦中学校二模)用分子的知识解释下列现象,正确的是( )
A.缉毒犬能根据气味发现毒品,是由于分子不断运动
B.铁丝在空气中不燃烧而在氧气中燃烧,说明空气中和氧气中的氧分子化学性质不同
C.变瘪的乒乓球放入热水中能鼓起来,是由于分子受热体积变大
D.降温能使水结成冰,是因为在低温下水分子静止不动
A
达标检测
3.(2022崇州市崇庆中学实验学校二模 ) 下列对分子、原子、离子的认识正确的是( )
A.同种分子排列方式不同,化学性质不同
B.在干冰中,分子因相互作用而静止不动
C.同种原子按不同方式结合,可以构成不同的物质
D.原子得失电子形成离子后,原子核发生了变化
C
达标检测
4.(2022金堂县福兴镇初级中学二模)在下列示意图表示的粒子中,属于原
子的有 (填序号,下同),属于阳离子的有 ,属于阴离子的
有 ,属于同种元素的为 。
②⑤⑥
①④
③
④⑤
达标检测
5.(2022山东聊城二模)下列关于微观粒子说法不
正确的是( )
A.分子的质量一定比原子的质量大
B.同种原子可以构成不同种分子
C.所有原子都由原子核和核外电子构成
D.原子得到或失去电子变成离子
A
达标检测
1.完成配套练习册;
2.完成导学案 。
作业布置
沪教版九上化学精品课件
3.4 章末复习
绪言
第三章 物质构成的奥秘
学习目标
重点难点
1.认识物质的微粒性,知道分子的有关性质;能用微粒的观点解释某些常见的现象。
2.能说出原子核外电子分层排布的规律,学会原子结构的表示方法;
3.认识一些常见元素,会书写它们的名称与符号;知道元素符号的意义;掌握有关
单质和化合物的概念。
4.会写出单质及简单化合物的化学式;归纳书写化学式的方法及一些简单计算。
1.用微粒的观点解释某些常见的现象;
2.原子的内部结构及原子核外电子分层排布的规律。
3.离子形成的过程。
4.能利用相对原子质量和相对分子质量来计算物质的组成。
知 识 网 络
物质构成
的奥秘
构成物质的基本微粒
微粒的性质
分子
原子
离子
元素及元素符号
自然界中的元素分布
元素与人体健康
化 学 元 素
化学式
化合价
化学式的读与写
化合物中元素之间的质量关系
物 质 的 组 成
新课引入
性质
“小”——微粒的体积和_______都很小
“动”——微粒总是在___________
“间”——微粒之间都有一定的________
“同”——同种物质分子的化学性质_______,不同种物质分子的化学性质不同
应用
区别物理变化和化学变化:从微观角度来分析,对于由分子构成的物质,当发生______(填“物理”或“化学”,下同)变化时,物质的分子本身没有发生变化,当发生_____变化时,原物质的分子发生了变化,生成了新物质的分子
质量
不断地运动
空隙
相同
物理
化学
新课讲解
构成物质的基本微粒
解释常见现象:
根据分子在 中,可解释物质的扩散(如气体的扩散、液体的蒸发、固体的溶解等);根据分子之间有______可解释热胀冷缩,气体易被压缩等现象
不断地运动
空隙
新课讲解
构成物质的基本微粒
分子:保持物质(由分子构成)_________的最小微粒。由分子构成的物质有H2O、CO2等
原子
原子是________中的最小微粒。由原子构成的物质有Fe、Cu等金属和氦、氖等稀有气体
原子结构
构成
原子核
_______(带正电)
________(不带正电)
核外电子(带负电,分层排布)
等量关系:核电荷数=质子数=核外电子数
原子结构示意图(以钠原子为例)
意义:表示核外电子数排布
化学性质
化学变化
质子
中子
电子层
电子数
原子核
质子数
相对原子质量
新课讲解
构成物质的基本微粒
构成原子的各粒子间的关系
①构成原子的粒子有三种:_________________。但并不是所有的原子都是由这三种粒子构成的,如氢原子中只有一个质子和一个电子,没有中子。
②原子核内质子所带电荷与核外电子的电荷数____,电性________,所以原子___________。
③原子核所带电荷数叫做核电荷数。
核电荷数=_________=______________
质子、中子、电子
相等
相反
不显电性
质子数
核外电子数
新课讲解
构成物质的基本微粒
相对原子质量
定义:以一种碳原子的质量的 作为基准,其他原子的质量与这一基准的比
表达式:某原子的相对原子质量=
近似计算式:相对原子质量≈____________+中子数
单位:相对原子质量单位为“1”,通常省略不写
注意:相对分子质量(Mr)等于构成分子的各原子的相对原子质量(Ar)的总和
质子数
新课讲解
构成物质的基本微粒
阳离子:原子在______电子带_________的离子,如Na+、K+等
阴离子:原子在______电子带_________的离子,如Cl-、SO42-等
注意:阳离子不一定都是金属离子,如H+、NH4+等
离子
分类
表示方法:
失去
失去
正电荷
得到
负电荷
意义:
每个镁离子带两个单位的正电荷
2个镁离子
定义:在化学变化在,电中性的原子因得到或_______电子而成为带电荷的微粒
新课讲解
构成物质的基本微粒
元素与物质、微观粒子的关系
原子
元素
质子数相同
的一类原子
金刚石、汞等
分 子
氧气、氢气等
离 子
氯化钠等
结合
结合
分解
聚集
得失电子
结合
构成物质的基本微粒
新课讲解
分子、原子、离子之间的联系
新课讲解
构成物质的基本微粒
金属元素:“ ”(汞除外),最外层电子数<4(H、He、B除外),
易____电子
非金属元素:“ ”、“ ”、“气”字旁,最外层电子数>4,易______电子,
稀有气体元素最外层有8个电子(He)有两个,相对稳定
元素与
元素符号
分类
元素
元素符号
书写原则:元素符号用1个或2个拉丁字母表示,第一个字母_____,第二个字
母____
宏观:表示一种元素(如H:宏观表示_______),若物质的化学式与元
素符号相同时,则还表示这种物质
微观:表示这种元素的一个原子(如H:微观表示__________),元素符
号前面加上化学计量数,该符号只具有微观意义
(如2H:表示__________)
意义
核电荷数
失去
得到
大写
小写
氢元素
1个氢原子
2个氢原子
定义:具有相同的________(即质子数)的同一类原子总称
新课讲解
组成物质的化学元素
元素周期表最早由俄国科学家门捷列夫编制的
横行(周期):每一个横行叫周期,共有七个周期
纵行(族):每一个纵行叫一个族,共有18个纵行16个族,其中8、9、10
三个纵行共同组成一个族
元素周期表中元素信息:
(以氮元素为例)
元素
周期表
原子序数
元素符号
元素与
元素符号
相对原子质量
新课讲解
组成物质的化学元素
自然界中
元素的存在
地壳:含量居于前四位的依次是_________________,其中含量最多的金属元
素是_____,含量最多的非金属元素是_______
氧、硅、铝、铁
铝
氧
氧
氧
太阳:含量最多的是氢,其次是氦,还含有碳、氮、氧和多种金属元素
人体:含量最多的是_______,其次是碳、氢、氮
海水:含量最多的是_______,其次是氢
新课讲解
组成物质的化学元素
元素分类
常量元素:碳(C)、氢(H)、氮(N)、钙(Ga)等
微量元素:铁(Fe)、铜(Cu)、锰(Mn)、锌(Zn)、钴(Co)、碘(I)、硒(Se)等
一些元素对人体健康的影响
钙:主要存在于骨骼、牙齿中,缺钙有可能导致________、畸形,易得佝偻
病,主要食物来源:高钙奶、钙片、虾皮等
铁:血红蛋白的主要成分,能帮助运输氧气,缺铁易得________
主要食物来源:动物肝脏、瘦肉、蛋、鱼等
锌:影响人体发育,缺锌会使儿童发育停滞,智力低下,严重时会得_______
主要食物来源:动物肝脏、瘦肉、蛋、鱼等
碘:甲状腺激素的重要成分,缺碘或碘过量均会导致___________
主要食物来源:海产品、加碘盐等
硒:微量的硒可以防晒,过量的硒则是致癌的因素之一
主要食物来源:富硒大米、富硒茶叶等
氟:预防______
主要食物来源:茶叶、海虾等
骨质疏松
贫血症
侏儒症
甲状腺疾病
龋齿
元素与
人体健康
新课讲解
组成物质的化学元素
混合物:由两种或两种以上物质混合而成的物质,如石油、食醋等
纯净物
定义:由__________组成的纯净物
单质
金属单质:如铜、铁等
非金属单质(包括稀有气体单质),如氮气、氧气、氩气等
按性质分
化合物
定义:由____________________组成的纯净物
分类————
按组成和性质分
无机
化合物
氧化物:由______种元素组成,其中有一种元素是
氧的化合物,如H2O、Fe3O4等
酸:解离时产生的阳离子全为H+的化合物,如硫酸、
盐酸等
碱:解离时产生的阴离子全部为OH—的化合物,如
氢氧化钠、氢氧化钙等
盐:解离时生成金属离子(或铵根离子)和酸根离子
的化合物,如氯化钠、硫酸钠等
同种元素
两种或两种以上元素
两(或2)
混合
分离
有机化合物:含碳元素的化合物(CO、CO2、碳酸、碳酸
盐等少数含碳化合物除外),如甲烷、乙醇等
分类 ————
新课讲解
组成物质的化学元素
定义:用___________和数字组合表示纯净物组成的式子
意义
宏观
表示一种物质,如CH4表示_________________
表示这种物质的元素组成,如CH4表示甲烷由_________________组成
表示该物质的一个分子,如CH4表示_______________________
表示物质的分子构成,如CH4表示____________________________________________
________
稀有气体、金属和固态非金属:用组成元素的元素符号表示(碘除外),如氖写为
Ne、铁写为Fe
气态非金属:用元素符号和数字的组合表示,如氧气写为O2
单质
化合物:通常为正左负右,标价交叉,化简复查,如
书写
元素符号
甲烷这种物质
碳元素和氢元素
一个甲烷分子
一个甲烷分子由一个碳原子和四个氢原子构成(合理即可)
微观
新课讲解
物质的组成
注意事项
表示方法:在元素符号或原子团的正上方用符号和数字表示,如 等
a.符号在前,数字在后
b.表示某物质中某元素化合价时,需将整个化学式写出再标该元素的化合价
常见元素及原子团的化合价
常见元素的化合价记忆口诀:一价钾钠氯氢银,二价氧钙钡镁锌,三氯四硅五价磷,
二三铁,二四碳,二四六硫都齐全,铜汞二价最常见,
单质为零永不变(带点显负价)
.
.
常见原子团的化合价
原子团化合价的数值等于所带电荷数
名称 氢氧根 硝酸根 铵根 硫酸根 碳酸根
离子符号 OH- NO3- NH4+ SO42- CO32-
化合价 -1 ______ +1 -2 _______
-1
-2
新课讲解
物质的组成
一般规律
a.在单质种,任何元素的化合价均为_________
b.在金属化合物种,金属元素一般呈____价,非金属元素一般呈_____价,在非金属氧化物种,该非金属元素一般呈______价
c.在化合物中各元素正负化合价代数和为_______
d.在不同的物质中同种元素化合价可能不同
计算
计算原则:化合物中各元素正负化合价的代数和为______
计算步骤
(以Na2FeO4为例)
零
正
负
正
零
零
新课讲解
物质的组成
化学式的相关计算
新课讲解
物质的组成
典例精讲
例1.(2022年山东省泰安市中考)宏观辨识与微观探析是化学学科的核心素养之一、下列宏观事实的微观解释错误的是( )
A.自然界中水的天然循环一水分子不断运动的结果
B.氧气经压缩储存在钢瓶中一氧气分子体积变小了
C.一滴水中大约含有1.67×1021个水分子一水分子很小
D.氧气和液氧都能支持燃烧一物质的分子相同,其化学性质相同
B
典例精讲
例2.(2022年云南省中考)幼儿及青少年缺钙会患佝偻病。因此,每日必须摄入足够量的钙。这里的“钙”指的是( )
A.原子 B.分子
C.元素 D.单质
C
典例精讲
例3.(2022年重庆市中考)缺锌会导致生长迟缓。下图为锌元素的信息,下列说法不正确的是( )
A.锌原子的质量为68.38g
B.锌的原子序数为30
C.锌原子核外有四层电子
D.锌在反应中易失去电子
A
典例精讲
例4.(2022湖南衡阳一模)某同学从衡阳到西藏旅游,
到达西藏后,发现从衡阳带来的密封饼干包装袋鼓起了。
包装袋鼓起的原因是( )
A.袋内饼干的体积变大
B.袋内气体分子的体积变大
C.袋内气体分子个数增多
D.袋内气体分子间的间隙变大
D
C
典例精讲
例5.(2022年湖南省衡阳市中考)我国著名科学家、中国科学院院士张青莲教授主持测定了铟、铱、锑、铕等近十种元素的相对原子质量,为相对原子质量测定作出了卓越贡献。关于钢元素在元素周期表中的部分信息及原了结构示意图如图所示。下列说法正确的是( )
A.铟元素属于非金属元素 B.铟元素的相对原子质量是114.8g
C.铟原子的质子数为49 D.铟的原子结构示意图中X=18
例6. 某物质的化学式为HnMO2n,其相对分子质量是A,则M的相对原子质量是____________,M的化合价是______,当M的化合价不变时,其氧化物化学式为_________,其氧化物的相对分子质量是_______。
A-33n
+3n
M2O3n
2A-18n
典例精讲
C
例7. (2021湖南常德)如图是五种微粒的结构示意图,下列说法不
正确的是( )
A.上述五种微粒只涉及四种元素
B.②③⑤表示的微粒性质较稳定
C.①②④属于原子,③⑤属于阴离子
D.①④对应元素组成化合物的化学式为NaF
-
典例精讲
例8.列对几种有机物的有关叙述中正确的是( )
A. 甲醛(CH2O)分子由碳原子和水分子构成
B. 丙烷(C3H8)由3个碳元素、8个氢元素组成
C. 乙酸(C2H4O2)中碳元素的质量分数为40%
D. 维生素C(C6H8O6)中C、H、O的质量比为3∶4∶3
例9. (2022江苏徐州一模)下列关于青蒿素(化学式为C15H22O5)的说法正确的是( )
A. 青蒿素中含有42个原子
B. 青蒿素是由三种元素组成的有机化合物
C. 青蒿素中氢元素的质量分数最大
D. 青蒿素中C、H元素的质量比为15∶22
C
B
典例精讲
1.(2022四川省成都市青白江中学校二模)下列关于分子的叙述中,正确的是( )
A.一切物质都是由分子构成的
B.分子是化学变化中的最小粒子
C.分子是不能再分的一种粒子
D.分子是保持物质化学性质的最小粒子
D
达标检测
2.(2022成都市通锦中学校二模)用分子的知识解释下列现象,正确的是( )
A.缉毒犬能根据气味发现毒品,是由于分子不断运动
B.铁丝在空气中不燃烧而在氧气中燃烧,说明空气中和氧气中的氧分子化学性质不同
C.变瘪的乒乓球放入热水中能鼓起来,是由于分子受热体积变大
D.降温能使水结成冰,是因为在低温下水分子静止不动
A
达标检测
3.(2022崇州市崇庆中学实验学校二模 ) 下列对分子、原子、离子的认识正确的是( )
A.同种分子排列方式不同,化学性质不同
B.在干冰中,分子因相互作用而静止不动
C.同种原子按不同方式结合,可以构成不同的物质
D.原子得失电子形成离子后,原子核发生了变化
C
达标检测
4.(2022金堂县福兴镇初级中学二模)在下列示意图表示的粒子中,属于原
子的有 (填序号,下同),属于阳离子的有 ,属于阴离子的
有 ,属于同种元素的为 。
②⑤⑥
①④
③
④⑤
达标检测
5.(2022山东聊城二模)下列关于微观粒子说法不
正确的是( )
A.分子的质量一定比原子的质量大
B.同种原子可以构成不同种分子
C.所有原子都由原子核和核外电子构成
D.原子得到或失去电子变成离子
A
达标检测
1.完成配套练习册;
2.完成导学案 。
作业布置
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
