人教版(2019)高中化学选择性必修一 2.3 化学反应的方向 课件(共26张PPT)
文档属性
| 名称 | 人教版(2019)高中化学选择性必修一 2.3 化学反应的方向 课件(共26张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-16 11:56:50 | ||
图片预览







文档简介
(共26张PPT)
化学反应的方向
化学(人教版)选择性必修1 第二章 第三节
碳和氧气燃烧可以得到二氧化碳,而二氧化碳却很难分解成碳和氧气,为什么?
导入情景
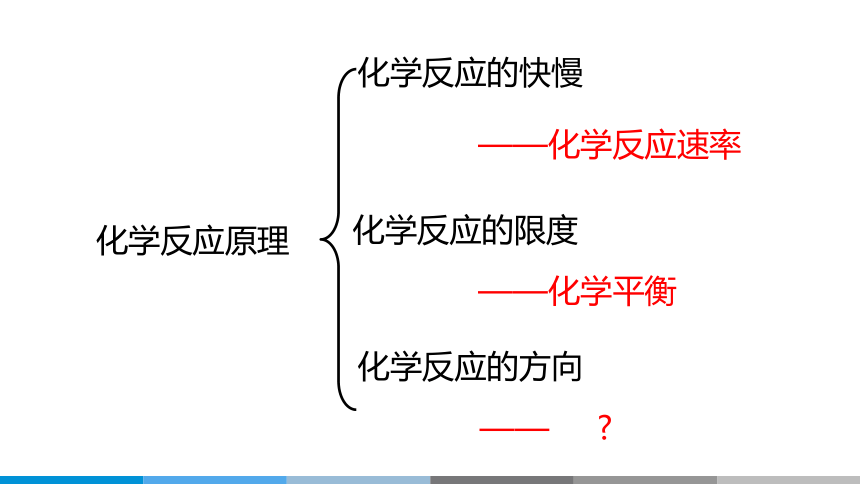
化学反应的快慢
化学反应的限度
化学反应的方向
——化学反应速率
——化学平衡
——
化学反应原理
水总是自发地由高处往低处流
红墨水扩散
导入情景
问题一:什么是自发过程?
花香四溢
铁生锈
问题一:什么是自发反应?
交流讨论
自发反应:在一定条件下,不需外界帮助就能自动进行的化学反应。
想一想:你知道有哪些化学反应能自发进行?
自发过程:在一定条件下,不借助外部力量就能自动进行的过程。
水 流
电 流
热 量
自发
高处
低处
自发
高电位
低电位
自发
高温
低温
交流讨论
问题二:如何判断自发反应?
反应物的总能量高
生成物的总能量低
放热反应
H<0
焓判据:体系趋向于从能量高的状态转变为能量低的状态,
因此反应放热有利于反应自发进行。
总结感悟
科学史话
19世纪初,贝特罗(法)和汤姆逊(丹麦)提出:放热反应可以自发进行,而吸热反应则不能自发进行。
你如何评价贝特罗和汤姆逊的观点?
2NH4Cl(s)+Ba(OH)2·8 H2O(s)=NH3(g)+BaCl2(s)+10H2O(l)
2N2O5(g)=4NO2(g)+O2 (g)
(NH4) 2CO3(s) = NH4HCO3(s)+NH3(g)
反应放热有利于反应自发进行,
但只根据反应的焓变来判断化学反应的方向是不全面的。
H ﹥ 0
想一想:吸热反应都不能自发进行吗?
交流讨论
有序排列的火柴散落时自发地成为无序排列
放在包里的耳机线总是自发地缠绕打结
联系生活
问题三:吸热反应为什么能自发进行?
整理好的房间一段时间后总是会变得杂乱无章
联系生活
固体溶解过程
气体的扩散
纯物质相互接触后自发地混合形成混合物
体系混乱度增大
联系
总结感悟
熵:符号为S,单位为J·mol-1·K-1
1850年, 克劳修斯提出用熵来度量体系的混乱(或无序)程度。体系越混乱,熵越大 。
熵判据:孤立体系或绝热体系中,
反应自发地向熵增的方向进行。
S(水) :69.9 J·mol-1·K-1
S(冰) :47.9 J·mol-1·K-1
S(水蒸气):188.7 J·mol-1·K-1
同一物质:S(g)>S(l)>S(s)。
通常情况下,气体分子数增大的化学反应为熵增的反应。
交流讨论
想一想:同一物质不同状态下熵值相等吗?
1.在下列变化中,体系的熵将发生怎样的变化?
A.少量的食盐溶解于水中
B.气态水变成液态水
C. 2Na2SO3(s)+O2(g)===2Na2SO4(s)
D.CaCO3(s)受热分解为CaO(s)和CO2(g)
E. HCl(g) + NH3(g) = NH4Cl (s)
交流讨论
ΔS<0
ΔS>0
ΔS<0
ΔS<0
ΔS>0
2.下列反应中,熵显著增加的反应是( )
A.CO(g)+2H2(g)===CH3OH(g)
B.3NO2(g)+H2O(l)===2HNO3(aq)+NO(g)
C.2C(s)+O2(g) === 2CO (g)
D.2Hg(l)+O2(g)===2HgO(s)
C
2NH4Cl(s)+Ba(OH)2·8 H2O(s)=NH3(g)+BaCl2(s)+10H2O(l)
2N2O5(g)=4NO2(g)+O2 (g)
(NH4) 2CO3(s) = NH4HCO3(s)+NH3(g)
交流讨论
想一想:下列吸热反应为什么能自发进行?有什么共同点?
上述反应过程中气体分子数增大,反应的熵值增大。
S ﹥ 0
交流讨论
想一想:自发反应一定是熵增加的反应吗?
2H2(g)+O2(g)=2H2O(l) S﹤0
推论: 熵增有利于反应自发进行,
但只根据熵变判断化学反应的方向是不全面的。
结论: 自发反应的方向与焓变、熵变有关,判断反应自发进行的方向,需综合考虑体系的焓变和熵变。
交流讨论
3.下列说法中,正确的是( )
A.冰在室温下自动熔化成水,这是熵增的过程
B.能够自发进行的反应一定是放热反应
C.ΔH<0的反应均是自发进行的反应
D.能够自发进行的反应一定是熵增的过程
A
√
X
2KClO3(s)==2KCl(s)+3O2(g)
H = -78.03 kJ·mol-1 S = +494.4 J·mol-1·K-1
CO(g)==C(s,石墨)+1/2O2(g)
H =+110.5 kJ·mol-1 S = -89.36 J·mol-1·K-1
判断下列反应能否自发进行
4Fe(OH)2(s)+2H2O(l)+O2(g)==4Fe(OH)3(s)
H = -444.3kJ·mol-1 S = -280.1 J·mol-1·K-1
牛刀小试
CaCO3(s)= CaO(s)+ CO2(g)
H = + 178.2 kJ·mol-1 S = +169.6 J·mol-1·K-1
√
X
利用熵变和焓变对自发反应方向性的判断不一致时,怎么办?
√
X
√
X
资料卡片
自由能与化学反应的方向
1876年,吉布斯(美)提出自由能变化 ΔG,并认为化学反应总是向着自由能减小( ΔG < 0)的方向进行,直至达到平衡。
在恒温、恒容的封闭体系中,
G = H – T S (T为热力学温度,为正值)
焓变ΔH 熵变ΔS 反应的自发性
<0 >0
>0 <0
<0 <0
>0 >0
非自发
自发
低温可行
高温可行
资料卡片
G = H – T S
课堂小结
化学反应进行的方向
复合判据
熵判据
焓判据
1. 下列说法中正确的是( )
A.凡是放热反应都是自发的,吸热反应都是非自发的
B.自发反应一定是熵增大,非自发反应一定是熵减小或不变
C.熵增加且放热的反应一定是自发反应
D.非自发反应在任何条件下都不能实现
课堂练习
2.能用焓判据判断下列过程的方向的是( )
A.水总是自发地由高处往低处流
B.室温下冰融化成水
C.有序排列的火柴散落时成为无序排列
D.多次洗牌以后,扑克牌毫无规律混乱排列的几率大
3. 下列反应中,熵减小的反应是( )
A.(NH4)2CO3(s) = NH4HCO3(s) +NH3(g)
B.2N2O5(g) = 4NO2(g) +O2(g)
C.MgCO3(s) = MgO(s) +CO2(g)
D.2CO(g)= 2C(s) +O2(g)
课堂练习
4. 某化学反应其ΔH = -122 kJ·mol-1,ΔS = +231 kJ·mol-1·K-1,则此反应在下列哪种情况下可自发进行( )
A.在任何温度下都能自发进行
B.在任何温度下都不能自发进行
C.仅在高温下自发进行
D.仅在低温下自发进行
5.石墨、金刚石燃烧的热化学方程式分别为
C(石墨) + O2 (g) = CO2(g) ΔH=-393.51 kJ·mol-1
C(金刚石) + O2 (g) = CO2(g) ΔH=-395.41 kJ·mol-1
关于金刚石和石墨的相互转化,下列说法正确的是( )
A.石墨转化成金刚石是自发进行的过程
B.金刚石转化成石墨是自发进行的过程
C.金刚石比石墨更稳定
D.金刚石比石墨能量低
答案: 1. C 2. A 3. D 4. A 5. B
谢 谢 !
化学反应的方向
化学(人教版)选择性必修1 第二章 第三节
碳和氧气燃烧可以得到二氧化碳,而二氧化碳却很难分解成碳和氧气,为什么?
导入情景
化学反应的快慢
化学反应的限度
化学反应的方向
——化学反应速率
——化学平衡
——
化学反应原理
水总是自发地由高处往低处流
红墨水扩散
导入情景
问题一:什么是自发过程?
花香四溢
铁生锈
问题一:什么是自发反应?
交流讨论
自发反应:在一定条件下,不需外界帮助就能自动进行的化学反应。
想一想:你知道有哪些化学反应能自发进行?
自发过程:在一定条件下,不借助外部力量就能自动进行的过程。
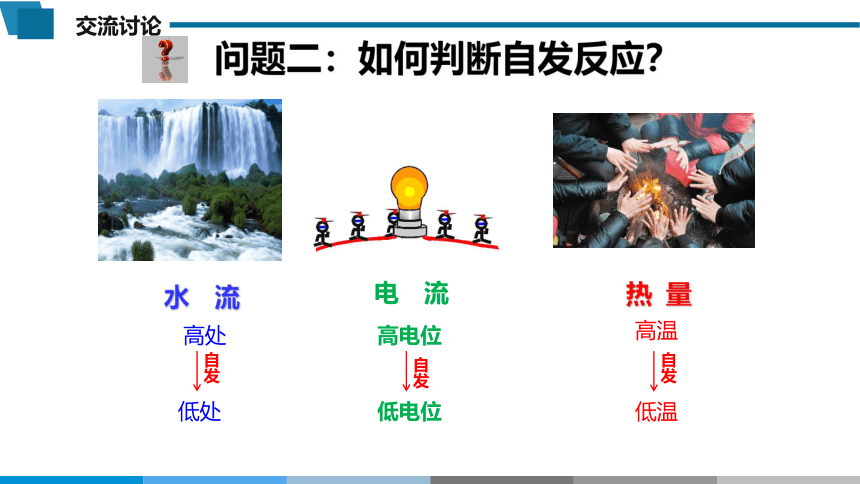
水 流
电 流
热 量
自发
高处
低处
自发
高电位
低电位
自发
高温
低温
交流讨论
问题二:如何判断自发反应?
反应物的总能量高
生成物的总能量低
放热反应
H<0
焓判据:体系趋向于从能量高的状态转变为能量低的状态,
因此反应放热有利于反应自发进行。
总结感悟
科学史话
19世纪初,贝特罗(法)和汤姆逊(丹麦)提出:放热反应可以自发进行,而吸热反应则不能自发进行。
你如何评价贝特罗和汤姆逊的观点?
2NH4Cl(s)+Ba(OH)2·8 H2O(s)=NH3(g)+BaCl2(s)+10H2O(l)
2N2O5(g)=4NO2(g)+O2 (g)
(NH4) 2CO3(s) = NH4HCO3(s)+NH3(g)
反应放热有利于反应自发进行,
但只根据反应的焓变来判断化学反应的方向是不全面的。
H ﹥ 0
想一想:吸热反应都不能自发进行吗?
交流讨论
有序排列的火柴散落时自发地成为无序排列
放在包里的耳机线总是自发地缠绕打结
联系生活
问题三:吸热反应为什么能自发进行?
整理好的房间一段时间后总是会变得杂乱无章
联系生活
固体溶解过程
气体的扩散
纯物质相互接触后自发地混合形成混合物
体系混乱度增大
联系
总结感悟
熵:符号为S,单位为J·mol-1·K-1
1850年, 克劳修斯提出用熵来度量体系的混乱(或无序)程度。体系越混乱,熵越大 。
熵判据:孤立体系或绝热体系中,
反应自发地向熵增的方向进行。
S(水) :69.9 J·mol-1·K-1
S(冰) :47.9 J·mol-1·K-1
S(水蒸气):188.7 J·mol-1·K-1
同一物质:S(g)>S(l)>S(s)。
通常情况下,气体分子数增大的化学反应为熵增的反应。
交流讨论
想一想:同一物质不同状态下熵值相等吗?
1.在下列变化中,体系的熵将发生怎样的变化?
A.少量的食盐溶解于水中
B.气态水变成液态水
C. 2Na2SO3(s)+O2(g)===2Na2SO4(s)
D.CaCO3(s)受热分解为CaO(s)和CO2(g)
E. HCl(g) + NH3(g) = NH4Cl (s)
交流讨论
ΔS<0
ΔS>0
ΔS<0
ΔS<0
ΔS>0
2.下列反应中,熵显著增加的反应是( )
A.CO(g)+2H2(g)===CH3OH(g)
B.3NO2(g)+H2O(l)===2HNO3(aq)+NO(g)
C.2C(s)+O2(g) === 2CO (g)
D.2Hg(l)+O2(g)===2HgO(s)
C
2NH4Cl(s)+Ba(OH)2·8 H2O(s)=NH3(g)+BaCl2(s)+10H2O(l)
2N2O5(g)=4NO2(g)+O2 (g)
(NH4) 2CO3(s) = NH4HCO3(s)+NH3(g)
交流讨论
想一想:下列吸热反应为什么能自发进行?有什么共同点?
上述反应过程中气体分子数增大,反应的熵值增大。
S ﹥ 0
交流讨论
想一想:自发反应一定是熵增加的反应吗?
2H2(g)+O2(g)=2H2O(l) S﹤0
推论: 熵增有利于反应自发进行,
但只根据熵变判断化学反应的方向是不全面的。
结论: 自发反应的方向与焓变、熵变有关,判断反应自发进行的方向,需综合考虑体系的焓变和熵变。
交流讨论
3.下列说法中,正确的是( )
A.冰在室温下自动熔化成水,这是熵增的过程
B.能够自发进行的反应一定是放热反应
C.ΔH<0的反应均是自发进行的反应
D.能够自发进行的反应一定是熵增的过程
A
√
X
2KClO3(s)==2KCl(s)+3O2(g)
H = -78.03 kJ·mol-1 S = +494.4 J·mol-1·K-1
CO(g)==C(s,石墨)+1/2O2(g)
H =+110.5 kJ·mol-1 S = -89.36 J·mol-1·K-1
判断下列反应能否自发进行
4Fe(OH)2(s)+2H2O(l)+O2(g)==4Fe(OH)3(s)
H = -444.3kJ·mol-1 S = -280.1 J·mol-1·K-1
牛刀小试
CaCO3(s)= CaO(s)+ CO2(g)
H = + 178.2 kJ·mol-1 S = +169.6 J·mol-1·K-1
√
X
利用熵变和焓变对自发反应方向性的判断不一致时,怎么办?
√
X
√
X
资料卡片
自由能与化学反应的方向
1876年,吉布斯(美)提出自由能变化 ΔG,并认为化学反应总是向着自由能减小( ΔG < 0)的方向进行,直至达到平衡。
在恒温、恒容的封闭体系中,
G = H – T S (T为热力学温度,为正值)
焓变ΔH 熵变ΔS 反应的自发性
<0 >0
>0 <0
<0 <0
>0 >0
非自发
自发
低温可行
高温可行
资料卡片
G = H – T S
课堂小结
化学反应进行的方向
复合判据
熵判据
焓判据
1. 下列说法中正确的是( )
A.凡是放热反应都是自发的,吸热反应都是非自发的
B.自发反应一定是熵增大,非自发反应一定是熵减小或不变
C.熵增加且放热的反应一定是自发反应
D.非自发反应在任何条件下都不能实现
课堂练习
2.能用焓判据判断下列过程的方向的是( )
A.水总是自发地由高处往低处流
B.室温下冰融化成水
C.有序排列的火柴散落时成为无序排列
D.多次洗牌以后,扑克牌毫无规律混乱排列的几率大
3. 下列反应中,熵减小的反应是( )
A.(NH4)2CO3(s) = NH4HCO3(s) +NH3(g)
B.2N2O5(g) = 4NO2(g) +O2(g)
C.MgCO3(s) = MgO(s) +CO2(g)
D.2CO(g)= 2C(s) +O2(g)
课堂练习
4. 某化学反应其ΔH = -122 kJ·mol-1,ΔS = +231 kJ·mol-1·K-1,则此反应在下列哪种情况下可自发进行( )
A.在任何温度下都能自发进行
B.在任何温度下都不能自发进行
C.仅在高温下自发进行
D.仅在低温下自发进行
5.石墨、金刚石燃烧的热化学方程式分别为
C(石墨) + O2 (g) = CO2(g) ΔH=-393.51 kJ·mol-1
C(金刚石) + O2 (g) = CO2(g) ΔH=-395.41 kJ·mol-1
关于金刚石和石墨的相互转化,下列说法正确的是( )
A.石墨转化成金刚石是自发进行的过程
B.金刚石转化成石墨是自发进行的过程
C.金刚石比石墨更稳定
D.金刚石比石墨能量低
答案: 1. C 2. A 3. D 4. A 5. B
谢 谢 !
