人教版(2019)高中化学选择性必修一 2.4 化学反应的调控 课件(共27张PPT)
文档属性
| 名称 | 人教版(2019)高中化学选择性必修一 2.4 化学反应的调控 课件(共27张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-16 11:56:58 | ||
图片预览







文档简介
(共27张PPT)
化学反应的调控
人教版化学 选择性必修1 第二章 第四节
氮短缺事关人类的存亡,某一天将会有一位化学家寻找出一种方法,将成对的氮原子间三键打破,制出一种能为植物吸收的氮的化合物。
——威廉 克鲁克斯
先合成氨,再进一步将之转化为铵盐或者硝酸盐,变成了土壤可吸收的形式。最好的原料是空气,因为它其中富含氮元素。
——卡尔 ·博施
合成氨的提出
合成氨存在的问题
合成氨很难!
调控外界条件:
温度、浓度、压强、催化剂
化学反应的调控
化学反应速率
化学平衡
哈伯法合成氨
1903年:哈伯发现在常温的条件下,氮、氢难以生成氨,在高温的条件下,氨太易于分解。在1000摄氏度时,合成氨只占到混合气体的0.01,根本没有意义。
升高温度对反应有什么影响?
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
温度
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
温度 25℃ 350℃ 400℃ 450℃ 600℃ 700℃
平衡常数 5×108 1.847 0.507 0.152 0.009 2.6×10-3
合成氨反应的平衡常数随温度的变化
升高温度
化学反应速率
化学平衡
速率加快
平衡逆向移动
温度
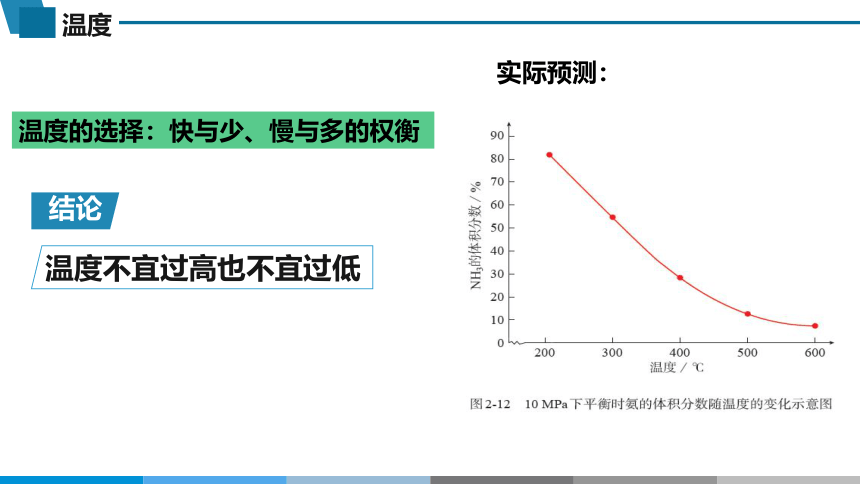
实际预测:
温度不宜过高也不宜过低
结论
温度的选择:快与少、慢与多的权衡
1908年:
哈伯成功地设计出一套精密的高压装置。罗塞格尔和他实验室的机械师们一起创造了新的阀门,将哈伯的设计变成了现实。
增大压强对反应有什么影响?
哈伯法合成氨
压强
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
增大压强
化学反应速率
化学平衡
速率加快
平衡正向移动
理论分析:
实际预测:
压强
压强的选择—成本与效益的博弈
压强越大,对材料的强度和设备的制造要求也越高,需要的动力也越大,这会加大生产投资,可能降低综合经济效益。
压强不宜过高也不宜过低
结论
催化剂
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
合成氨仍然存在的问题?
显著改变反应速率
加入催化剂
化学反应速率
化学平衡
平衡不移动
效果不够理想
铀价格昂贵 ,性质过于敏感
效果好,但储量极少
铁
锇
铀
催化剂
含铅镁的铁
效果好,原料易得,性质稳定
催化剂
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
2007 年 Ertl 证实了 N2与 H2在催化剂表面合成氨的反应历程如图所示。
扩散→吸附→表面反应→脱附→扩散。
合成氨的研究历程
“合成氨”里的中国人:2016年中科院大连化学物理研究所研究团队研制合成了一种新型催化剂,将合成氨的温度、压强分别降到了350 ℃、1 MPa 。
更加节能、降低成本
合成氨的研究历程
温度不宜过高也不宜过低
压强不宜过高也不宜过低
加入含铅镁的铁做催化剂
数据分析
已知:合成氨的催化剂在500℃左右时活性最大
催化剂
反应
速率
温度
500℃左右
转化率
温度
降低温度
数据分析
数据分析
温度/℃ 氨的含量/% 0.1MPa 10MPa 20MPa 30MPa 60MPa 100MPa
200 15.3 81.5 86.4 89.9 95.4 98.8
300 2.20 52.0 64.2 71.0 84.2 92.6
400 0.40 25.1 38.2 47.0 65.2 79.8
500 0.10 10.6 19.1 26.4 42.2 57.5
600 0.05 4.50 9.10 13.8 23.1 31.4
不同条件下,合成氨反应达到化学平衡时反应混合物中氨的含量(体积分数)
浓度
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
增大反应物浓度
化学平衡
平衡正向移动
降低生成物浓度
及时补充N2和H2
增大反应物浓度
原料气循环通过合成塔
原料气循环利用
浓度
还有什么办法可以提高氨的产率?
浓度
降低生成物的浓度
将氨气及时从气态混合物中分离出去
铁触媒催化剂
400~500℃
合成氨常用的生产条件
10MPa~30MPa
原料气循环利用
及时分离出氨气
400~500℃
10MPa~30MPa
解决实际问题
在硫酸工业中,通过下列反应使SO2氧化为SO3:
2SO2(g)+O2(g) 2SO3(g) ΔH=-92.4 kJ·mol-1。下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
(1)从理论分析,为了使二氧化硫尽可能多地转化为三氧化硫,应选择的条件是 。
(2)在实际生产中,选定的温度为400~500℃,原因是 。
(3)在实际生产中,采用的压强为常压,原因是 。
(4)在实际生产中,通入过量的空气,原因是 。
温度/℃ 平衡时SO2的转化率/% 0.1MPa 0.5MPa 1MPa 5MPa 10MPa
450 97.5 98.9 99.2 99.6 99.7
550 85.6 92.9 94.9 97.7 98.3
解决实际问题
(5)工业上采用接触法制备硫酸,V2O5做催化剂,有人提出如下反应历程:
反应Ⅰ: 2SO2+ V2 O5=SO3 + V2 O4 (较慢)
反应Ⅱ: 2SO2+ V2 O5=SO3 + V2 O4 (较快)
由此推知,活化能较大的是反应________填“”或“”。
(6)尾气中的SO2必须回收,原因是 。
化工生产中调控反应的一般思路
化学平衡
实践层面
设备可行
原理分析
反应速率
成本核算
思想理念
“绿色化学”
可持续发展
化学反应
随堂练习
1.1913年德国化学家哈伯发明了以低成本制造大量氨的方法,从而大大满足了当时日益增长的人口对粮食的需求。下列所示是哈伯法的流程图,其中为提高原料转化率而采取的措施是
A.①②③ B.②④⑤
C.①③⑤ D.②③④
√
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
随堂练习
2.据报道,在300 ℃、70 MPa下由二氧化碳和氢气合成乙醇已成为现实:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g),下列叙述错误的是
A.使用Cu -Zn -Fe催化剂可大大提高生产效率
B.反应需在300 ℃下进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
√
随堂练习
3.某温度下,对于反应: N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1 N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是
A.将1 mol氮气、3 mol氢气置于1 L密闭容器中发生反应,放出的热量为92.4 kJ
B.平衡状态由A变为B时,平衡常数K(A)C.上述反应在达到平衡后,增大压强,H2的
转化率增大
D.升高温度,平衡常数K增大
√
化学反应的调控
人教版化学 选择性必修1 第二章 第四节
氮短缺事关人类的存亡,某一天将会有一位化学家寻找出一种方法,将成对的氮原子间三键打破,制出一种能为植物吸收的氮的化合物。
——威廉 克鲁克斯
先合成氨,再进一步将之转化为铵盐或者硝酸盐,变成了土壤可吸收的形式。最好的原料是空气,因为它其中富含氮元素。
——卡尔 ·博施
合成氨的提出
合成氨存在的问题
合成氨很难!
调控外界条件:
温度、浓度、压强、催化剂
化学反应的调控
化学反应速率
化学平衡
哈伯法合成氨
1903年:哈伯发现在常温的条件下,氮、氢难以生成氨,在高温的条件下,氨太易于分解。在1000摄氏度时,合成氨只占到混合气体的0.01,根本没有意义。
升高温度对反应有什么影响?
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
温度
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
温度 25℃ 350℃ 400℃ 450℃ 600℃ 700℃
平衡常数 5×108 1.847 0.507 0.152 0.009 2.6×10-3
合成氨反应的平衡常数随温度的变化
升高温度
化学反应速率
化学平衡
速率加快
平衡逆向移动
温度
实际预测:
温度不宜过高也不宜过低
结论
温度的选择:快与少、慢与多的权衡
1908年:
哈伯成功地设计出一套精密的高压装置。罗塞格尔和他实验室的机械师们一起创造了新的阀门,将哈伯的设计变成了现实。
增大压强对反应有什么影响?
哈伯法合成氨
压强
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
增大压强
化学反应速率
化学平衡
速率加快
平衡正向移动
理论分析:
实际预测:
压强
压强的选择—成本与效益的博弈
压强越大,对材料的强度和设备的制造要求也越高,需要的动力也越大,这会加大生产投资,可能降低综合经济效益。
压强不宜过高也不宜过低
结论
催化剂
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
合成氨仍然存在的问题?
显著改变反应速率
加入催化剂
化学反应速率
化学平衡
平衡不移动
效果不够理想
铀价格昂贵 ,性质过于敏感
效果好,但储量极少
铁
锇
铀
催化剂
含铅镁的铁
效果好,原料易得,性质稳定
催化剂
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
2007 年 Ertl 证实了 N2与 H2在催化剂表面合成氨的反应历程如图所示。
扩散→吸附→表面反应→脱附→扩散。
合成氨的研究历程
“合成氨”里的中国人:2016年中科院大连化学物理研究所研究团队研制合成了一种新型催化剂,将合成氨的温度、压强分别降到了350 ℃、1 MPa 。
更加节能、降低成本
合成氨的研究历程
温度不宜过高也不宜过低
压强不宜过高也不宜过低
加入含铅镁的铁做催化剂
数据分析
已知:合成氨的催化剂在500℃左右时活性最大
催化剂
反应
速率
温度
500℃左右
转化率
温度
降低温度
数据分析
数据分析
温度/℃ 氨的含量/% 0.1MPa 10MPa 20MPa 30MPa 60MPa 100MPa
200 15.3 81.5 86.4 89.9 95.4 98.8
300 2.20 52.0 64.2 71.0 84.2 92.6
400 0.40 25.1 38.2 47.0 65.2 79.8
500 0.10 10.6 19.1 26.4 42.2 57.5
600 0.05 4.50 9.10 13.8 23.1 31.4
不同条件下,合成氨反应达到化学平衡时反应混合物中氨的含量(体积分数)
浓度
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
增大反应物浓度
化学平衡
平衡正向移动
降低生成物浓度
及时补充N2和H2
增大反应物浓度
原料气循环通过合成塔
原料气循环利用
浓度
还有什么办法可以提高氨的产率?
浓度
降低生成物的浓度
将氨气及时从气态混合物中分离出去
铁触媒催化剂
400~500℃
合成氨常用的生产条件
10MPa~30MPa
原料气循环利用
及时分离出氨气
400~500℃
10MPa~30MPa
解决实际问题
在硫酸工业中,通过下列反应使SO2氧化为SO3:
2SO2(g)+O2(g) 2SO3(g) ΔH=-92.4 kJ·mol-1。下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
(1)从理论分析,为了使二氧化硫尽可能多地转化为三氧化硫,应选择的条件是 。
(2)在实际生产中,选定的温度为400~500℃,原因是 。
(3)在实际生产中,采用的压强为常压,原因是 。
(4)在实际生产中,通入过量的空气,原因是 。
温度/℃ 平衡时SO2的转化率/% 0.1MPa 0.5MPa 1MPa 5MPa 10MPa
450 97.5 98.9 99.2 99.6 99.7
550 85.6 92.9 94.9 97.7 98.3
解决实际问题
(5)工业上采用接触法制备硫酸,V2O5做催化剂,有人提出如下反应历程:
反应Ⅰ: 2SO2+ V2 O5=SO3 + V2 O4 (较慢)
反应Ⅱ: 2SO2+ V2 O5=SO3 + V2 O4 (较快)
由此推知,活化能较大的是反应________填“”或“”。
(6)尾气中的SO2必须回收,原因是 。
化工生产中调控反应的一般思路
化学平衡
实践层面
设备可行
原理分析
反应速率
成本核算
思想理念
“绿色化学”
可持续发展
化学反应
随堂练习
1.1913年德国化学家哈伯发明了以低成本制造大量氨的方法,从而大大满足了当时日益增长的人口对粮食的需求。下列所示是哈伯法的流程图,其中为提高原料转化率而采取的措施是
A.①②③ B.②④⑤
C.①③⑤ D.②③④
√
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
随堂练习
2.据报道,在300 ℃、70 MPa下由二氧化碳和氢气合成乙醇已成为现实:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g),下列叙述错误的是
A.使用Cu -Zn -Fe催化剂可大大提高生产效率
B.反应需在300 ℃下进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
√
随堂练习
3.某温度下,对于反应: N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1 N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是
A.将1 mol氮气、3 mol氢气置于1 L密闭容器中发生反应,放出的热量为92.4 kJ
B.平衡状态由A变为B时,平衡常数K(A)
转化率增大
D.升高温度,平衡常数K增大
√
