安徽省六安市舒城县中2022-2023学年高一上学期9月开学考试化学试题(Word版含答案)
文档属性
| 名称 | 安徽省六安市舒城县中2022-2023学年高一上学期9月开学考试化学试题(Word版含答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 209.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-17 00:00:00 | ||
图片预览

文档简介
舒城县中2022-2023学年高一上学期9月开学考试
化学试卷
可能用到的相对原子质量: H 1 O 16 Na 23 Cl 35.5 Al 27 Mg 24 Fe 56
一、单选题(48分)
1.将铁片放入下列溶液中,铁片溶解,溶液质量增加,但没有气体放出的是( )
A.稀硫酸 B. CuSO4溶液 C.Fe2(SO4)3溶液 D. AgNO3溶液
2.纯净铁的物理性质有( )
①光亮的银白色 ②黑色 ③在潮湿的空气中易被腐蚀 ④有延展性 ⑤能导电导热 ⑥硬而脆 ⑦能被磁铁吸引易被磁化
A.①③④⑤⑦ B.①④⑤⑦ C.①③⑤⑦ D.全部
3.向FeCl3溶液中滴入几滴KSCN溶液,出现的现象为( )
A.红色沉淀 B.棕黄色溶液 C.红色溶液 D.浅绿色溶液
4.下列说法不正确的是( )
A.Fe在过量O2中燃烧反应生成Fe2O3
B.Fe与少量的Cl2发生反应生成FeCl3
C.Fe元素在地壳中含量仅次于氧
D.Fe在氧气中燃烧需要在集气瓶中放少量沙子,以免集气瓶炸裂
5.下列有关铁和铁的化合物的说法正确的是( )
A.氧化亚铁与水反应可以生成氢氧化亚铁 B.铁在纯氧中燃烧生成三氧化二铁
C.Fe(OH)3在空气中加强热生成Fe2O3 D.Fe3O4是FeO和Fe2O3的混合物
6.构建知识网络是一种有效的学习方法,化学学习中的“价一类”二维图就是其中一种,如图所示是铁及其化合物的“价一类”二维图,下列有关叙述或化学方程式书写错误的是( )
A.物质A是氧化亚铁
B.可能是
C.该过程在空气中最终变成红褐色
D.的反应类型只能是复分解反应
7.下列各组物质反应后,加KSCN溶液一定显红色的是( )
A.铁粉和稀硫酸反应后的溶液 B.向FeCl3溶液中加入过量铁粉
C.带锈的铁片放入稀硫酸中 D.四氧化三铁和盐酸反应后的溶液
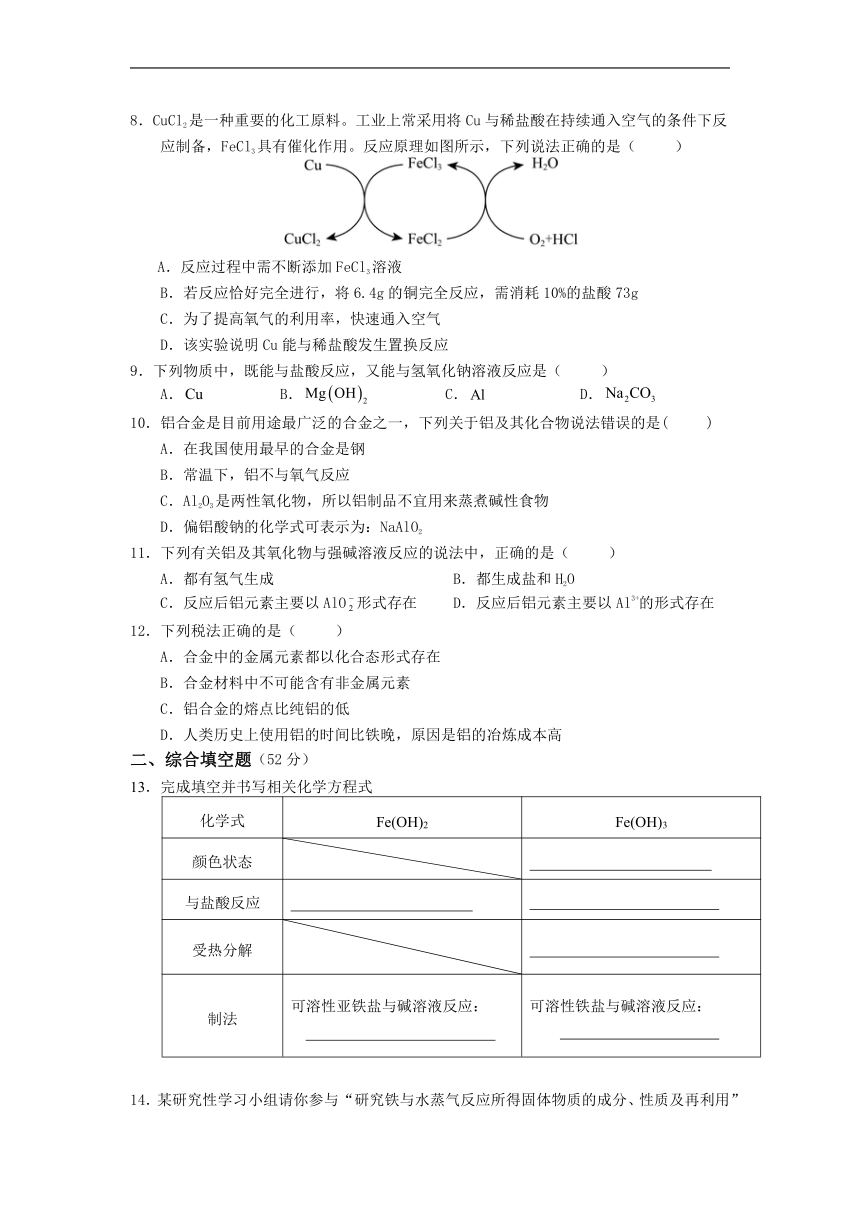
8.CuCl2是一种重要的化工原料。工业上常采用将Cu与稀盐酸在持续通入空气的条件下反应制备,FeCl3具有催化作用。反应原理如图所示,下列说法正确的是( )
A.反应过程中需不断添加FeCl3溶液
B.若反应恰好完全进行,将6.4g的铜完全反应,需消耗10%的盐酸73g
C.为了提高氧气的利用率,快速通入空气
D.该实验说明Cu能与稀盐酸发生置换反应
9.下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应是( )
A. B. C. D.
10.铝合金是目前用途最广泛的合金之一,下列关于铝及其化合物说法错误的是( )
A.在我国使用最早的合金是钢
B.常温下,铝不与氧气反应
C.Al2O3是两性氧化物,所以铝制品不宜用来蒸煮碱性食物
D.偏铝酸钠的化学式可表示为:NaAlO2
11.下列有关铝及其氧化物与强碱溶液反应的说法中,正确的是( )
A.都有氢气生成 B.都生成盐和H2O
C.反应后铝元素主要以AlO形式存在 D.反应后铝元素主要以Al3+的形式存在
12.下列税法正确的是( )
A.合金中的金属元素都以化合态形式存在
B.合金材料中不可能含有非金属元素
C.铝合金的熔点比纯铝的低
D.人类历史上使用铝的时间比铁晚,原因是铝的冶炼成本高
二、综合填空题(52分)
13.完成填空并书写相关化学方程式
化学式 Fe(OH)2 Fe(OH)3
颜色状态
与盐酸反应
受热分解
制法 可溶性亚铁盐与碱溶液反应: 可溶性铁盐与碱溶液反应:
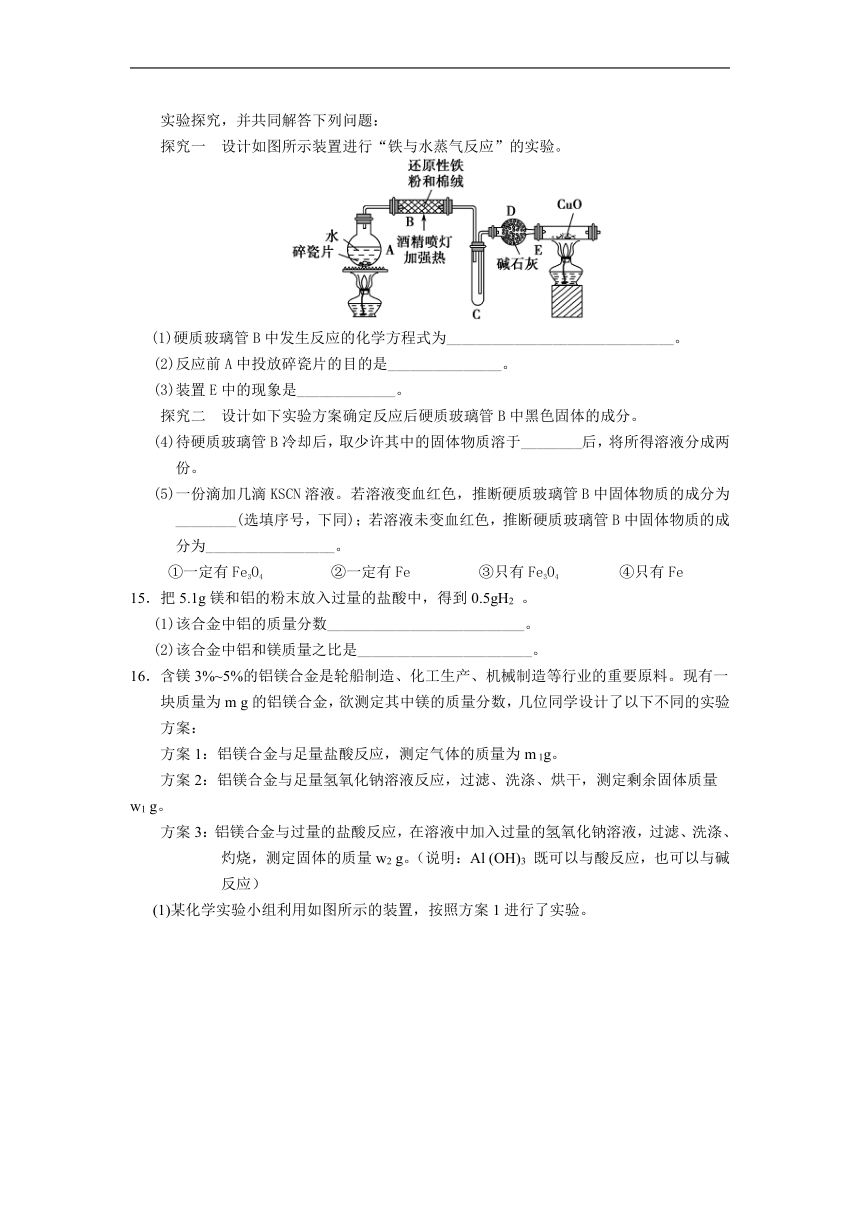
14.某研究性学习小组请你参与“研究铁与水蒸气反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
探究一 设计如图所示装置进行“铁与水蒸气反应”的实验。
(1)硬质玻璃管B中发生反应的化学方程式为______________________________。
(2)反应前A中投放碎瓷片的目的是_______________。
(3)装置E中的现象是_____________。
探究二 设计如下实验方案确定反应后硬质玻璃管B中黑色固体的成分。
(4)待硬质玻璃管B冷却后,取少许其中的固体物质溶于________后,将所得溶液分成两份。
(5)一份滴加几滴KSCN溶液。若溶液变血红色,推断硬质玻璃管B中固体物质的成分为________(选填序号,下同);若溶液未变血红色,推断硬质玻璃管B中固体物质的成分为_________________。
①一定有Fe3O4 ②一定有Fe ③只有Fe3O4 ④只有Fe
15.把5.1g镁和铝的粉末放入过量的盐酸中,得到0.5gH2 。
(1)该合金中铝的质量分数__________________________。
(2)该合金中铝和镁质量之比是_______________________。
16.含镁3%~5%的铝镁合金是轮船制造、化工生产、机械制造等行业的重要原料。现有一块质量为m g的铝镁合金,欲测定其中镁的质量分数,几位同学设计了以下不同的实验方案:
方案1:铝镁合金与足量盐酸反应,测定气体的质量为m 1g。
方案2:铝镁合金与足量氢氧化钠溶液反应,过滤、洗涤、烘干,测定剩余固体质量w1 g。
方案3:铝镁合金与过量的盐酸反应,在溶液中加入过量的氢氧化钠溶液,过滤、洗涤、灼烧,测定固体的质量w2 g。(说明:Al (OH)3 既可以与酸反应,也可以与碱反应)
(1)某化学实验小组利用如图所示的装置,按照方案1进行了实验。
实验装置中有两处明显错误,请指出至少一种: ________________________。
(2)方案2中的化学方程式为_______________________________________________。
(3)方案3中“过滤”操作中用到玻璃棒,玻璃棒的作用是_______________,若按方案3进行实验,测得的镁的质量分数为___________________________________________。
舒城县中2022-2023学年高一上学期9月开学考试
学答题卷
13.
14.
(1) ______________________________________________
(2) ______________________________________________________
(3) _________________________________________________
(4) ____________________________________
(5) ______________________, ________________________________
15.
(1) __________________________ (2) _______________________
16.
(1) ______________________________________________________________
(2) ______________________________________________。
(3) ___________________________________________________,
舒城县中2022-2023学年高一上学期9月开学考试
化学答案
题号 1 2 3 4 5 6
答案 C B C A C D
题号 7 8 9 10 11 12
答案 D B C B C C
13.(17分)
红褐色固体(2分)
Fe(OH)2+2HCl=== FeCl2+2H2O Fe(OH)3+3HCl === FeCl3+3H2O
2Fe(OH)3Fe2O3+3H2O
FeCl2+2NaOH===Fe(OH)2↓+2NaCl FeCl3+3NaOH===Fe(OH)3↓+3NaCl
答案合理即可
14.(18分)
(1)3Fe+4H2O(g)Fe3O4+4H2 (2)防止暴沸
(3)黑色固体变红,右端管壁有水珠 (4)稀硫酸 (5) ① ②
15.(6分) (1) 52.9% (2) 1∶1
16.(11分)
(1)收集气体的集气瓶中进气管插入液面下 、导管在量筒刻度线以上等合理答案即可
(2)
(3)引流,避免液体外溅 (2分)
除特殊标明外,以上每空3分
化学试卷
可能用到的相对原子质量: H 1 O 16 Na 23 Cl 35.5 Al 27 Mg 24 Fe 56
一、单选题(48分)
1.将铁片放入下列溶液中,铁片溶解,溶液质量增加,但没有气体放出的是( )
A.稀硫酸 B. CuSO4溶液 C.Fe2(SO4)3溶液 D. AgNO3溶液
2.纯净铁的物理性质有( )
①光亮的银白色 ②黑色 ③在潮湿的空气中易被腐蚀 ④有延展性 ⑤能导电导热 ⑥硬而脆 ⑦能被磁铁吸引易被磁化
A.①③④⑤⑦ B.①④⑤⑦ C.①③⑤⑦ D.全部
3.向FeCl3溶液中滴入几滴KSCN溶液,出现的现象为( )
A.红色沉淀 B.棕黄色溶液 C.红色溶液 D.浅绿色溶液
4.下列说法不正确的是( )
A.Fe在过量O2中燃烧反应生成Fe2O3
B.Fe与少量的Cl2发生反应生成FeCl3
C.Fe元素在地壳中含量仅次于氧
D.Fe在氧气中燃烧需要在集气瓶中放少量沙子,以免集气瓶炸裂
5.下列有关铁和铁的化合物的说法正确的是( )
A.氧化亚铁与水反应可以生成氢氧化亚铁 B.铁在纯氧中燃烧生成三氧化二铁
C.Fe(OH)3在空气中加强热生成Fe2O3 D.Fe3O4是FeO和Fe2O3的混合物
6.构建知识网络是一种有效的学习方法,化学学习中的“价一类”二维图就是其中一种,如图所示是铁及其化合物的“价一类”二维图,下列有关叙述或化学方程式书写错误的是( )
A.物质A是氧化亚铁
B.可能是
C.该过程在空气中最终变成红褐色
D.的反应类型只能是复分解反应
7.下列各组物质反应后,加KSCN溶液一定显红色的是( )
A.铁粉和稀硫酸反应后的溶液 B.向FeCl3溶液中加入过量铁粉
C.带锈的铁片放入稀硫酸中 D.四氧化三铁和盐酸反应后的溶液
8.CuCl2是一种重要的化工原料。工业上常采用将Cu与稀盐酸在持续通入空气的条件下反应制备,FeCl3具有催化作用。反应原理如图所示,下列说法正确的是( )
A.反应过程中需不断添加FeCl3溶液
B.若反应恰好完全进行,将6.4g的铜完全反应,需消耗10%的盐酸73g
C.为了提高氧气的利用率,快速通入空气
D.该实验说明Cu能与稀盐酸发生置换反应
9.下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应是( )
A. B. C. D.
10.铝合金是目前用途最广泛的合金之一,下列关于铝及其化合物说法错误的是( )
A.在我国使用最早的合金是钢
B.常温下,铝不与氧气反应
C.Al2O3是两性氧化物,所以铝制品不宜用来蒸煮碱性食物
D.偏铝酸钠的化学式可表示为:NaAlO2
11.下列有关铝及其氧化物与强碱溶液反应的说法中,正确的是( )
A.都有氢气生成 B.都生成盐和H2O
C.反应后铝元素主要以AlO形式存在 D.反应后铝元素主要以Al3+的形式存在
12.下列税法正确的是( )
A.合金中的金属元素都以化合态形式存在
B.合金材料中不可能含有非金属元素
C.铝合金的熔点比纯铝的低
D.人类历史上使用铝的时间比铁晚,原因是铝的冶炼成本高
二、综合填空题(52分)
13.完成填空并书写相关化学方程式
化学式 Fe(OH)2 Fe(OH)3
颜色状态
与盐酸反应
受热分解
制法 可溶性亚铁盐与碱溶液反应: 可溶性铁盐与碱溶液反应:
14.某研究性学习小组请你参与“研究铁与水蒸气反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
探究一 设计如图所示装置进行“铁与水蒸气反应”的实验。
(1)硬质玻璃管B中发生反应的化学方程式为______________________________。
(2)反应前A中投放碎瓷片的目的是_______________。
(3)装置E中的现象是_____________。
探究二 设计如下实验方案确定反应后硬质玻璃管B中黑色固体的成分。
(4)待硬质玻璃管B冷却后,取少许其中的固体物质溶于________后,将所得溶液分成两份。
(5)一份滴加几滴KSCN溶液。若溶液变血红色,推断硬质玻璃管B中固体物质的成分为________(选填序号,下同);若溶液未变血红色,推断硬质玻璃管B中固体物质的成分为_________________。
①一定有Fe3O4 ②一定有Fe ③只有Fe3O4 ④只有Fe
15.把5.1g镁和铝的粉末放入过量的盐酸中,得到0.5gH2 。
(1)该合金中铝的质量分数__________________________。
(2)该合金中铝和镁质量之比是_______________________。
16.含镁3%~5%的铝镁合金是轮船制造、化工生产、机械制造等行业的重要原料。现有一块质量为m g的铝镁合金,欲测定其中镁的质量分数,几位同学设计了以下不同的实验方案:
方案1:铝镁合金与足量盐酸反应,测定气体的质量为m 1g。
方案2:铝镁合金与足量氢氧化钠溶液反应,过滤、洗涤、烘干,测定剩余固体质量w1 g。
方案3:铝镁合金与过量的盐酸反应,在溶液中加入过量的氢氧化钠溶液,过滤、洗涤、灼烧,测定固体的质量w2 g。(说明:Al (OH)3 既可以与酸反应,也可以与碱反应)
(1)某化学实验小组利用如图所示的装置,按照方案1进行了实验。
实验装置中有两处明显错误,请指出至少一种: ________________________。
(2)方案2中的化学方程式为_______________________________________________。
(3)方案3中“过滤”操作中用到玻璃棒,玻璃棒的作用是_______________,若按方案3进行实验,测得的镁的质量分数为___________________________________________。
舒城县中2022-2023学年高一上学期9月开学考试
学答题卷
13.
14.
(1) ______________________________________________
(2) ______________________________________________________
(3) _________________________________________________
(4) ____________________________________
(5) ______________________, ________________________________
15.
(1) __________________________ (2) _______________________
16.
(1) ______________________________________________________________
(2) ______________________________________________。
(3) ___________________________________________________,
舒城县中2022-2023学年高一上学期9月开学考试
化学答案
题号 1 2 3 4 5 6
答案 C B C A C D
题号 7 8 9 10 11 12
答案 D B C B C C
13.(17分)
红褐色固体(2分)
Fe(OH)2+2HCl=== FeCl2+2H2O Fe(OH)3+3HCl === FeCl3+3H2O
2Fe(OH)3Fe2O3+3H2O
FeCl2+2NaOH===Fe(OH)2↓+2NaCl FeCl3+3NaOH===Fe(OH)3↓+3NaCl
答案合理即可
14.(18分)
(1)3Fe+4H2O(g)Fe3O4+4H2 (2)防止暴沸
(3)黑色固体变红,右端管壁有水珠 (4)稀硫酸 (5) ① ②
15.(6分) (1) 52.9% (2) 1∶1
16.(11分)
(1)收集气体的集气瓶中进气管插入液面下 、导管在量筒刻度线以上等合理答案即可
(2)
(3)引流,避免液体外溅 (2分)
除特殊标明外,以上每空3分
同课章节目录
