鲁教版(五四制)化学九年级全册 第三单元3.3.2 海水制碱第二课时 课件(共22张PPT)
文档属性
| 名称 | 鲁教版(五四制)化学九年级全册 第三单元3.3.2 海水制碱第二课时 课件(共22张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 138.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-19 07:00:28 | ||
图片预览







文档简介
(共22张PPT)
鲁教版五四制九年级化学全一册
3.3.2 海水制碱第二课时
第三单元
教学目标
1. 认识纯碱的重要性质;知道工业制碱的反应原理;了解纯碱的应用。
2.通过对氨碱法制碱反应原理的分析,树立元素守恒观。
教学重难点
纯碱性质的探究;碳酸根离子的检验
氨碱法制纯碱的原理;盐的性质;元素守恒观的建立
一
课堂导入
复习旧知:
1、氨碱法制碱的化学原理是什么?
①NaCl +NH3+CO2+H2O== NaHCO3+ NH4Cl
②2NaHCO3 ======= Na2CO3+CO2↑+ H2O
△
③Ca(OH)2+ 2NH4Cl == CaCl2 +2NH3 ↑ +2H2O
2、盐的化学性质都学习了哪些?
①盐与酸相互交换成分发生复分解反应,生成新的盐和新的碱
②可溶性的盐与可溶性的碱相互交换成分发生复分解反应,生成新的盐和新的碱
③两种可溶性的盐相互交换成分发生复分解反应,生成另外两种新的盐
二
师生互动,共学新知
一、复分解反应的定义
两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应
表达式:AB + CD→ AD+ CB
例子:
6HCl + Fe2O3=2FeCl3 + 3H2O
H2SO4 + BaCl2=BaSO4 ↓+ 2HCl
2NaOH + CuCl2=Cu(OH)2 ↓+ 2NaCl
2HCl + Ba(OH)2=BaCl2 + 2H2O
二
师生互动,共学新知
二、复分解反应发生的条件
生成物中
有沉淀(↓)
或有气体(↑)
或有水(H2O)
反应必须在溶液中进行
三个条件中,满足其中一个条件,复分解反应便能发生
二
师生互动,共学新知
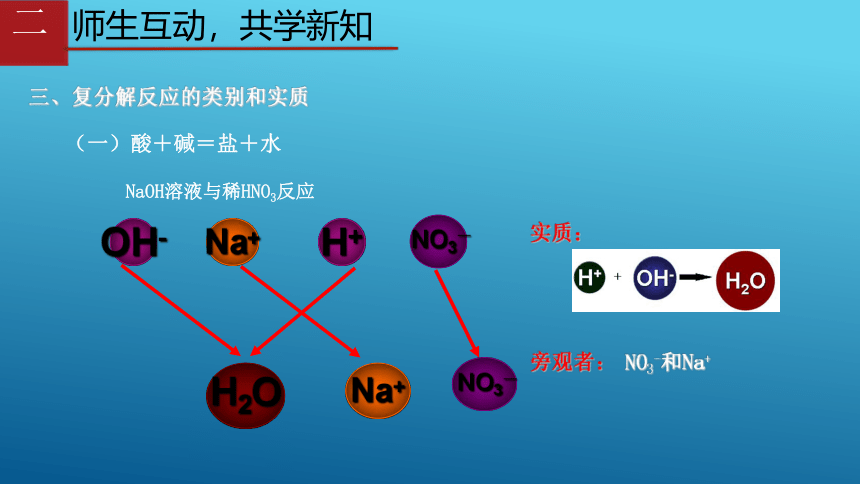
三、复分解反应的类别和实质
(一)酸+碱=盐+水
NaOH溶液与稀HNO3反应
OH-
Na+
H+
NO3-
H2O
Na+
NO3-
实质:
旁观者:
NO3-和Na+
二
师生互动,共学新知
HCl+NaOH==NaCl+H2O
离子的角度:H+ +Cl-+Na++OH-==Na++Cl-+H2O
反应的实质:H++OH==H2O
HCl+KOH==KCl+H2O
离子的角度:H++Cl-+K++OH-==K++Cl-+H2O
反应的实质:H++OH-==H2O
2HCl+Ca(OH)2=CaCl2+2H2O
离子的角度:2H+ +2Cl-+Ca2++2OH-==2Cl-+Ca2++2H2O
反应的实质:H++OH-==H2O
H2SO4+2NaOH==Na2SO4+2H2O
离子的角度:2H++SO42-+2Na++2OH-=SO42-+2Na++2H2O
反应的实质:H++OH-==H2O
二
师生互动,共学新知
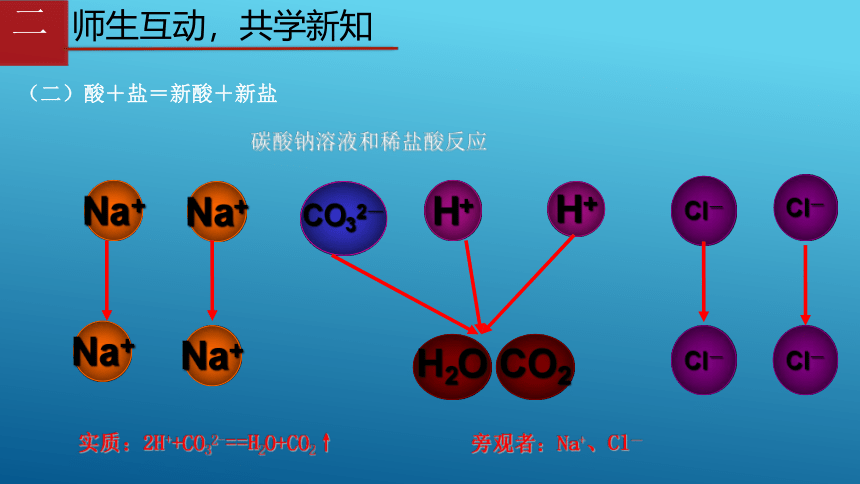
(二)酸+盐=新酸+新盐
碳酸钠溶液和稀盐酸反应
Na+
Na+
CO32-
Cl-
Cl-
H+
H+
H2O
CO2
Na+
Na+
Cl-
Cl-
实质:2H++CO32-==H2O+CO2↑
旁观者:Na+、Cl-
二
师生互动,共学新知
H2SO4+Na2CO3=Na2SO4+H2O+CO2↑
离子角度:2H++SO42-+2Na++CO32-=SO42-+2Na++H2O+CO2↑
反应的实质:2H++CO32-=H2O+CO2↑
H2SO4+2NaHCO3=Na2SO4+2H2O+2CO2↑
离子角度:2H++SO42-+2Na++2HCO3-=SO42-+2Na++2H2O+2CO2↑
反应的实质: H+ + HCO3- = H2O+CO2↑
2HCl+K2CO3==2KCl+H2O+CO2↑
离子角度:2H+ +2Cl-+2K++CO32-=2Cl-+2K++H2O+CO2↑
反应的实质:2H++CO32-=H2O+CO2↑
HCl+NaHCO3=NaCl+H2O+CO2↑
离子角度:H+ +Cl-+Na++HCO3-=Cl-+Na++H2O+CO2↑
反应的实质:H++HCO3-=H2O+CO2↑
二
师生互动,共学新知
HCl+AgNO3=AgCl↓+HNO3
离子角度:H+ +Cl- +Ag++NO3-=H++NO3-+AgCl↓
反应的实质:Cl- +Ag+=AgCl↓
H2SO4+BaCl2=BaSO4↓+2HCl
离子角度:2H++SO42-+Ba2+ +2Cl-=BaSO4↓+2H++2Cl-
反应的实质:SO42-+Ba2+=BaSO4↓
H2SO4+Ba(NO3)2==BaSO4↓+2HNO3
离子角度:2H++SO42-+Ba2++2NO3-=2H++2NO3-+BaSO4↓
反应的实质:SO42-+Ba2+=BaSO4↓
2HCl+Na2CO3==2NaCl+H2O+CO2↑
离子角度:2H+ +2Cl-+2Na++CO32-=2Cl-+2Na++H2O+CO2↑
反应的实质:2H++CO32-=H2O+CO2↑
二
师生互动,共学新知
(三)碱+盐=新碱+新盐
氢氧化钠溶液与氯化镁溶液的反应
Na+
Na+
OH-
OH-
Mg2+
Cl-
Cl-
Mg(OH)2
Na+
Na+
Cl-
Cl-
实质:Mg2++2OH-==Mg(OH)2↓
旁观者:Na+、Cl-
二
师生互动,共学新知
2NaOH+CUCl2==2NaCl+CU(OH)2↓
离子角度: 2Na++2OH-+CU2++2Cl-=2Na++2Cl+CU(OH)2↓
反应的实质:2OH-+CU2+=CU(OH)2↓
3NaOH+AlCl3==Al(OH)3↓+3NaCl
离子角度: 3Na++3OH-+Al3++3Cl-=3Na++3Cl-+Al(OH)3↓
反应的实质:3OH-+Al3+=Al(OH)3↓
3NaOH+FeCl3==Fe(OH)3↓+3NaCl
离子角度: 3Na++3OH-+Fe3++3Cl-=3Na++3Cl-+Fe(OH)3↓
反应的实质:3OH-+Fe3+=Fe(OH)3↓
NaOH+NH4Cl==NaCl+NH3↑+H2O
离子角度: Na++OH-+NH4++Cl-==NH3↑+H2O+Cl-+Na+
反应的实质:OH-+NH4+==NH3↑+H2O
二
师生互动,共学新知
(四)盐1+盐2=盐3+盐4
碳酸钠溶液与氯化钡溶液的反应
Na+
Na+
CO32-
Cl-
Cl-
Ba2+
BaCO3
Na+
Na+
Cl-
Cl-
实质:Ba2++CO32-==BaCO3↓
旁观者:Na+、Cl-
二
师生互动,共学新知
AgNO3+NH4Cl==NH4NO3+AgCl↓
离子角度:Ag++NO3-+NH4++Cl-==NO3-+NH4++AgCl↓
反应的实质:Cl- +Ag+=AgCl↓
K2CO3+Ca(NO3)2==2KNO3+CaCO3↓
离子角度:2K++CO32-+Ca2++2NO3-==2K++2NO3-+CaCO3↓
反应的实质:CO32-+Ca2+==CaCO3↓
K2CO3+2AgNO3==2KNO3+Ag2CO3↓
离子角度:2K++CO32-+Ag2++2NO3-==2K++2NO3-+Ag2CO3↓
反应的实质:CO32-+Ag+==Ag2CO3↓
Cu2SO4+Ba(NO3)2==Cu(NO3)2+BaSO4↓
离子角度:Cu2++SO42-+Ba2++2NO3-==Cu2++2NO3-+BaSO4↓
反应的实质:SO42-+Ba2+==BaSO4↓
二
师生互动,共学新知
(五)酸+金属氧化物=盐+水
稀盐酸除去铁锈:6HCl+Fe2O3==2FeCl3+3H2O
稀硫酸除去铁锈:3H2SO4+Fe2O3==Fe2(SO4)3+3H2O
稀盐酸与氧化铜:2HCl+CuO=CUCl2+H2O
稀硫酸与氧化铜:H2SO4+CuO=CUSO4+H2O
稀盐酸和氧化钾:2HCl+K2O=2KCl+H2O
稀硫酸和氧化钾:H2SO4+K2O=K2SO4+H2O
此类复分解反应在初中阶段不谈论反应的实质
二
师生互动,共学新知
四、复分解反应的应用---离子共存
(一)条件:如果一种阳离子和一种阴离子结合后可以生成水、气体或者沉淀,则两者不能共存。
(二)知识点:
H+:OH-、CO32-、HCO3-、 S2--、HS-等;
OH-:H+、NH4+、Fe3+、Cu2+、Fe2+、Mg2+、Al3+等;
CO32-:H+、Ba2+、Ca2+、Ag+ 等;
SO42-:Ba2+等;
Cl-:Ag+等。
三
课堂检测
1、只用一种试剂就能把NaOH溶液、稀盐酸和澄清石灰水鉴别开来,这种试剂可以是下列物质中的___________。
A、BaCl2溶液 B、石蕊试液 C、酚酞试液
D、Na2CO3溶液 E、pH试纸
2、下列各组物的溶液不用其他试剂就可以鉴别出来的是( )
A. HCl CuCl2 NaNO3 Na2SO4
B. BaCl2 Na2CO3 HCl (NH4)2CO3
C. FeCl3 NaCl NaOH HCl
D. Na2CO3 Na2SO4 H2SO4 HCl
D
BC
三
课堂检测
3、在无色透明的溶液中,下列各组离子能大量共存的是( )A. H+、Cl-、Ba2+、CO32- B . Ag+、K+、NO3-、Cl-
C . K+、OH-、Cl-、Na+ D . Fe3+、Cl-、NO3-、Na+
4、若在加入镁粉能放出氢气的溶液中,分别加入下列各组离子,可能共存的是( )
A . NH4+、Na+、NO3-、CO32- B. Ba2+、Na+、Mg2+、HCO3-
C. Ca2+、K+、NO3-、Cl- D. NO3-、K+、SO42-、OH-
C
C
三
课堂检测
5、有甲、乙两个相邻的工厂,排放的污水经过初步处理后只溶有:Ag+、Ba2+、Fe3+、Na+、CI-、SO42-、OH-、NO3﹣中的各不相同的4种离子,若单独排放仍会造成环境污染,如按适当比例混合排放,则污染程度大大降低,现又测得甲厂污水pH>7,
试推断: (1)甲厂污水中含有的4种离子可能是__________ ________;
(2)乙厂污水中含有的4种离子可能是____________________________。
Na+、OH-、CI-、SO42-
Ag+、Fe3+、Ba2+、NO3﹣
四
课堂小结
1、氨碱法制碱(索尔维制碱法)
2、复分解反应的分类、实质
3、离子共存问题
谢谢观赏
鲁教版五四制九年级化学全一册
3.3.2 海水制碱第二课时
第三单元
教学目标
1. 认识纯碱的重要性质;知道工业制碱的反应原理;了解纯碱的应用。
2.通过对氨碱法制碱反应原理的分析,树立元素守恒观。
教学重难点
纯碱性质的探究;碳酸根离子的检验
氨碱法制纯碱的原理;盐的性质;元素守恒观的建立
一
课堂导入
复习旧知:
1、氨碱法制碱的化学原理是什么?
①NaCl +NH3+CO2+H2O== NaHCO3+ NH4Cl
②2NaHCO3 ======= Na2CO3+CO2↑+ H2O
△
③Ca(OH)2+ 2NH4Cl == CaCl2 +2NH3 ↑ +2H2O
2、盐的化学性质都学习了哪些?
①盐与酸相互交换成分发生复分解反应,生成新的盐和新的碱
②可溶性的盐与可溶性的碱相互交换成分发生复分解反应,生成新的盐和新的碱
③两种可溶性的盐相互交换成分发生复分解反应,生成另外两种新的盐
二
师生互动,共学新知
一、复分解反应的定义
两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应
表达式:AB + CD→ AD+ CB
例子:
6HCl + Fe2O3=2FeCl3 + 3H2O
H2SO4 + BaCl2=BaSO4 ↓+ 2HCl
2NaOH + CuCl2=Cu(OH)2 ↓+ 2NaCl
2HCl + Ba(OH)2=BaCl2 + 2H2O
二
师生互动,共学新知
二、复分解反应发生的条件
生成物中
有沉淀(↓)
或有气体(↑)
或有水(H2O)
反应必须在溶液中进行
三个条件中,满足其中一个条件,复分解反应便能发生
二
师生互动,共学新知
三、复分解反应的类别和实质
(一)酸+碱=盐+水
NaOH溶液与稀HNO3反应
OH-
Na+
H+
NO3-
H2O
Na+
NO3-
实质:
旁观者:
NO3-和Na+
二
师生互动,共学新知
HCl+NaOH==NaCl+H2O
离子的角度:H+ +Cl-+Na++OH-==Na++Cl-+H2O
反应的实质:H++OH==H2O
HCl+KOH==KCl+H2O
离子的角度:H++Cl-+K++OH-==K++Cl-+H2O
反应的实质:H++OH-==H2O
2HCl+Ca(OH)2=CaCl2+2H2O
离子的角度:2H+ +2Cl-+Ca2++2OH-==2Cl-+Ca2++2H2O
反应的实质:H++OH-==H2O
H2SO4+2NaOH==Na2SO4+2H2O
离子的角度:2H++SO42-+2Na++2OH-=SO42-+2Na++2H2O
反应的实质:H++OH-==H2O
二
师生互动,共学新知
(二)酸+盐=新酸+新盐
碳酸钠溶液和稀盐酸反应
Na+
Na+
CO32-
Cl-
Cl-
H+
H+
H2O
CO2
Na+
Na+
Cl-
Cl-
实质:2H++CO32-==H2O+CO2↑
旁观者:Na+、Cl-
二
师生互动,共学新知
H2SO4+Na2CO3=Na2SO4+H2O+CO2↑
离子角度:2H++SO42-+2Na++CO32-=SO42-+2Na++H2O+CO2↑
反应的实质:2H++CO32-=H2O+CO2↑
H2SO4+2NaHCO3=Na2SO4+2H2O+2CO2↑
离子角度:2H++SO42-+2Na++2HCO3-=SO42-+2Na++2H2O+2CO2↑
反应的实质: H+ + HCO3- = H2O+CO2↑
2HCl+K2CO3==2KCl+H2O+CO2↑
离子角度:2H+ +2Cl-+2K++CO32-=2Cl-+2K++H2O+CO2↑
反应的实质:2H++CO32-=H2O+CO2↑
HCl+NaHCO3=NaCl+H2O+CO2↑
离子角度:H+ +Cl-+Na++HCO3-=Cl-+Na++H2O+CO2↑
反应的实质:H++HCO3-=H2O+CO2↑
二
师生互动,共学新知
HCl+AgNO3=AgCl↓+HNO3
离子角度:H+ +Cl- +Ag++NO3-=H++NO3-+AgCl↓
反应的实质:Cl- +Ag+=AgCl↓
H2SO4+BaCl2=BaSO4↓+2HCl
离子角度:2H++SO42-+Ba2+ +2Cl-=BaSO4↓+2H++2Cl-
反应的实质:SO42-+Ba2+=BaSO4↓
H2SO4+Ba(NO3)2==BaSO4↓+2HNO3
离子角度:2H++SO42-+Ba2++2NO3-=2H++2NO3-+BaSO4↓
反应的实质:SO42-+Ba2+=BaSO4↓
2HCl+Na2CO3==2NaCl+H2O+CO2↑
离子角度:2H+ +2Cl-+2Na++CO32-=2Cl-+2Na++H2O+CO2↑
反应的实质:2H++CO32-=H2O+CO2↑
二
师生互动,共学新知
(三)碱+盐=新碱+新盐
氢氧化钠溶液与氯化镁溶液的反应
Na+
Na+
OH-
OH-
Mg2+
Cl-
Cl-
Mg(OH)2
Na+
Na+
Cl-
Cl-
实质:Mg2++2OH-==Mg(OH)2↓
旁观者:Na+、Cl-
二
师生互动,共学新知
2NaOH+CUCl2==2NaCl+CU(OH)2↓
离子角度: 2Na++2OH-+CU2++2Cl-=2Na++2Cl+CU(OH)2↓
反应的实质:2OH-+CU2+=CU(OH)2↓
3NaOH+AlCl3==Al(OH)3↓+3NaCl
离子角度: 3Na++3OH-+Al3++3Cl-=3Na++3Cl-+Al(OH)3↓
反应的实质:3OH-+Al3+=Al(OH)3↓
3NaOH+FeCl3==Fe(OH)3↓+3NaCl
离子角度: 3Na++3OH-+Fe3++3Cl-=3Na++3Cl-+Fe(OH)3↓
反应的实质:3OH-+Fe3+=Fe(OH)3↓
NaOH+NH4Cl==NaCl+NH3↑+H2O
离子角度: Na++OH-+NH4++Cl-==NH3↑+H2O+Cl-+Na+
反应的实质:OH-+NH4+==NH3↑+H2O
二
师生互动,共学新知
(四)盐1+盐2=盐3+盐4
碳酸钠溶液与氯化钡溶液的反应
Na+
Na+
CO32-
Cl-
Cl-
Ba2+
BaCO3
Na+
Na+
Cl-
Cl-
实质:Ba2++CO32-==BaCO3↓
旁观者:Na+、Cl-
二
师生互动,共学新知
AgNO3+NH4Cl==NH4NO3+AgCl↓
离子角度:Ag++NO3-+NH4++Cl-==NO3-+NH4++AgCl↓
反应的实质:Cl- +Ag+=AgCl↓
K2CO3+Ca(NO3)2==2KNO3+CaCO3↓
离子角度:2K++CO32-+Ca2++2NO3-==2K++2NO3-+CaCO3↓
反应的实质:CO32-+Ca2+==CaCO3↓
K2CO3+2AgNO3==2KNO3+Ag2CO3↓
离子角度:2K++CO32-+Ag2++2NO3-==2K++2NO3-+Ag2CO3↓
反应的实质:CO32-+Ag+==Ag2CO3↓
Cu2SO4+Ba(NO3)2==Cu(NO3)2+BaSO4↓
离子角度:Cu2++SO42-+Ba2++2NO3-==Cu2++2NO3-+BaSO4↓
反应的实质:SO42-+Ba2+==BaSO4↓
二
师生互动,共学新知
(五)酸+金属氧化物=盐+水
稀盐酸除去铁锈:6HCl+Fe2O3==2FeCl3+3H2O
稀硫酸除去铁锈:3H2SO4+Fe2O3==Fe2(SO4)3+3H2O
稀盐酸与氧化铜:2HCl+CuO=CUCl2+H2O
稀硫酸与氧化铜:H2SO4+CuO=CUSO4+H2O
稀盐酸和氧化钾:2HCl+K2O=2KCl+H2O
稀硫酸和氧化钾:H2SO4+K2O=K2SO4+H2O
此类复分解反应在初中阶段不谈论反应的实质
二
师生互动,共学新知
四、复分解反应的应用---离子共存
(一)条件:如果一种阳离子和一种阴离子结合后可以生成水、气体或者沉淀,则两者不能共存。
(二)知识点:
H+:OH-、CO32-、HCO3-、 S2--、HS-等;
OH-:H+、NH4+、Fe3+、Cu2+、Fe2+、Mg2+、Al3+等;
CO32-:H+、Ba2+、Ca2+、Ag+ 等;
SO42-:Ba2+等;
Cl-:Ag+等。
三
课堂检测
1、只用一种试剂就能把NaOH溶液、稀盐酸和澄清石灰水鉴别开来,这种试剂可以是下列物质中的___________。
A、BaCl2溶液 B、石蕊试液 C、酚酞试液
D、Na2CO3溶液 E、pH试纸
2、下列各组物的溶液不用其他试剂就可以鉴别出来的是( )
A. HCl CuCl2 NaNO3 Na2SO4
B. BaCl2 Na2CO3 HCl (NH4)2CO3
C. FeCl3 NaCl NaOH HCl
D. Na2CO3 Na2SO4 H2SO4 HCl
D
BC
三
课堂检测
3、在无色透明的溶液中,下列各组离子能大量共存的是( )A. H+、Cl-、Ba2+、CO32- B . Ag+、K+、NO3-、Cl-
C . K+、OH-、Cl-、Na+ D . Fe3+、Cl-、NO3-、Na+
4、若在加入镁粉能放出氢气的溶液中,分别加入下列各组离子,可能共存的是( )
A . NH4+、Na+、NO3-、CO32- B. Ba2+、Na+、Mg2+、HCO3-
C. Ca2+、K+、NO3-、Cl- D. NO3-、K+、SO42-、OH-
C
C
三
课堂检测
5、有甲、乙两个相邻的工厂,排放的污水经过初步处理后只溶有:Ag+、Ba2+、Fe3+、Na+、CI-、SO42-、OH-、NO3﹣中的各不相同的4种离子,若单独排放仍会造成环境污染,如按适当比例混合排放,则污染程度大大降低,现又测得甲厂污水pH>7,
试推断: (1)甲厂污水中含有的4种离子可能是__________ ________;
(2)乙厂污水中含有的4种离子可能是____________________________。
Na+、OH-、CI-、SO42-
Ag+、Fe3+、Ba2+、NO3﹣
四
课堂小结
1、氨碱法制碱(索尔维制碱法)
2、复分解反应的分类、实质
3、离子共存问题
谢谢观赏
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
