【周测必备】2022-2023学年上学期浙教版九年级科学试卷(一)第一章 物质及其变化(1~3节)【word,含答案】
文档属性
| 名称 | 【周测必备】2022-2023学年上学期浙教版九年级科学试卷(一)第一章 物质及其变化(1~3节)【word,含答案】 |  | |
| 格式 | doc | ||
| 文件大小 | 829.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-09-19 16:22:26 | ||
图片预览



文档简介
第一章 物质及其变化(1~3节)
一、选择题(每小题只有一个正确答案,每小题2分,共40分)
1.古诗词是古人留给我们的宝贵精神财富。下列诗词中不涉及化学变化的是( )
A.好雨知时节,当春乃发生 B.爆竹声中一岁除,春风送暖人屠苏
C.千锤万凿出深山,烈火焚烧若等闲 D.春蚕到死丝方尽,蜡炬成灰泪始干
2.如表列出了一些物质在常温下的近似pH。下列有关说法正确的是( )
A.所有的食物均呈酸性
B.PH<7的雨水称为酸雨
C.向肥皂水中滴加酚酞,溶液呈红色
D.清理厨房顽固油渍时,将厕所清洁剂与炉具清洁剂混合使用,效果更佳
3.肉类的鲜度可以通过测试pH来判断。有资料显示,pH与肉类新鲜度的关系如表,则新鲜肉在变质过程中酸性如何变化( )
A 变强 B 变弱 C 不变 D 无法确定
4.为研究盐酸的化学性质,小明进行如下实验。其中能产生白色沉淀的是 ( )
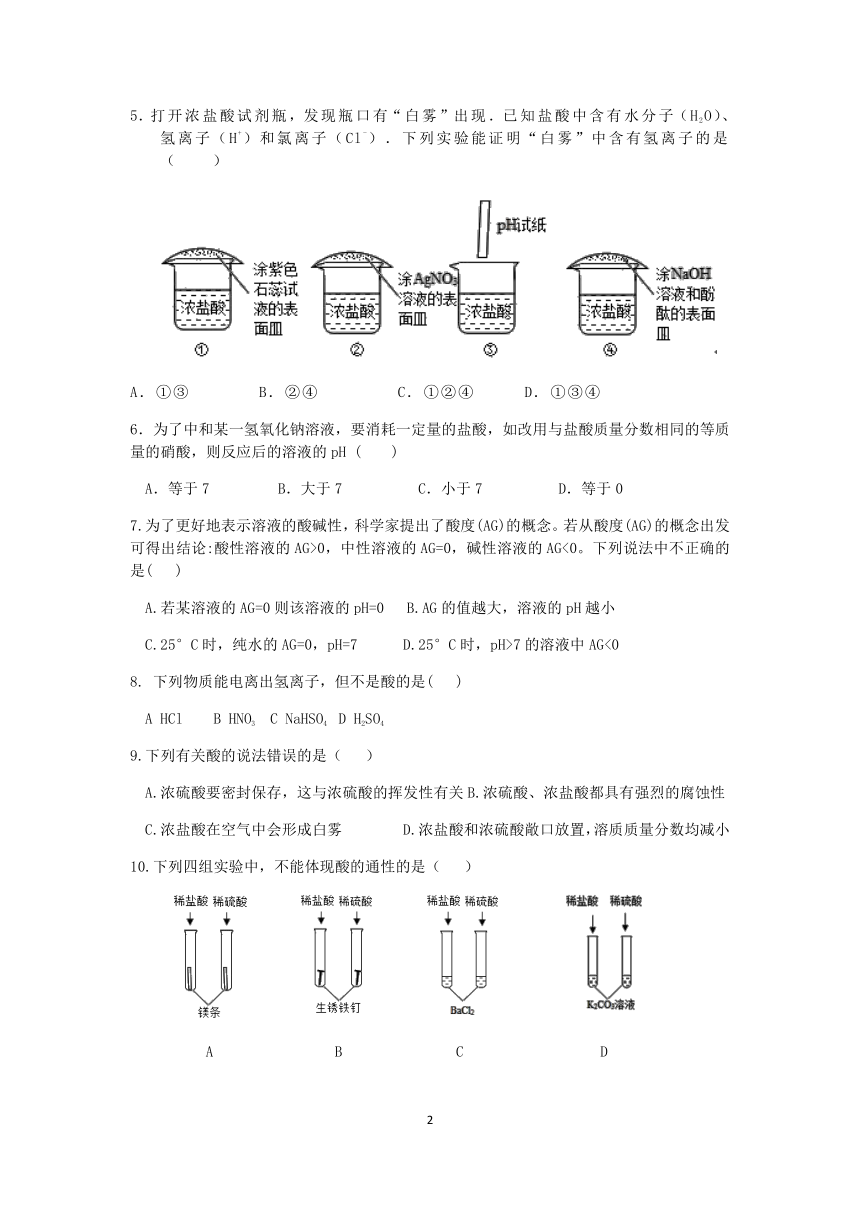
5.打开浓盐酸试剂瓶,发现瓶口有“白雾”出现.已知盐酸中含有水分子(H2O)、氢离子(H+)和氯离子(Cl-).下列实验能证明“白雾”中含有氢离子的是( )
A.①③ B.②④ C.①②④ D.①③④
6.为了中和某一氢氧化钠溶液,要消耗一定量的盐酸,如改用与盐酸质量分数相同的等质量的硝酸,则反应后的溶液的pH ( )
A.等于7 B.大于7 C.小于7 D.等于0
7.为了更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念。若从酸度(AG)的概念出发可得出结论:酸性溶液的AG>0,中性溶液的AG=0,碱性溶液的AG<0。下列说法中不正确的是( )
A.若某溶液的AG=0则该溶液的pH=0 B.AG的值越大,溶液的pH越小
C.25°C时,纯水的AG=0,pH=7 D.25°C时,pH>7的溶液中AG<0
8. 下列物质能电离出氢离子,但不是酸的是( )
A HCl B HNO3 C NaHSO4 D H2SO4
9.下列有关酸的说法错误的是( )
A.浓硫酸要密封保存,这与浓硫酸的挥发性有关B.浓硫酸、浓盐酸都具有强烈的腐蚀性
C.浓盐酸在空气中会形成白雾 D.浓盐酸和浓硫酸敞口放置,溶质质量分数均减小
10.下列四组实验中,不能体现酸的通性的是( )
A B C D
11.下列实验中浓硫酸表现脱水性的是( )
①浓硫酸敞口久置于空气中增重 ②浓硫酸干燥氢气
③浓硫酸使白纸变黑 ④浓硫酸使蓝色硫酸铜晶体变白
⑤蔗糖中加入浓硫酸制“黑面包”
A.②④⑤ B.③④⑤ C.③⑤ D.①③⑤
12.纳米(nm)是一种长度单位,1nm=10 9m,纳米科技开辟了人类认识世界的新层面。纳米材料科技是纳米科技最基本的组成部分,把固体物质加工到纳米级(1nm 100nm)的超细粉末,即可得到纳米材料。这种加工过程属于( )
A.化学变化 B.物理变化
C.既有物理变化又有化学变化 D.既不是物理变化又不是化学变化
13.将下列组合物质中的液体分别滴加到固体中,实验装置如图所示,发现小气球都可以鼓起来,小气球鼓起的主要原因不同于其他三个的是( )
①镁和稀硫酸②石灰石和稀盐酸③氢氧化钠和水④碳酸钠和稀硝酸
A.① B.② C.③ D.④
14.生锈的铁钉放入盛有稀盐酸的密闭容器中,用压强传感器测得容器内气体压强和反应时间的变化曲线如图,说法正确的是( )
A.CD段压强变化的主要因素是反应速度减慢
B.AB段的化学反应是:Fe+2HCl═FeCl2+H2↑
C.D点反应结束
D.E点温度等于A点
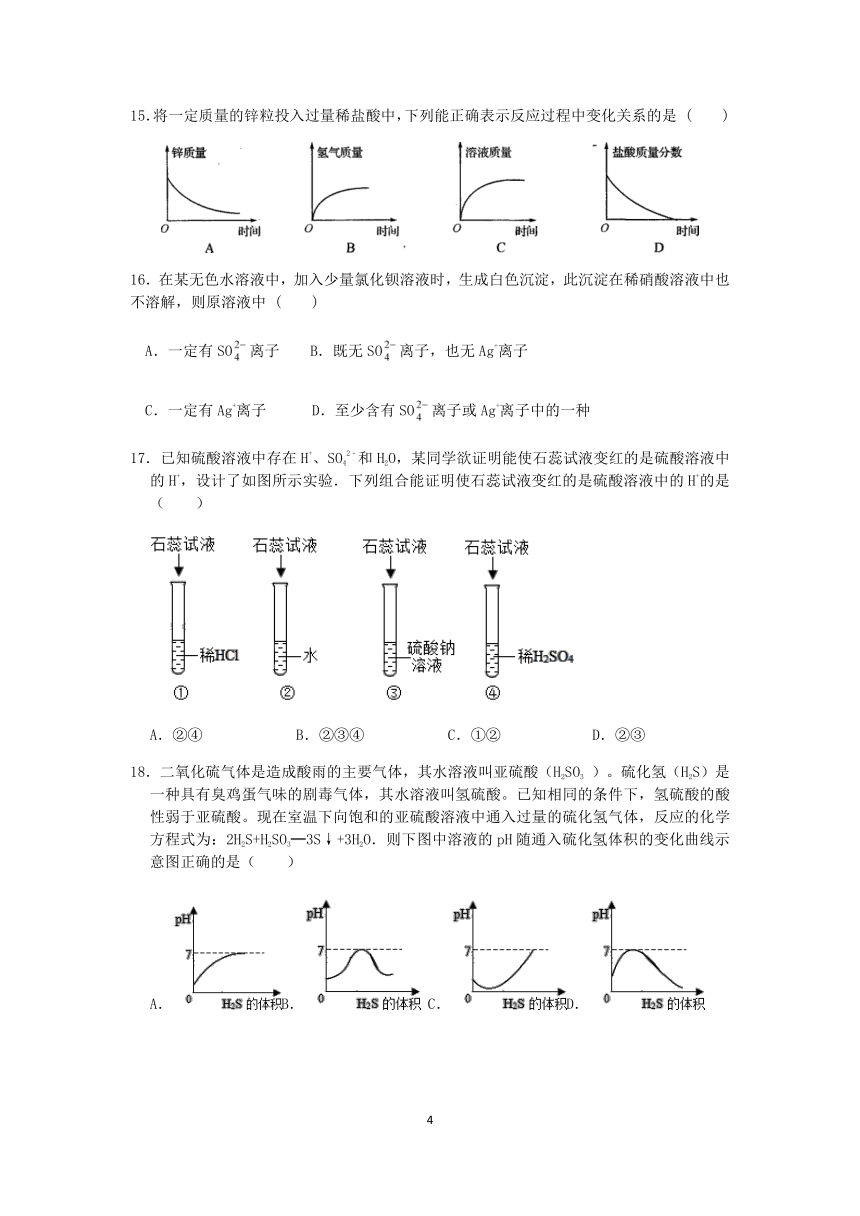
15.将一定质量的锌粒投入过量稀盐酸中,下列能正确表示反应过程中变化关系的是 ( )
16.在某无色水溶液中,加入少量氯化钡溶液时,生成白色沉淀,此沉淀在稀硝酸溶液中也不溶解,则原溶液中 ( )
A.一定有SO离子 B.既无SO离子,也无Ag+离子
C.一定有Ag+离子 D.至少含有SO离子或Ag+离子中的一种
17.已知硫酸溶液中存在H+、SO42﹣和H2O,某同学欲证明能使石蕊试液变红的是硫酸溶液中的H+,设计了如图所示实验.下列组合能证明使石蕊试液变红的是硫酸溶液中的H+的是( )
A.②④ B.②③④ C.①② D.②③
18.二氧化硫气体是造成酸雨的主要气体,其水溶液叫亚硫酸(H2SO3 )。硫化氢(H2S)是一种具有臭鸡蛋气味的剧毒气体,其水溶液叫氢硫酸。已知相同的条件下,氢硫酸的酸性弱于亚硫酸。现在室温下向饱和的亚硫酸溶液中通入过量的硫化氢气体,反应的化学方程式为:2H2S+H2SO3═3S↓+3H2O.则下图中溶液的pH随通入硫化氢体积的变化曲线示意图正确的是( )
A.B. C.D.
19.向盛有一定量氧化铁粉末的烧杯中不断加入稀盐酸,烧杯中相关量的变化与图像相符的是( )
20.如图为硫酸性质的知识归纳,下列说法不正确的是( )
A. 若盐为BaCl2溶液,则反应中有白色沉淀生成
B.若碱为NaOH溶液,可以在溶液中滴加酚酞试液,证明两者发生了反应
C.若金属氧化物为铁锈的主要成分(Fe2O3),可以利用硫酸与金属氧化物反应这一性质,除去铁锈
D.若金属为Mg和Zn,将质量相等且过量的两种金属与一定量的稀硫酸充分反应,Mg产生的氢气多
二、填空题(共28分)
21.(6分)盐酸和硫酸是两种重要的酸。
(1)浓硫酸使木棒或棉花变黑,体现了浓硫酸的________性。
(2)如图为实验室稀释浓硫酸的操作示意图,其中烧杯中的液体A是________。(填“浓硫酸”或“水”)
(3)打开浓盐酸试剂瓶的瓶盖,瓶口出现白雾,这是因为浓盐酸具有________性。
22.(6分)小颖通过查阅资料得知:紫甘蓝含有丰富的花青素,花青素遇酸性溶液变红色,遇碱性溶液变蓝色,于是她选做了如下实验:用紫甘蓝丝浸泡在肥皂水里,很快变蓝,她又将另一些紫甘蓝丝浸泡在家庭厨房里的某种调味品中,变成了红色,根据上述现象回答:
(1)肥皂水呈 (填“酸性”“中性”“碱性”)
(2)小颖选用的调味品可能是 。
(3)紫甘蓝丝汁液的性质与化学实验室中常用的 性质相似。
23.(6分)硫酸和盐酸是实验室中两种重要的试剂,用途广泛。
(1)小柯将一张滤纸在某指示剂中浸泡后晾干,用蘸有氢氧化钠溶液的玻璃棒在上面写“化学”两字,立刻显红色。再将其悬挂于铁架台上,并在滤纸的下方(如图甲)放置一盛有某溶液的烧杯,立刻发现红色的字消失,则烧杯中的溶液可以是 。
(2)为探究酸碱反应的过程中是否伴随能量变化,小柯按图乙装置进行实验,其中澄清饱和石灰水的作用是 。
(3)在稀盐酸的下列用途中,可以用稀硫酸代替的是 (填编号)。
①金属表面除锈 ②实验室利用它和块状大理石制取CO2
③除去NaCl中的少量 NaOH ④制造药物氯化锌
24.(10分)归纳是学习的重要方法,小郑在复习盐酸的性质时,归纳出盐酸的五条化学性质。
(1)为了验证性质①,小郑将紫色石蕊试液滴加到盐酸溶液中,溶液变________。
(2)图中A所表示的物质类别是________。
(3)盐酸的性质③决定了盐酸可用于清除铁锈,该反应的化学方程式为____________。
(4)为了验证性质⑤,可选用的物质是________(填一种即可)。
(5)镁和锌可以用来验证盐酸的性质②,小郑要探究镁、锌与盐酸反应的快慢,需要控制不变(相同)的量是________(填字母)。
A.两种金属的形状 B.盐酸的质量分数 C.反应容器的大小 D.温度
三、实验探究题(每空2分,共20分)
25.(6分)在做锌与稀硫酸反应实验时,小丽同学发现试管中产生气泡的速度先变快后变慢。这一现象引起了同学们的思考,化学反应的快慢会受到哪些因素的影响?他们设计了如下的实验方案进行探究:分三次取足量的相同质量的稀硫酸,分别与大小、形状、质量相同的锌粒进行反应。实验数据记录如表。
实验编号 1 2 3
稀硫酸的质量分数 10% 10% 20%
溶液温度/℃ 反应前 20 30 20
反应后 26 37 28
反应所需时间 长 较短 较短
(1)分析实验数据可以得出锌与稀硫酸反应的快慢与______有关。
(2)同学们发现3次实验过程中总是开始阶段产生气泡逐渐变快,一定时间后逐渐变慢至停止。根据实验数据分析,锌与稀硫酸反应开始阶段产生气泡变快的决定因素是 。
(3)请你根据实验结果,分析硫在氧气中燃烧比在空气中燃烧剧烈的原因 。
26.(6分) 小明在实验室做镁条和稀盐酸反应的实验时,发现试管中产生大量气体、试管壁发烫。放置较长时间后,试管底部有沉淀生成。针对这一现象,小明进行了探究:
(1)小明最初认为试管底部的沉淀可能是镁与稀盐酸反应生成大量的MgCl2不能完全溶于水所致。但随后小明通过实验证实了沉淀不是 MgCl2,你认为小明的实验操作是______。
(2)小明查阅资料知道镁与水在加热的条件下能生成氢氧化镁(难溶性物质)和氢气。于是他进行了实验验证:将去除氧化膜的镁条和水放在试管中加热,发现镁条表面有少量气泡生成。停止加热后,却始终没有观察到沉淀。请对“没有观察到沉淀”这一结果作出合理的解释___________________________。
(3)镁与水反应没有观察到沉淀,而镁与稀盐酸混合却有沉淀,小明经过思考,认为沉淀的产生与氯离子有关。后来查阅资料得知,沉淀的主要成分是一种可溶于稀硝酸,并生成氯化镁、硝酸镁和水的碱式氯化镁[Mg(OH)Cl]。请你设计实验验证沉淀中含有氯元素_______
。
27.(8分)为探究盐酸的化学性质,某化学小组做了如下实验:
(1)A试管中的实验现象为________
(2)将反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质成分进行探究:
【提出问题】滤液中溶质的成分是什么
【作出猜想】猜想一:NaCl; 猜想二:NaCl和CaCl2;猜想三:________
猜想四:NaCl、Ca(OH)2和HCl
同学们马上否定了猜想四,请问他们否定的理由是什么?________
(3)【设计实验】请完成实验报告。
实验步骤 实验现象 实验结论
取少量滤液于试管中,滴加适量的碳酸钠溶液。 ________ 猜想二不成立
取少量滤液于试管中, 滴加________(填名称)。 产生气泡 猜想三成立
(4)【迁移拓展】稀盐酸、稀硫酸有一些相似的化学性质,是因为在不同的酸溶液中都含有________。
四、计算题(共12分)
28.(6分)取CaCl2和CaCO3的混合物15g于烧杯中,向其中滴加一定溶质质量分数的稀盐酸,滴加稀盐酸的质量与产生气体质量的关系如图所示(注:CaCl2与稀盐酸不能发生反应)。求:
(1)混合物中CaCO3的质量。
(2)稀盐酸中的溶质质量分数。
(3)恰好完全反应时,所得溶液中溶质的质量分数。(写出计算过程,结果保留一位小数)
29.(6分)向一定质量的含杂质的锌样品中加入稀硫酸充分反应(杂质不与稀硫酸反应),所加稀硫酸与生成气体的质量关系如图所示.(提示:稀硫酸与锌反应生成硫酸锌和氢气)
(1)锌样品与稀硫酸充分反应后产生氢气的总质量为 g.
(2)求:样品中锌的质量(请写出具体的计算过程)。
物质及其变化(1~3节)
参考答案
一、选择题(每小题只有一个正确答案,每小题2分,共40分)
1.A 2.C 3.B 4.A 5.D 6.B 7.A 8. C 9.A 10.C
11.C 12.B 13.C 14.D 15.B 16.D 17.B 18.B 19.A 20.D
二、填空题(共28分)
21.(6分)(1)脱水(2)浓硫酸(3)挥发
22.(6分)(1)碱性 (2)醋 (3)紫色石蕊试液
23.(6分)(1)浓盐酸;(2)饱和石灰水变浑浊,说明氢氧化钠与盐酸反应能放出热量;
(3)①
24.(10分)(1)红 (2)碱 (3)Fe2O3+6HCl===2FeCl3+3H2O (4)Na2CO3(合理即可) (5)ABD
三、实验探究题(每空2分,共20分)
25.(6分)(1)反应温度、反应物浓度(2)反应温度(3)空气中氧气浓度比纯氧小,所以硫在氧气中燃烧比在空气中燃烧剧烈
26.(6分) (1)取少量氯化镁于试管中,加入水
(2)镁与水在加热条件下反应生成了氢氧化镁,覆盖镁条表面,阻止了镁与水的继续反应。
(3)取洗涤干净后的沉淀,加入试管,加入稀硝酸溶解后,加入硝酸银溶液,若有自色沉淀生成说明含有氯元素。
27.(8分)(1)紫色石蕊溶液变红
(2)NaCl和Na2CO3;稀盐酸会与氢氧化钙反应不能共存
(3)无沉淀产生(无现象);稀盐酸(或稀硫酸)
(4)氢离子(或H+)
四、计算题(共12分)
28.(6分)(1)混合物中CaCO3的质量为 ; x=10g
(2)稀盐酸中的溶质质量分数为 ×100%=7.3%
(3)恰好完全反应时,所得溶液中溶质的质量分数= ×100%≈14.6%
29.(6分)解:(1)由图可知,完全反应后生成氢气的质量为0.4g;
(2)设样品中锌的质量为x.
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.4g
则,解得x=13g.
答:样品中锌的质量为13g.
【周测必备】科学九年级(上册)测试卷(一)
一、选择题(每小题只有一个正确答案,每小题2分,共40分)
1.古诗词是古人留给我们的宝贵精神财富。下列诗词中不涉及化学变化的是( )
A.好雨知时节,当春乃发生 B.爆竹声中一岁除,春风送暖人屠苏
C.千锤万凿出深山,烈火焚烧若等闲 D.春蚕到死丝方尽,蜡炬成灰泪始干
2.如表列出了一些物质在常温下的近似pH。下列有关说法正确的是( )
A.所有的食物均呈酸性
B.PH<7的雨水称为酸雨
C.向肥皂水中滴加酚酞,溶液呈红色
D.清理厨房顽固油渍时,将厕所清洁剂与炉具清洁剂混合使用,效果更佳
3.肉类的鲜度可以通过测试pH来判断。有资料显示,pH与肉类新鲜度的关系如表,则新鲜肉在变质过程中酸性如何变化( )
A 变强 B 变弱 C 不变 D 无法确定
4.为研究盐酸的化学性质,小明进行如下实验。其中能产生白色沉淀的是 ( )
5.打开浓盐酸试剂瓶,发现瓶口有“白雾”出现.已知盐酸中含有水分子(H2O)、氢离子(H+)和氯离子(Cl-).下列实验能证明“白雾”中含有氢离子的是( )
A.①③ B.②④ C.①②④ D.①③④
6.为了中和某一氢氧化钠溶液,要消耗一定量的盐酸,如改用与盐酸质量分数相同的等质量的硝酸,则反应后的溶液的pH ( )
A.等于7 B.大于7 C.小于7 D.等于0
7.为了更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念。若从酸度(AG)的概念出发可得出结论:酸性溶液的AG>0,中性溶液的AG=0,碱性溶液的AG<0。下列说法中不正确的是( )
A.若某溶液的AG=0则该溶液的pH=0 B.AG的值越大,溶液的pH越小
C.25°C时,纯水的AG=0,pH=7 D.25°C时,pH>7的溶液中AG<0
8. 下列物质能电离出氢离子,但不是酸的是( )
A HCl B HNO3 C NaHSO4 D H2SO4
9.下列有关酸的说法错误的是( )
A.浓硫酸要密封保存,这与浓硫酸的挥发性有关B.浓硫酸、浓盐酸都具有强烈的腐蚀性
C.浓盐酸在空气中会形成白雾 D.浓盐酸和浓硫酸敞口放置,溶质质量分数均减小
10.下列四组实验中,不能体现酸的通性的是( )
A B C D
11.下列实验中浓硫酸表现脱水性的是( )
①浓硫酸敞口久置于空气中增重 ②浓硫酸干燥氢气
③浓硫酸使白纸变黑 ④浓硫酸使蓝色硫酸铜晶体变白
⑤蔗糖中加入浓硫酸制“黑面包”
A.②④⑤ B.③④⑤ C.③⑤ D.①③⑤
12.纳米(nm)是一种长度单位,1nm=10 9m,纳米科技开辟了人类认识世界的新层面。纳米材料科技是纳米科技最基本的组成部分,把固体物质加工到纳米级(1nm 100nm)的超细粉末,即可得到纳米材料。这种加工过程属于( )
A.化学变化 B.物理变化
C.既有物理变化又有化学变化 D.既不是物理变化又不是化学变化
13.将下列组合物质中的液体分别滴加到固体中,实验装置如图所示,发现小气球都可以鼓起来,小气球鼓起的主要原因不同于其他三个的是( )
①镁和稀硫酸②石灰石和稀盐酸③氢氧化钠和水④碳酸钠和稀硝酸
A.① B.② C.③ D.④
14.生锈的铁钉放入盛有稀盐酸的密闭容器中,用压强传感器测得容器内气体压强和反应时间的变化曲线如图,说法正确的是( )
A.CD段压强变化的主要因素是反应速度减慢
B.AB段的化学反应是:Fe+2HCl═FeCl2+H2↑
C.D点反应结束
D.E点温度等于A点
15.将一定质量的锌粒投入过量稀盐酸中,下列能正确表示反应过程中变化关系的是 ( )
16.在某无色水溶液中,加入少量氯化钡溶液时,生成白色沉淀,此沉淀在稀硝酸溶液中也不溶解,则原溶液中 ( )
A.一定有SO离子 B.既无SO离子,也无Ag+离子
C.一定有Ag+离子 D.至少含有SO离子或Ag+离子中的一种
17.已知硫酸溶液中存在H+、SO42﹣和H2O,某同学欲证明能使石蕊试液变红的是硫酸溶液中的H+,设计了如图所示实验.下列组合能证明使石蕊试液变红的是硫酸溶液中的H+的是( )
A.②④ B.②③④ C.①② D.②③
18.二氧化硫气体是造成酸雨的主要气体,其水溶液叫亚硫酸(H2SO3 )。硫化氢(H2S)是一种具有臭鸡蛋气味的剧毒气体,其水溶液叫氢硫酸。已知相同的条件下,氢硫酸的酸性弱于亚硫酸。现在室温下向饱和的亚硫酸溶液中通入过量的硫化氢气体,反应的化学方程式为:2H2S+H2SO3═3S↓+3H2O.则下图中溶液的pH随通入硫化氢体积的变化曲线示意图正确的是( )
A.B. C.D.
19.向盛有一定量氧化铁粉末的烧杯中不断加入稀盐酸,烧杯中相关量的变化与图像相符的是( )
20.如图为硫酸性质的知识归纳,下列说法不正确的是( )
A. 若盐为BaCl2溶液,则反应中有白色沉淀生成
B.若碱为NaOH溶液,可以在溶液中滴加酚酞试液,证明两者发生了反应
C.若金属氧化物为铁锈的主要成分(Fe2O3),可以利用硫酸与金属氧化物反应这一性质,除去铁锈
D.若金属为Mg和Zn,将质量相等且过量的两种金属与一定量的稀硫酸充分反应,Mg产生的氢气多
二、填空题(共28分)
21.(6分)盐酸和硫酸是两种重要的酸。
(1)浓硫酸使木棒或棉花变黑,体现了浓硫酸的________性。
(2)如图为实验室稀释浓硫酸的操作示意图,其中烧杯中的液体A是________。(填“浓硫酸”或“水”)
(3)打开浓盐酸试剂瓶的瓶盖,瓶口出现白雾,这是因为浓盐酸具有________性。
22.(6分)小颖通过查阅资料得知:紫甘蓝含有丰富的花青素,花青素遇酸性溶液变红色,遇碱性溶液变蓝色,于是她选做了如下实验:用紫甘蓝丝浸泡在肥皂水里,很快变蓝,她又将另一些紫甘蓝丝浸泡在家庭厨房里的某种调味品中,变成了红色,根据上述现象回答:
(1)肥皂水呈 (填“酸性”“中性”“碱性”)
(2)小颖选用的调味品可能是 。
(3)紫甘蓝丝汁液的性质与化学实验室中常用的 性质相似。
23.(6分)硫酸和盐酸是实验室中两种重要的试剂,用途广泛。
(1)小柯将一张滤纸在某指示剂中浸泡后晾干,用蘸有氢氧化钠溶液的玻璃棒在上面写“化学”两字,立刻显红色。再将其悬挂于铁架台上,并在滤纸的下方(如图甲)放置一盛有某溶液的烧杯,立刻发现红色的字消失,则烧杯中的溶液可以是 。
(2)为探究酸碱反应的过程中是否伴随能量变化,小柯按图乙装置进行实验,其中澄清饱和石灰水的作用是 。
(3)在稀盐酸的下列用途中,可以用稀硫酸代替的是 (填编号)。
①金属表面除锈 ②实验室利用它和块状大理石制取CO2
③除去NaCl中的少量 NaOH ④制造药物氯化锌
24.(10分)归纳是学习的重要方法,小郑在复习盐酸的性质时,归纳出盐酸的五条化学性质。
(1)为了验证性质①,小郑将紫色石蕊试液滴加到盐酸溶液中,溶液变________。
(2)图中A所表示的物质类别是________。
(3)盐酸的性质③决定了盐酸可用于清除铁锈,该反应的化学方程式为____________。
(4)为了验证性质⑤,可选用的物质是________(填一种即可)。
(5)镁和锌可以用来验证盐酸的性质②,小郑要探究镁、锌与盐酸反应的快慢,需要控制不变(相同)的量是________(填字母)。
A.两种金属的形状 B.盐酸的质量分数 C.反应容器的大小 D.温度
三、实验探究题(每空2分,共20分)
25.(6分)在做锌与稀硫酸反应实验时,小丽同学发现试管中产生气泡的速度先变快后变慢。这一现象引起了同学们的思考,化学反应的快慢会受到哪些因素的影响?他们设计了如下的实验方案进行探究:分三次取足量的相同质量的稀硫酸,分别与大小、形状、质量相同的锌粒进行反应。实验数据记录如表。
实验编号 1 2 3
稀硫酸的质量分数 10% 10% 20%
溶液温度/℃ 反应前 20 30 20
反应后 26 37 28
反应所需时间 长 较短 较短
(1)分析实验数据可以得出锌与稀硫酸反应的快慢与______有关。
(2)同学们发现3次实验过程中总是开始阶段产生气泡逐渐变快,一定时间后逐渐变慢至停止。根据实验数据分析,锌与稀硫酸反应开始阶段产生气泡变快的决定因素是 。
(3)请你根据实验结果,分析硫在氧气中燃烧比在空气中燃烧剧烈的原因 。
26.(6分) 小明在实验室做镁条和稀盐酸反应的实验时,发现试管中产生大量气体、试管壁发烫。放置较长时间后,试管底部有沉淀生成。针对这一现象,小明进行了探究:
(1)小明最初认为试管底部的沉淀可能是镁与稀盐酸反应生成大量的MgCl2不能完全溶于水所致。但随后小明通过实验证实了沉淀不是 MgCl2,你认为小明的实验操作是______。
(2)小明查阅资料知道镁与水在加热的条件下能生成氢氧化镁(难溶性物质)和氢气。于是他进行了实验验证:将去除氧化膜的镁条和水放在试管中加热,发现镁条表面有少量气泡生成。停止加热后,却始终没有观察到沉淀。请对“没有观察到沉淀”这一结果作出合理的解释___________________________。
(3)镁与水反应没有观察到沉淀,而镁与稀盐酸混合却有沉淀,小明经过思考,认为沉淀的产生与氯离子有关。后来查阅资料得知,沉淀的主要成分是一种可溶于稀硝酸,并生成氯化镁、硝酸镁和水的碱式氯化镁[Mg(OH)Cl]。请你设计实验验证沉淀中含有氯元素_______
。
27.(8分)为探究盐酸的化学性质,某化学小组做了如下实验:
(1)A试管中的实验现象为________
(2)将反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质成分进行探究:
【提出问题】滤液中溶质的成分是什么
【作出猜想】猜想一:NaCl; 猜想二:NaCl和CaCl2;猜想三:________
猜想四:NaCl、Ca(OH)2和HCl
同学们马上否定了猜想四,请问他们否定的理由是什么?________
(3)【设计实验】请完成实验报告。
实验步骤 实验现象 实验结论
取少量滤液于试管中,滴加适量的碳酸钠溶液。 ________ 猜想二不成立
取少量滤液于试管中, 滴加________(填名称)。 产生气泡 猜想三成立
(4)【迁移拓展】稀盐酸、稀硫酸有一些相似的化学性质,是因为在不同的酸溶液中都含有________。
四、计算题(共12分)
28.(6分)取CaCl2和CaCO3的混合物15g于烧杯中,向其中滴加一定溶质质量分数的稀盐酸,滴加稀盐酸的质量与产生气体质量的关系如图所示(注:CaCl2与稀盐酸不能发生反应)。求:
(1)混合物中CaCO3的质量。
(2)稀盐酸中的溶质质量分数。
(3)恰好完全反应时,所得溶液中溶质的质量分数。(写出计算过程,结果保留一位小数)
29.(6分)向一定质量的含杂质的锌样品中加入稀硫酸充分反应(杂质不与稀硫酸反应),所加稀硫酸与生成气体的质量关系如图所示.(提示:稀硫酸与锌反应生成硫酸锌和氢气)
(1)锌样品与稀硫酸充分反应后产生氢气的总质量为 g.
(2)求:样品中锌的质量(请写出具体的计算过程)。
物质及其变化(1~3节)
参考答案
一、选择题(每小题只有一个正确答案,每小题2分,共40分)
1.A 2.C 3.B 4.A 5.D 6.B 7.A 8. C 9.A 10.C
11.C 12.B 13.C 14.D 15.B 16.D 17.B 18.B 19.A 20.D
二、填空题(共28分)
21.(6分)(1)脱水(2)浓硫酸(3)挥发
22.(6分)(1)碱性 (2)醋 (3)紫色石蕊试液
23.(6分)(1)浓盐酸;(2)饱和石灰水变浑浊,说明氢氧化钠与盐酸反应能放出热量;
(3)①
24.(10分)(1)红 (2)碱 (3)Fe2O3+6HCl===2FeCl3+3H2O (4)Na2CO3(合理即可) (5)ABD
三、实验探究题(每空2分,共20分)
25.(6分)(1)反应温度、反应物浓度(2)反应温度(3)空气中氧气浓度比纯氧小,所以硫在氧气中燃烧比在空气中燃烧剧烈
26.(6分) (1)取少量氯化镁于试管中,加入水
(2)镁与水在加热条件下反应生成了氢氧化镁,覆盖镁条表面,阻止了镁与水的继续反应。
(3)取洗涤干净后的沉淀,加入试管,加入稀硝酸溶解后,加入硝酸银溶液,若有自色沉淀生成说明含有氯元素。
27.(8分)(1)紫色石蕊溶液变红
(2)NaCl和Na2CO3;稀盐酸会与氢氧化钙反应不能共存
(3)无沉淀产生(无现象);稀盐酸(或稀硫酸)
(4)氢离子(或H+)
四、计算题(共12分)
28.(6分)(1)混合物中CaCO3的质量为 ; x=10g
(2)稀盐酸中的溶质质量分数为 ×100%=7.3%
(3)恰好完全反应时,所得溶液中溶质的质量分数= ×100%≈14.6%
29.(6分)解:(1)由图可知,完全反应后生成氢气的质量为0.4g;
(2)设样品中锌的质量为x.
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.4g
则,解得x=13g.
答:样品中锌的质量为13g.
【周测必备】科学九年级(上册)测试卷(一)
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
