2022年秋人教版九年级化学上册 3.2.2 离子 相对原子质量 同步练习 (有解析)
文档属性
| 名称 | 2022年秋人教版九年级化学上册 3.2.2 离子 相对原子质量 同步练习 (有解析) |  | |
| 格式 | doc | ||
| 文件大小 | 189.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-20 16:44:51 | ||
图片预览



文档简介
3.2.2 离子 相对原子质量
一、单选题
1.下列各微粒的结构示意图中表示阳离子的是( )
A. B. C. D.
2.考古学家通过C-14测定法将我省宁波地区的文明发展史推到距今8000多年前。C-14原子的核电荷数为6.相对原子质量为14,则该原子核外电子数为( )
A.6 B.8 C.14 D.20
3.某粒子结构示意图如图所示。下列说法不正确的是
A.x为8
B.该粒子为阴离子
C.该粒子的质子数为12
D.该粒子的核外有两个电子层
4.如图是硫原子的结构示意图,下列由图中获取的信息错误的是
A.硫原子的核电荷数为16
B.硫原子在化学反应中易失去电子
C.硫原子的结构示意图中的x等于8
D.硫原子所形成离子的符号为S2-
5.根据图中提供的信息判断,下列说法不正确的是( )
A.④表示镁原子有二个电子层 B.②表示金属元素的原子
C.③④为相对稳定结构 D.①③属于同种元素
6.如图为某粒子的结构示意图,有关该粒子的说法中,错误的是( )
A.该粒子的原子核内有11个质子
B.该粒子的核外有三个电子层
C.该粒子最外层上有一个电子
D.该粒子是带负电的阴离子
7.从如图所示的两种粒子结构示意图中,所获取的信息正确的是( )
A.它们属于不同种元素
B.它们都属于非金属元素
C.它们原子的核外电子数相同
D.①表示阴离子,②表示原子
8.下列有关原子的说法正确的是( )
A.原子都由原子核和核外电子构成
B.分子的质量一定比原子的质量大
C.原子通过得失电子形成离子,离子不能形成原子
D.温度越高,原子的体积越大
9.如图表示用中子轰击铀-235原子核产生氪核和钡核的模型。下列叙述正确的是( )
A.该模型表示的是核聚变
B.该反应产生的中子可继续轰击其他铀核形成链式反应
C.该反应不会产生放射性物质
D.不能用该反应获得能量的方式来发电
10.如图为某粒子的结构示意图,下列说法正确的是( )
A.该粒子有12个质子
B.该粒子第一层的2个电子能量最高
C.该粒子已达到相对稳定结构
D.该粒子是阳离子
11.建立正确的微粒观有助于化学的学习,下列有关微粒的说法错误的是( )
A.原子可以转化为离子
B.原子的质量主要由质子和中子决定
C.离子之间存在着相互作用,分子之间不存在相互作用
D.原子得失电子后,原子核没有发生变化
12.下列关于微观粒子的说法,正确的是
A.带电的粒子一定是离子
B.在干冰中,分子因相互作用而静止不动
C.所有原子都由原子核和核外电子构成
D.并不是所有分子都是由原子构成的
13.下图为R元素的原子结构示意图。下列说法错误的是
A.x值为11
B.决定R元素种类的是核内的质子数
C.R元素化学性质与最外层电子数密切相关
D.R在反应中易得电子,形成R-
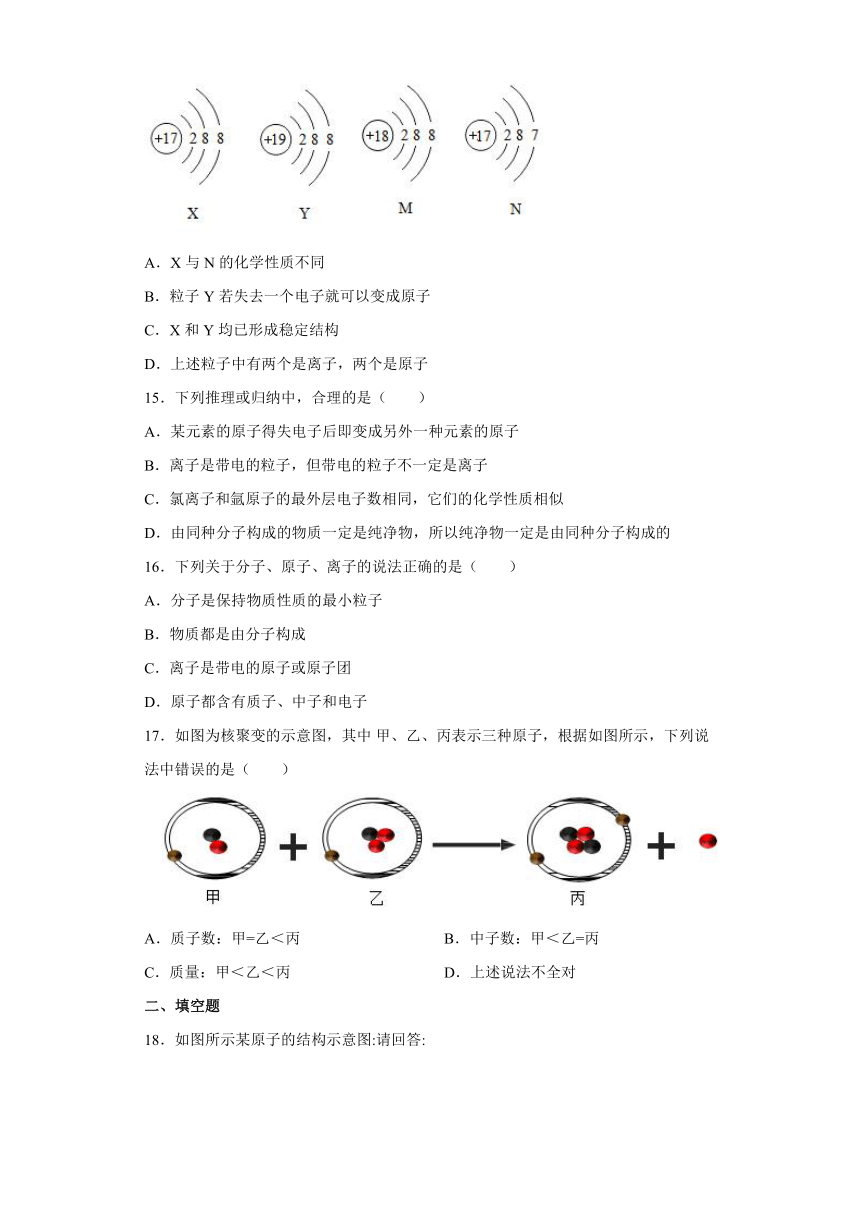
14.关于下列四种粒子的说法不正确的是( )
A.X与N的化学性质不同
B.粒子Y若失去一个电子就可以变成原子
C.X和Y均已形成稳定结构
D.上述粒子中有两个是离子,两个是原子
15.下列推理或归纳中,合理的是( )
A.某元素的原子得失电子后即变成另外一种元素的原子
B.离子是带电的粒子,但带电的粒子不一定是离子
C.氯离子和氩原子的最外层电子数相同,它们的化学性质相似
D.由同种分子构成的物质一定是纯净物,所以纯净物一定是由同种分子构成的
16.下列关于分子、原子、离子的说法正确的是( )
A.分子是保持物质性质的最小粒子
B.物质都是由分子构成
C.离子是带电的原子或原子团
D.原子都含有质子、中子和电子
17.如图为核聚变的示意图,其中 甲、乙、丙表示三种原子,根据如图所示,下列说法中错误的是( )
A.质子数:甲=乙<丙 B.中子数:甲<乙=丙
C.质量:甲<乙<丙 D.上述说法不全对
二、填空题
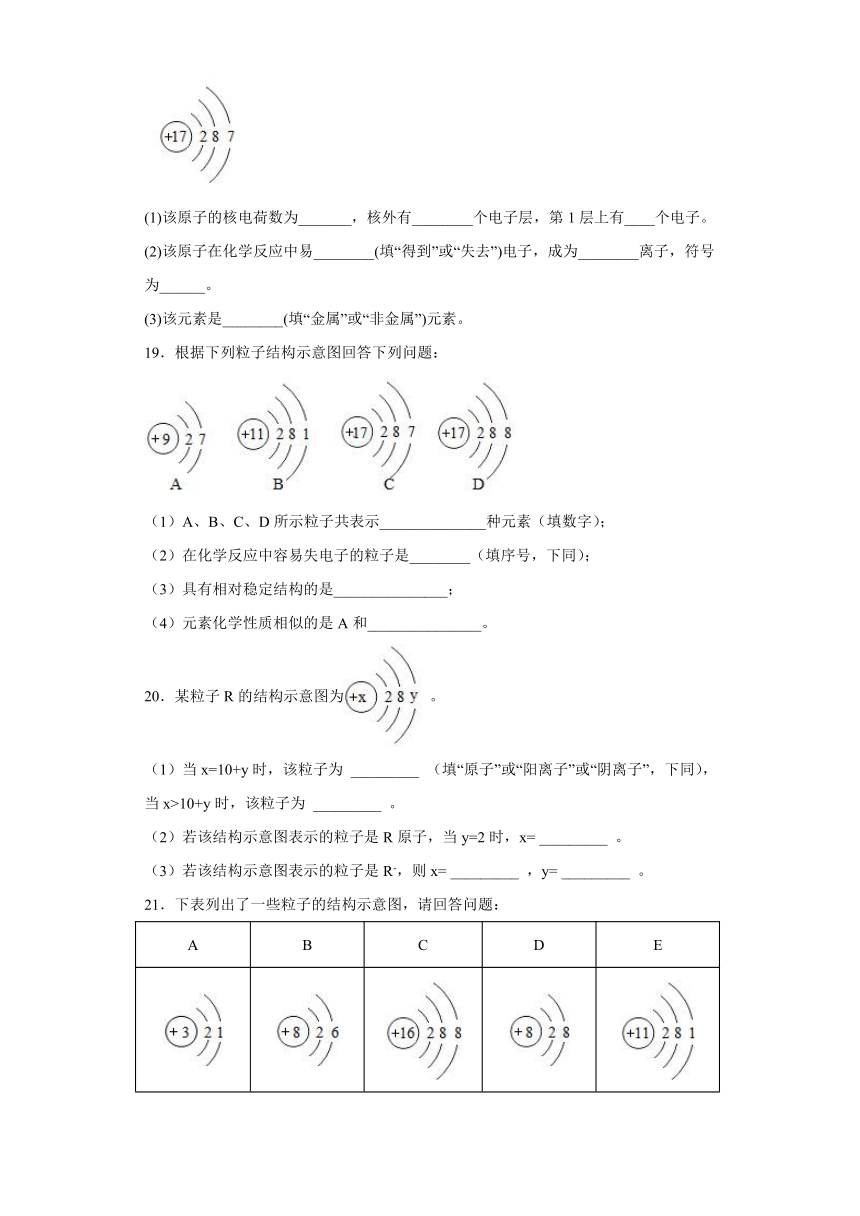
18.如图所示某原子的结构示意图:请回答:
(1)该原子的核电荷数为_______,核外有________个电子层,第1层上有____个电子。
(2)该原子在化学反应中易________(填“得到”或“失去”)电子,成为________离子,符号为______。
(3)该元素是________(填“金属”或“非金属”)元素。
19.根据下列粒子结构示意图回答下列问题:
(1)A、B、C、D所示粒子共表示______________种元素(填数字);
(2)在化学反应中容易失电子的粒子是________(填序号,下同);
(3)具有相对稳定结构的是_______________;
(4)元素化学性质相似的是A和_______________。
20.某粒子R的结构示意图为 。
(1)当x=10+y时,该粒子为 _________ (填“原子”或“阳离子”或“阴离子”,下同),当x>10+y时,该粒子为 _________ 。
(2)若该结构示意图表示的粒子是R原子,当y=2时,x= _________ 。
(3)若该结构示意图表示的粒子是R-,则x= _________ ,y= _________ 。
21.下表列出了一些粒子的结构示意图,请回答问题:
A B C D E
(1)具有相似化学性质的原子是___________(用 ABCDE表示)。
(2)表格中共有________种元素的粒子。
(3)在化学反应中容易获得电子的粒子是_________(用 ABCDE表示)。
(4)上述粒子中属于金属元素原子的是________(用 ABCDE表示)。
22.模型是联系宏观与微观的桥梁.
(1)下图是钠原子结构示意图.
①x的数值为_________.
②“11”指的是__________.
(2)氮化镓(GaN)是“蓝色发光二极管”研发技术中的重要材料.
①镓元素(Ga)的原子结构如图,镓原子失去电子形成离子的符号可表示为__________.
②下列原子结构示意图所对应的元素与镓元素的化学性质相似的是______(填字母序号).
A B C D
(3)下图是氢分子和氧分子运动的示意图.
A B C
①在A、B和C中,能比较得出“温度越高,分子运动速率越快”的是_____(填标号).
②从图中可见,影响分子运动速率的因素除温度外,还与_________有关.
③举一个能说明“温度升高,分子运动速率加快”的生活事例:____________.
参考答案:
1.B
【解析】
【详解】
A、核内质子数等于核外电子数,属于原子,故A错误;
B、核内质子数大于核外电子数,原子失去了电子,带正电荷,属于阳离子,故B正确;
C、核内质子数等于核外电子数,属于原子,故C错误;
D、核内质子数小于核外电子数,原子得到了电子,带负电荷,属于阴离子,故D错误。故选B。
【点睛】
核内质子数等于核外电子数属于原子,核内质子数大于核外电子数为阳离子,核内质子数小于核外电子数为阴离子。
2.A
【解析】
【分析】
【详解】
在原子中:核电荷数=核内质子数=核外电子数,已知C-14原子的核电荷数为6,则该原子核外电子数为6。
故选:A。
【点睛】
熟记原子中这两个等式:核电荷数=核内质子数=核外电子数;相对原子质量=质子数+中子数。
3.B
【解析】
【详解】
A、图为“某粒子”结构示意图,质子数为12,核外有2个电子层,为镁离子,故能确定x为8,说法正确;
B、该粒子质子数为12,核外有2个电子层,为镁离子,为阳离子,说法错误;
C、根据图示,该粒子的质子数为12,说法正确;
D、根据图示,该粒子的核外有两个电子层,说法正确;
故选:B。
4.B
【解析】
【详解】
A、由硫原子的结构示意图可知,硫原子核内有16个质子,故硫原子的核电荷数为16,不符合题意;
B、硫原子的原子结构示意图中最外层电子数为6,在化学反应中易得到电子,符合题意;
C、由硫原子的结构示意图,硫原子核内有16个质子,等于核外电子总数,即:2+x+6=16,则x=8,不符合题意;
D、硫原子的最外层得2个电子,最外层电子数为6+2=8,硫原子变成离子,符号是S2-,不符合题意。故选:B。
5.A
【解析】
【详解】
A、④中质子数≠核外电子数,表示的是镁离子,表示镁离子有二个电子层,此选项错误;
B、②的原子序数是11,是钠原子结构示意图,钠原子是金属元素的原子,此选项正确;
C、最外层是8个电子的结构是稳定结构,③④为相对稳定结构,此选项正确;
D、①③两种粒子的核内质子数相同,属于同种元素,此选项正确。
故选A。
6.D
【解析】
【详解】
A、由粒子结构示意图可知,该粒子的原子核内有11个质子,选项A正确;
B、原子结构示意图中原子核外的弧线表示电子层,由粒子结构示意图可知,该粒子的核外有三个电子层,选项B正确;
C、由粒子结构示意图可知,该粒子的最外层是第三层,该电子层上有一个电子,选项C正确;
D、由粒子结构示意图可知,该粒子中质子数=核外电子数,电子没有得失,是呈电中性的原子,选项D错误。故选D。
7.A
【解析】
【详解】
A、元素是质子数相同的一类原子的总称,它们的质子数不同,一个是11,一个是10,属于不同种元素,符合题意;
B、11号元素是钠元素,由“钅”字旁可知,钠元素属于金属元素,10号元素是氖元素,由“气”字旁可知,氖元素属于非金属元素,不符合题意;
C、原子的质子数=原子的核外电子数,故钠原子的核外电子数为11,氖原子的核外电子数为10,不相同,不符合题意;
D、①质子数小于核外电子数,表示阳离子,②质子数=核外电子数,表示原子,不符合题意。
故选A。
8.A
【解析】
【详解】
A、原子都是由原子核和核外电子构成的,故A说法正确;
B、分子的质量不一定比原子的质量大,故B说法错误;
C、离子通过得失电子也能形成原子,故C说法错误;
D、温度越高,原子间的间隔变大,原子的体积不变,故D说法错误;
故选:A。
9.B
【解析】
【详解】
A、该模型表示的是核裂变,此选项错误;
B、该反应产生的中子可继续轰击其他铀核形成链式反应,此选项正确;
C、该反应中产生的氪原子具有放射性,此选项错误;
D、该反应可通过核裂变来发电,例如:核电站是利用核裂变发电,此选项错误。
故选B。
10.A
【解析】
【分析】
原子结构示意图中,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,离圆圈最远的弧线表示最外层。若原子的最外层电子数为8,则为稀有气体元素,属于相对稳定结构;若最外层电子数≥4,在化学反应中易得电子,若最外层电子数<4,在化学反应中易失去电子。
【详解】
A、圆圈内数字表示核内质子数,该粒子有12个质子,故A正确;
B、把能量最低、离核最近的叫做第一层,该粒子第一层的2个电子能量最低,故B不正确;
C、该粒子的最外层电子数是2,该粒子没有已达到相对稳定结构,故C不正确;
D、该粒子的质子数为12,核外电子数为,质子数=核外电子数,为原子,故D不正确。故选A。
11.C
【解析】
【详解】
A、原子得失电子可以转化为离子,故A说法正确;
B、在原子中电子的质量与中子和质子相比较很小,可以忽略不计,所以原子的质量主要由质子和中子决定,故B说法正确;
C、离子之间存在着相互作用,分子之间也存在相互作用,故C说法错误;
D、原子得失电子后,原子核没有发生变化,故D说法正确。
故选C。
12.C
【解析】
【详解】
A、带电的粒子不一定是离子,例如电子带负电,不是离子,故A说法不正确;
B、分子是不断运动的,在干冰中,分子没有静止不动,故B说法不正确;
C、所有原子都由原子核和核外电子构成,故C说法正确;
D、分子都是由原子构成的,故D说法不正确。
故选C。
13.D
【解析】
【详解】
A、图为原子结构示意图,根据原子中:核外电子数=核内质子数可知,x=2+8+1=11,选项说法正确,故不符合题意;
B、决定元素种类的是核内质子数即核电荷数,选项说法正确,故不符合题意;
C、元素的化学性质与该原子的最外层电子数密切相关,选项说法正确,故不符合题意;
D、由图可知,R元素的原子最外层电子数为1小于4,在反应中易失去电子,形成R+,选项说法错误,故符合题意,故选D。
14.B
【解析】
【分析】
通过分析图中的原子或离子结构示意图可知,X是Cl-,Y是K+,M是Ar,N是Cl。
【详解】
A、 X是Cl-,N是Cl,所以两者的化学性质不同,不符合题意;
B、 离子Y是K+,得到一个电子可以变成K原子,该说法错误,符合题意;
C、 根据示意图可知,X是Cl-,Y是K+,两者均已形成稳定结构,不符合题意;
D、 X是Cl-,Y是K+,M是Ar,N是Cl,有两个离子,两个原子,不符合题意。故选B。
15.B
【解析】
【详解】
A、某元素的原子得失电子后变成离子,但质子数未变,因此元素的种类不变,故A归纳不合理;
B、离子是带电的粒子,但带电的粒子不一定是离子,例如,电子不是离子,故B归纳合理;
C、氯离子和氩原子的最外层电子数相同,但电性不同,它们的化学性质不相似,故C归纳不合理;
D、由同种分子构成的物质一定是纯净物,但纯净物不一定是由同种分子构成的,比如铜是由同种原子构成的,故D归纳不合理。
故选:B。
16.C
【解析】
【详解】
A、分子是保持物质化学性质的最小粒子,故A错;B、构成物质的微粒有分子、原子和离子,故B错;C、离子是指带电的原子或原子团,故C正确;D、氢原子核内没有中子,故D错。故选C。
17.D
【解析】
【分析】
根据核内质子数等于核外电子数,确定出黑球是质子,红球是中子,再进行分析即可。
【详解】
A、核内质子数等于核外电子数,由图乙可知黑球是质子,红球是中子,甲和乙中质子数都是1,丙中质子数是2,故A正确;
B、核内质子数等于核外电子数,由图乙可知黑球是质子,红球是中子,甲的中子数是1,乙和丙的中子数是2,故B正确;
C、决定原子质量大小的微粒是中子和质子,甲中含有一个质子和一个中子,乙中含有一个质子和2个中子,丙中含有2个质子和2个中子,所以质量:甲<乙<丙,故C正确;
D、由于ABC都正确,所以D错误,故D错误。
故选:D。
18. 17 3 2 得到 阴 Cl- 非金属
【解析】
【详解】
(1)该原子为氯原子,核电荷数为17,核外有3个电子层,第1层上有2个电子。
(2)该原子最外层电子数为7,在化学反应中易得到1个电子达到稳定结构,形成阴离子:符号为:Cl-;
(3)氯元素是非金属元素。
19. 3 B D C
【解析】
【详解】
(1)同种元素具有相同的质子数,A、B、C、D所示粒子共有三种质子数,表示3种元素;
(2)最外层电子数小于4个,在化学反应中容易失电子,B粒子容易失去一个电子形成稳定结构;
(3)一般情况下,最外层电子数为8(只有一层时为2),是一种相对稳定结构,具有相对稳定结构的是D;
(4)一般情况下,最外层电子数相等,化学性质相似,元素化学性质相似的是:A和C,它们的最外层电子数都为7。
20. 原子 阳离子 12 17 8
【解析】
【详解】
(1)当x=10+y时,核电荷数=核外电子数,该粒子表示原子;当x>10+y时,核电荷数>核外电子数,说明该粒子失去了电子,所以表示阳离子;
(2)若该结构示意图表示的粒子是R原子,则x=10+y,当y=2时,x=12。
(3)若该结构示意图表示的粒子是R-离子,说明R原子得到一个电子形成稳定结构,所以y=8,R-离子的核外电子数是18,又因为R原子得到一个电子形成R-离子,则x=17。
21. AE 四 B AE
【解析】
【详解】
(1)最外层电子数相同的原子具有相似的化学性质,据图可以看出,AE的最外层电子数是1,具有相似的化学性质;
(2)元素的种类与核内的质子数有关,据图可以看出,表格中共有四种元素;
(3)最外层电子数大于4的原子在化学反应中易获得电子,B原子的最外层电子数是6,易得到电子;
(4)上述粒子分别为锂原子、氧原子、硫离子、氧离子和钠原子,属于金属元素原子的是AE。
22. 8 钠原子的质子数(或核电荷数) B B和C 分子种类 湿衣服在阳光下比在阴凉处干的快
【解析】
【分析】
根据图示,BC是同种分子在不同温度下的运动速率不同,由AB可知,温度相同,分子不同,运动速率不同。
【详解】
(1)①在原子中,质子数=核外电子数,x的数值为
②“11”指的是钠原子的质子数(或核电荷数)
(2)①镓元素(Ga)的原子结构如图,镓原子最外层电子数为3,失去电子形成离子的符号可表示为。
②最外层电子数相同,化学性质相似,原子结构示意图所对应的元素与镓元素的化学性质相似的是铝原子,故选B。
(3)①在A. B和C中,B、C是同种分子,且在127℃时分子的运动速率大于27℃,故能比较得出“温度越高,分子运动速率越快”的是B和C。
②从图中可见,氢气和氧气在27℃时的分子运动速率不同,故影响分子运动速率的因素除温度外,还与分子种类有关。
③说明“温度升高,分子运动速率加快”的生活事例湿衣服在阳光下比在阴凉处干的快。能说明“温度升高,分子运动速率加快”。
【点睛】
最外层电子数相同,化学性质相似,在原子中,质子数=核外电子数,分子运动速率的因素与温度和分子种类有关。
一、单选题
1.下列各微粒的结构示意图中表示阳离子的是( )
A. B. C. D.
2.考古学家通过C-14测定法将我省宁波地区的文明发展史推到距今8000多年前。C-14原子的核电荷数为6.相对原子质量为14,则该原子核外电子数为( )
A.6 B.8 C.14 D.20
3.某粒子结构示意图如图所示。下列说法不正确的是
A.x为8
B.该粒子为阴离子
C.该粒子的质子数为12
D.该粒子的核外有两个电子层
4.如图是硫原子的结构示意图,下列由图中获取的信息错误的是
A.硫原子的核电荷数为16
B.硫原子在化学反应中易失去电子
C.硫原子的结构示意图中的x等于8
D.硫原子所形成离子的符号为S2-
5.根据图中提供的信息判断,下列说法不正确的是( )
A.④表示镁原子有二个电子层 B.②表示金属元素的原子
C.③④为相对稳定结构 D.①③属于同种元素
6.如图为某粒子的结构示意图,有关该粒子的说法中,错误的是( )
A.该粒子的原子核内有11个质子
B.该粒子的核外有三个电子层
C.该粒子最外层上有一个电子
D.该粒子是带负电的阴离子
7.从如图所示的两种粒子结构示意图中,所获取的信息正确的是( )
A.它们属于不同种元素
B.它们都属于非金属元素
C.它们原子的核外电子数相同
D.①表示阴离子,②表示原子
8.下列有关原子的说法正确的是( )
A.原子都由原子核和核外电子构成
B.分子的质量一定比原子的质量大
C.原子通过得失电子形成离子,离子不能形成原子
D.温度越高,原子的体积越大
9.如图表示用中子轰击铀-235原子核产生氪核和钡核的模型。下列叙述正确的是( )
A.该模型表示的是核聚变
B.该反应产生的中子可继续轰击其他铀核形成链式反应
C.该反应不会产生放射性物质
D.不能用该反应获得能量的方式来发电
10.如图为某粒子的结构示意图,下列说法正确的是( )
A.该粒子有12个质子
B.该粒子第一层的2个电子能量最高
C.该粒子已达到相对稳定结构
D.该粒子是阳离子
11.建立正确的微粒观有助于化学的学习,下列有关微粒的说法错误的是( )
A.原子可以转化为离子
B.原子的质量主要由质子和中子决定
C.离子之间存在着相互作用,分子之间不存在相互作用
D.原子得失电子后,原子核没有发生变化
12.下列关于微观粒子的说法,正确的是
A.带电的粒子一定是离子
B.在干冰中,分子因相互作用而静止不动
C.所有原子都由原子核和核外电子构成
D.并不是所有分子都是由原子构成的
13.下图为R元素的原子结构示意图。下列说法错误的是
A.x值为11
B.决定R元素种类的是核内的质子数
C.R元素化学性质与最外层电子数密切相关
D.R在反应中易得电子,形成R-
14.关于下列四种粒子的说法不正确的是( )
A.X与N的化学性质不同
B.粒子Y若失去一个电子就可以变成原子
C.X和Y均已形成稳定结构
D.上述粒子中有两个是离子,两个是原子
15.下列推理或归纳中,合理的是( )
A.某元素的原子得失电子后即变成另外一种元素的原子
B.离子是带电的粒子,但带电的粒子不一定是离子
C.氯离子和氩原子的最外层电子数相同,它们的化学性质相似
D.由同种分子构成的物质一定是纯净物,所以纯净物一定是由同种分子构成的
16.下列关于分子、原子、离子的说法正确的是( )
A.分子是保持物质性质的最小粒子
B.物质都是由分子构成
C.离子是带电的原子或原子团
D.原子都含有质子、中子和电子
17.如图为核聚变的示意图,其中 甲、乙、丙表示三种原子,根据如图所示,下列说法中错误的是( )
A.质子数:甲=乙<丙 B.中子数:甲<乙=丙
C.质量:甲<乙<丙 D.上述说法不全对
二、填空题
18.如图所示某原子的结构示意图:请回答:
(1)该原子的核电荷数为_______,核外有________个电子层,第1层上有____个电子。
(2)该原子在化学反应中易________(填“得到”或“失去”)电子,成为________离子,符号为______。
(3)该元素是________(填“金属”或“非金属”)元素。
19.根据下列粒子结构示意图回答下列问题:
(1)A、B、C、D所示粒子共表示______________种元素(填数字);
(2)在化学反应中容易失电子的粒子是________(填序号,下同);
(3)具有相对稳定结构的是_______________;
(4)元素化学性质相似的是A和_______________。
20.某粒子R的结构示意图为 。
(1)当x=10+y时,该粒子为 _________ (填“原子”或“阳离子”或“阴离子”,下同),当x>10+y时,该粒子为 _________ 。
(2)若该结构示意图表示的粒子是R原子,当y=2时,x= _________ 。
(3)若该结构示意图表示的粒子是R-,则x= _________ ,y= _________ 。
21.下表列出了一些粒子的结构示意图,请回答问题:
A B C D E
(1)具有相似化学性质的原子是___________(用 ABCDE表示)。
(2)表格中共有________种元素的粒子。
(3)在化学反应中容易获得电子的粒子是_________(用 ABCDE表示)。
(4)上述粒子中属于金属元素原子的是________(用 ABCDE表示)。
22.模型是联系宏观与微观的桥梁.
(1)下图是钠原子结构示意图.
①x的数值为_________.
②“11”指的是__________.
(2)氮化镓(GaN)是“蓝色发光二极管”研发技术中的重要材料.
①镓元素(Ga)的原子结构如图,镓原子失去电子形成离子的符号可表示为__________.
②下列原子结构示意图所对应的元素与镓元素的化学性质相似的是______(填字母序号).
A B C D
(3)下图是氢分子和氧分子运动的示意图.
A B C
①在A、B和C中,能比较得出“温度越高,分子运动速率越快”的是_____(填标号).
②从图中可见,影响分子运动速率的因素除温度外,还与_________有关.
③举一个能说明“温度升高,分子运动速率加快”的生活事例:____________.
参考答案:
1.B
【解析】
【详解】
A、核内质子数等于核外电子数,属于原子,故A错误;
B、核内质子数大于核外电子数,原子失去了电子,带正电荷,属于阳离子,故B正确;
C、核内质子数等于核外电子数,属于原子,故C错误;
D、核内质子数小于核外电子数,原子得到了电子,带负电荷,属于阴离子,故D错误。故选B。
【点睛】
核内质子数等于核外电子数属于原子,核内质子数大于核外电子数为阳离子,核内质子数小于核外电子数为阴离子。
2.A
【解析】
【分析】
【详解】
在原子中:核电荷数=核内质子数=核外电子数,已知C-14原子的核电荷数为6,则该原子核外电子数为6。
故选:A。
【点睛】
熟记原子中这两个等式:核电荷数=核内质子数=核外电子数;相对原子质量=质子数+中子数。
3.B
【解析】
【详解】
A、图为“某粒子”结构示意图,质子数为12,核外有2个电子层,为镁离子,故能确定x为8,说法正确;
B、该粒子质子数为12,核外有2个电子层,为镁离子,为阳离子,说法错误;
C、根据图示,该粒子的质子数为12,说法正确;
D、根据图示,该粒子的核外有两个电子层,说法正确;
故选:B。
4.B
【解析】
【详解】
A、由硫原子的结构示意图可知,硫原子核内有16个质子,故硫原子的核电荷数为16,不符合题意;
B、硫原子的原子结构示意图中最外层电子数为6,在化学反应中易得到电子,符合题意;
C、由硫原子的结构示意图,硫原子核内有16个质子,等于核外电子总数,即:2+x+6=16,则x=8,不符合题意;
D、硫原子的最外层得2个电子,最外层电子数为6+2=8,硫原子变成离子,符号是S2-,不符合题意。故选:B。
5.A
【解析】
【详解】
A、④中质子数≠核外电子数,表示的是镁离子,表示镁离子有二个电子层,此选项错误;
B、②的原子序数是11,是钠原子结构示意图,钠原子是金属元素的原子,此选项正确;
C、最外层是8个电子的结构是稳定结构,③④为相对稳定结构,此选项正确;
D、①③两种粒子的核内质子数相同,属于同种元素,此选项正确。
故选A。
6.D
【解析】
【详解】
A、由粒子结构示意图可知,该粒子的原子核内有11个质子,选项A正确;
B、原子结构示意图中原子核外的弧线表示电子层,由粒子结构示意图可知,该粒子的核外有三个电子层,选项B正确;
C、由粒子结构示意图可知,该粒子的最外层是第三层,该电子层上有一个电子,选项C正确;
D、由粒子结构示意图可知,该粒子中质子数=核外电子数,电子没有得失,是呈电中性的原子,选项D错误。故选D。
7.A
【解析】
【详解】
A、元素是质子数相同的一类原子的总称,它们的质子数不同,一个是11,一个是10,属于不同种元素,符合题意;
B、11号元素是钠元素,由“钅”字旁可知,钠元素属于金属元素,10号元素是氖元素,由“气”字旁可知,氖元素属于非金属元素,不符合题意;
C、原子的质子数=原子的核外电子数,故钠原子的核外电子数为11,氖原子的核外电子数为10,不相同,不符合题意;
D、①质子数小于核外电子数,表示阳离子,②质子数=核外电子数,表示原子,不符合题意。
故选A。
8.A
【解析】
【详解】
A、原子都是由原子核和核外电子构成的,故A说法正确;
B、分子的质量不一定比原子的质量大,故B说法错误;
C、离子通过得失电子也能形成原子,故C说法错误;
D、温度越高,原子间的间隔变大,原子的体积不变,故D说法错误;
故选:A。
9.B
【解析】
【详解】
A、该模型表示的是核裂变,此选项错误;
B、该反应产生的中子可继续轰击其他铀核形成链式反应,此选项正确;
C、该反应中产生的氪原子具有放射性,此选项错误;
D、该反应可通过核裂变来发电,例如:核电站是利用核裂变发电,此选项错误。
故选B。
10.A
【解析】
【分析】
原子结构示意图中,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,离圆圈最远的弧线表示最外层。若原子的最外层电子数为8,则为稀有气体元素,属于相对稳定结构;若最外层电子数≥4,在化学反应中易得电子,若最外层电子数<4,在化学反应中易失去电子。
【详解】
A、圆圈内数字表示核内质子数,该粒子有12个质子,故A正确;
B、把能量最低、离核最近的叫做第一层,该粒子第一层的2个电子能量最低,故B不正确;
C、该粒子的最外层电子数是2,该粒子没有已达到相对稳定结构,故C不正确;
D、该粒子的质子数为12,核外电子数为,质子数=核外电子数,为原子,故D不正确。故选A。
11.C
【解析】
【详解】
A、原子得失电子可以转化为离子,故A说法正确;
B、在原子中电子的质量与中子和质子相比较很小,可以忽略不计,所以原子的质量主要由质子和中子决定,故B说法正确;
C、离子之间存在着相互作用,分子之间也存在相互作用,故C说法错误;
D、原子得失电子后,原子核没有发生变化,故D说法正确。
故选C。
12.C
【解析】
【详解】
A、带电的粒子不一定是离子,例如电子带负电,不是离子,故A说法不正确;
B、分子是不断运动的,在干冰中,分子没有静止不动,故B说法不正确;
C、所有原子都由原子核和核外电子构成,故C说法正确;
D、分子都是由原子构成的,故D说法不正确。
故选C。
13.D
【解析】
【详解】
A、图为原子结构示意图,根据原子中:核外电子数=核内质子数可知,x=2+8+1=11,选项说法正确,故不符合题意;
B、决定元素种类的是核内质子数即核电荷数,选项说法正确,故不符合题意;
C、元素的化学性质与该原子的最外层电子数密切相关,选项说法正确,故不符合题意;
D、由图可知,R元素的原子最外层电子数为1小于4,在反应中易失去电子,形成R+,选项说法错误,故符合题意,故选D。
14.B
【解析】
【分析】
通过分析图中的原子或离子结构示意图可知,X是Cl-,Y是K+,M是Ar,N是Cl。
【详解】
A、 X是Cl-,N是Cl,所以两者的化学性质不同,不符合题意;
B、 离子Y是K+,得到一个电子可以变成K原子,该说法错误,符合题意;
C、 根据示意图可知,X是Cl-,Y是K+,两者均已形成稳定结构,不符合题意;
D、 X是Cl-,Y是K+,M是Ar,N是Cl,有两个离子,两个原子,不符合题意。故选B。
15.B
【解析】
【详解】
A、某元素的原子得失电子后变成离子,但质子数未变,因此元素的种类不变,故A归纳不合理;
B、离子是带电的粒子,但带电的粒子不一定是离子,例如,电子不是离子,故B归纳合理;
C、氯离子和氩原子的最外层电子数相同,但电性不同,它们的化学性质不相似,故C归纳不合理;
D、由同种分子构成的物质一定是纯净物,但纯净物不一定是由同种分子构成的,比如铜是由同种原子构成的,故D归纳不合理。
故选:B。
16.C
【解析】
【详解】
A、分子是保持物质化学性质的最小粒子,故A错;B、构成物质的微粒有分子、原子和离子,故B错;C、离子是指带电的原子或原子团,故C正确;D、氢原子核内没有中子,故D错。故选C。
17.D
【解析】
【分析】
根据核内质子数等于核外电子数,确定出黑球是质子,红球是中子,再进行分析即可。
【详解】
A、核内质子数等于核外电子数,由图乙可知黑球是质子,红球是中子,甲和乙中质子数都是1,丙中质子数是2,故A正确;
B、核内质子数等于核外电子数,由图乙可知黑球是质子,红球是中子,甲的中子数是1,乙和丙的中子数是2,故B正确;
C、决定原子质量大小的微粒是中子和质子,甲中含有一个质子和一个中子,乙中含有一个质子和2个中子,丙中含有2个质子和2个中子,所以质量:甲<乙<丙,故C正确;
D、由于ABC都正确,所以D错误,故D错误。
故选:D。
18. 17 3 2 得到 阴 Cl- 非金属
【解析】
【详解】
(1)该原子为氯原子,核电荷数为17,核外有3个电子层,第1层上有2个电子。
(2)该原子最外层电子数为7,在化学反应中易得到1个电子达到稳定结构,形成阴离子:符号为:Cl-;
(3)氯元素是非金属元素。
19. 3 B D C
【解析】
【详解】
(1)同种元素具有相同的质子数,A、B、C、D所示粒子共有三种质子数,表示3种元素;
(2)最外层电子数小于4个,在化学反应中容易失电子,B粒子容易失去一个电子形成稳定结构;
(3)一般情况下,最外层电子数为8(只有一层时为2),是一种相对稳定结构,具有相对稳定结构的是D;
(4)一般情况下,最外层电子数相等,化学性质相似,元素化学性质相似的是:A和C,它们的最外层电子数都为7。
20. 原子 阳离子 12 17 8
【解析】
【详解】
(1)当x=10+y时,核电荷数=核外电子数,该粒子表示原子;当x>10+y时,核电荷数>核外电子数,说明该粒子失去了电子,所以表示阳离子;
(2)若该结构示意图表示的粒子是R原子,则x=10+y,当y=2时,x=12。
(3)若该结构示意图表示的粒子是R-离子,说明R原子得到一个电子形成稳定结构,所以y=8,R-离子的核外电子数是18,又因为R原子得到一个电子形成R-离子,则x=17。
21. AE 四 B AE
【解析】
【详解】
(1)最外层电子数相同的原子具有相似的化学性质,据图可以看出,AE的最外层电子数是1,具有相似的化学性质;
(2)元素的种类与核内的质子数有关,据图可以看出,表格中共有四种元素;
(3)最外层电子数大于4的原子在化学反应中易获得电子,B原子的最外层电子数是6,易得到电子;
(4)上述粒子分别为锂原子、氧原子、硫离子、氧离子和钠原子,属于金属元素原子的是AE。
22. 8 钠原子的质子数(或核电荷数) B B和C 分子种类 湿衣服在阳光下比在阴凉处干的快
【解析】
【分析】
根据图示,BC是同种分子在不同温度下的运动速率不同,由AB可知,温度相同,分子不同,运动速率不同。
【详解】
(1)①在原子中,质子数=核外电子数,x的数值为
②“11”指的是钠原子的质子数(或核电荷数)
(2)①镓元素(Ga)的原子结构如图,镓原子最外层电子数为3,失去电子形成离子的符号可表示为。
②最外层电子数相同,化学性质相似,原子结构示意图所对应的元素与镓元素的化学性质相似的是铝原子,故选B。
(3)①在A. B和C中,B、C是同种分子,且在127℃时分子的运动速率大于27℃,故能比较得出“温度越高,分子运动速率越快”的是B和C。
②从图中可见,氢气和氧气在27℃时的分子运动速率不同,故影响分子运动速率的因素除温度外,还与分子种类有关。
③说明“温度升高,分子运动速率加快”的生活事例湿衣服在阳光下比在阴凉处干的快。能说明“温度升高,分子运动速率加快”。
【点睛】
最外层电子数相同,化学性质相似,在原子中,质子数=核外电子数,分子运动速率的因素与温度和分子种类有关。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
