2.3 制取氧气 新课标测试卷 九年级化学人教版上册(有答案)
文档属性
| 名称 | 2.3 制取氧气 新课标测试卷 九年级化学人教版上册(有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 143.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-21 07:23:55 | ||
图片预览

文档简介
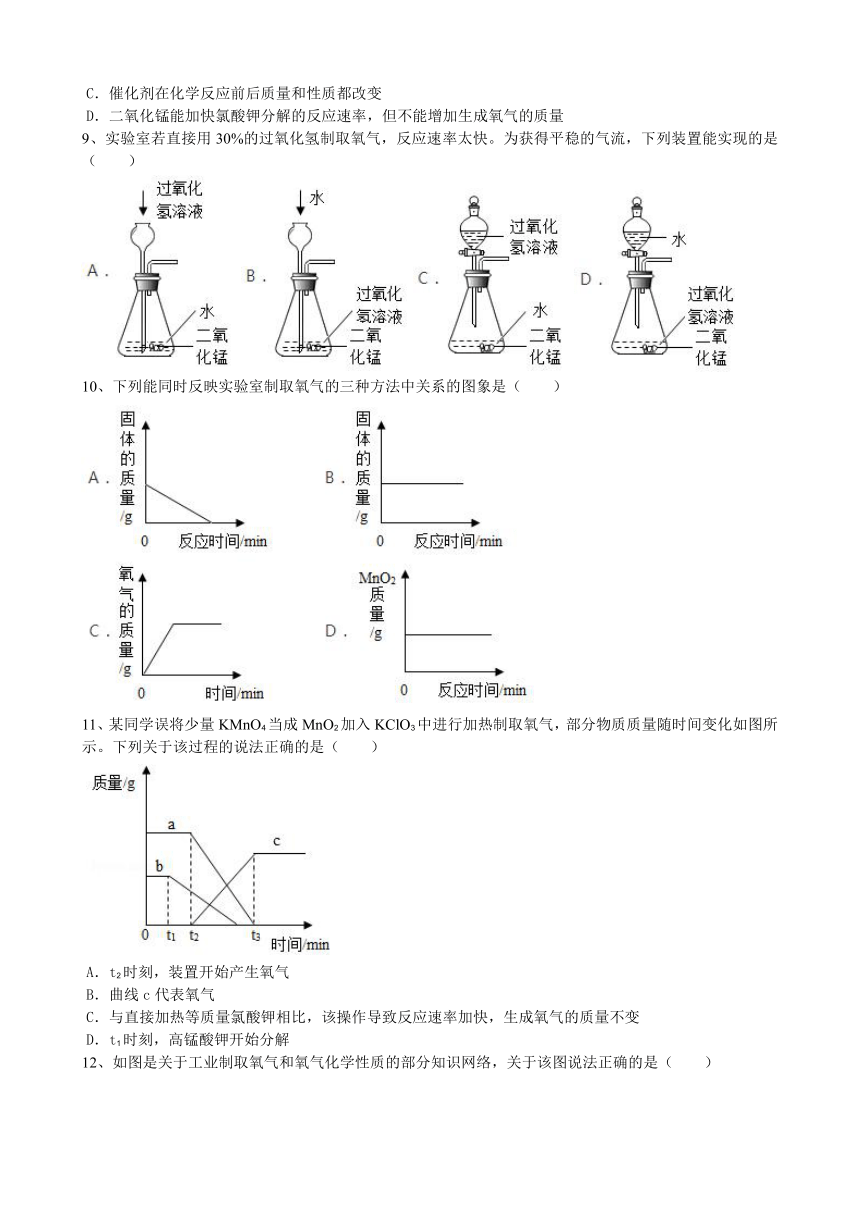
2.3制取氧气新课标测试卷
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1、下列有关氧气的描述正确的是( )
A.实验室用分离液态空气制取氧气
B.氧气不易溶于水
C.空气中的氧气和水中溶解的氧气化学性质不同
D.低温下氧气可以变成无色液体
2、实验室里用双氧水溶液制取氧气,所选发生装置最合适的是( )
3、氧气可以用向上排空气法收集的原因( )
A.无色 B.无味
C.熔点低 D.密度比空气大
4、用氯酸钾制备氧气,需使用的仪器有( )
①大试管②烧杯③试管夹④酒精灯⑤单孔塞⑥石棉网⑦铁架台(带铁夹)
A.①④⑤⑦ B.②④⑥ C.①③④ D.②④⑥⑦
5、“证据推理”是化学学科核心素养的组成要素之一。如图,将带火星木条放到集气瓶口,木条复燃。由上述证据推理,不能得到的结论是( )
A.该气体是氧气 B.氧气密度大于空气
C.氧气不易溶于水 D.氧气收集满了
6、实验室制取氧气的装置中,有关几个“口”的位置错误的是( )
A.用排空气法收集氧气验满时,应用带火星的木条置于集气瓶口
B.装高锰酸钾的试管口应略向下倾斜
C.用排空气法收集氧气时,集气瓶瓶口应朝上
D.用排水法收集氧气时,导气管口应伸至集气瓶底
7、实验室用高锰酸钾加热制取氧气,有如下操作步骤:①加热;②检查装置的气密性;③装入高锰酸钾,并在试管口放一团棉花;④用排水法收集氧气;⑤从水槽中取出导管;⑥熄灭酒精灯;⑦拆洗仪器清理实验台。其操作顺序正确的是( )
A.②③①④⑤⑥⑦ B.①③②⑤④⑥⑦ C.⑤③②①④⑥⑦ D.③①②④⑥⑤⑦
8、催化剂在生产生活中应用广泛,下列关于催化剂的说法中正确的是( )
A.催化剂不能加快化学反应速率
B.实验室用过氧化氢溶液制取氧气时只能用二氧化锰做催化剂
C.催化剂在化学反应前后质量和性质都改变
D.二氧化锰能加快氯酸钾分解的反应速率,但不能增加生成氧气的质量
9、实验室若直接用30%的过氧化氢制取氧气,反应速率太快。为获得平稳的气流,下列装置能实现的是( )
10、下列能同时反映实验室制取氧气的三种方法中关系的图象是( )
11、某同学误将少量KMnO4当成MnO2加入KClO3中进行加热制取氧气,部分物质质量随时间变化如图所示。下列关于该过程的说法正确的是( )
A.t2时刻,装置开始产生氧气
B.曲线c代表氧气
C.与直接加热等质量氯酸钾相比,该操作导致反应速率加快,生成氧气的质量不变
D.t1时刻,高锰酸钾开始分解
12、如图是关于工业制取氧气和氧气化学性质的部分知识网络,关于该图说法正确的是( )
A.工业上用分离液态空气的方法制取氧气是利用了氧气的化学性质
B.①、②两类反应均体现了氧气的可燃性
C.①类反应吸收热量
D.铁在①类反应中的生成物为四氧化三铁
二、本大题包括5小题,共28分
13、如图是实验室用加热高锰酸钾的方法制取氧气的装置图,请回答下列问题。
(1)请指出图中的四处错误
① ;② ;
③ ;④ 。
(2)请写出反应的文字表达式 。
(3)收集氧气可以用 法,其原因是 ;还可以用 法,其原因是: 。
(4)请写出验满氧气的方法 。
14、根据如图实验装置,请回答:
(1)仪器a的名称是 。
(2)检查装置A气密性的方法是夹紧止水夹, ,则气密性良好。
(3)用氯酸钾制取氧气,选择的发生装置为 (填字母),反应的文字表达式为: 。
(4)用装置F和另一仪器(除导管外)收集并测量O2体积,另一仪器名称为 ,在F中气体应从导管 (填“b”或“c”)端通入。
15、工业制取氧气主要有下列步骤。将经过除尘、除二氧化碳、除水的空气进行下列操作:
(1)工业制氧气属于 (填“物理变化”或“化学变化”);
(2)从步骤②可以得出氮气的沸点比氧气的沸点 (填“高”或“低”);
(3)步骤②得到的剩余液体为 色;
(4)储存在蓝色钢瓶里的“工业液氧”是 (填“纯净物”或“混合物”);
(5)用 可以区分空气、“工业液氧”和二氧化碳。
16、小明知道二氧化锰能作过氧化氢分解的催化剂后,再想探究其他一些物质如氧化铝是否也可作过氧化氢分解的催化剂。请你一起参与他们的探究过程,并填写下列空白。(1)[问题]氧化铝能不能作过氧化氢分解的催化剂呢?
(2)【猜想】氧化铝能作过氧化氢分解的催化剂。他设计并完成了下表所示的探究实验:
实验操作 实验现象 实验结论或总结
结论 总结
实验一 取5ml5%的过氧化氢溶液于试管中,伸入带火星的木条 有气泡产生,木条不复燃 过氧化氢分解产生氧气,但是
① 氧化铝是过氧化氢分解的催化剂
实验二 在盛水的试管中加入氧化铝,伸入带火星的木条 没有明显现象 ②
实验三 ③ ④ 氧化铝能加快过氧化氢的分解
(1)请你帮助小明同学填写上表中未完的表格。
(2)在小明的探究实验中,实验一和实验二起的作用是 ;
(3)【讨论与反思】经过讨论,有的同学认为只有上述两个证据,不能证明氧化铝能作过氧化氢分解的催化剂,还要补充两个方面的探究实验,最终大家一起完成了对这个猜想的验证。第一方面的实验操作中包含了两次称量,其目的是 ,第二方面的实验是利用实验三反应后试管内的剩余物继续实验。接下来的实验操作是 现象和结论为 。
17、小亮同学阅读课外资料后得知:过氧化氢分解除了用二氧化锰还可用氧化铜(黑色粉末)等物质作催化剂。于是他对氧化铜产生了探究兴趣。
【提出问题】氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰的催化效果更好?
【设计实验】小亮同学以相同时间内生成氧气的体积为标准,设计了下列三组实验(其他可能影响实验的因素均忽略请帮助小亮同学完成以下问题:
实验序号 氯酸钾的质量 其他物质质量 相同时间内生成氧气的体积/mL
① g / 2
② 10g 氧化铜2g 5
③ 10g 二氧化锰2g x
(1)实验①中加入氯酸钾的质量为 g。
(2)将实验②充分反应后的固体加水溶解(氯化钾易溶于水,而氧化铜难溶于水)、过滤、洗涤、干燥。若称量得到2g黑色粉末,再将黑色粉末放入试管中和10g氯酸钾混合加热,与②相同的时间内生成5mL氧气,则说明黑色粉末的在反应前后保持不变。
【预期结论】 。
【评价设计】你认为小亮设计实验③和实验②对比的目的是 。
参考答案
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1 2 3 4 5 6 7 8 9 10
B B D A C D A D C C
11 12
D D
二、本大题包括5小题,共28分
13、(2)试管口未放一小团棉花;试管口未向下倾斜;导管不应伸入试管中太长;不应用向下排空气法收集气体;
(3)高锰酸钾锰酸钾+二氧化锰+氧气;
(4)向上排空气;氧气的密度大于空气;排水;氧气不易溶于水;
(5)将带火星的木条放在集气瓶口,如果木条复燃,说明已收集满。
14、(1)长颈漏斗;
(2)从长颈漏斗中倒入水至淹没下端管口,使长颈漏斗中形成一段水柱,过一会儿,水柱不下降;(合理即可)
(4)量筒;c。
15、(1)物理变化;(2)低;(3)淡蓝;(4)混合物;(5)燃着的木条。
16、(1)
实验操作 实验现象 实验结论或总结
结论 总结
实验一
①速度很慢
实验二 ②氧化铝不能分解生成氧气
实验三 ③向盛有5mL5%过氧化氢溶液的试管中加入氧化铝,伸入带火星的木条 ④有大量气泡产生,带火星的木条迅速复燃
(2)对比
(3)比较氧化铝在过氧化氢分解前后的质量;倾倒掉反应后的液体,向剩余的固体中重新加入过氧化氢溶液,伸入带火星的木条;有大量气泡产生,带火星的木条复燃,说明氧化铝然能加快过氧化氢的分解速率。
17、(1)10;
(2)氧化铜能作为氯酸钾分解的催化剂;
氧化铜和二氧化锰的催化效果哪个好。
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1、下列有关氧气的描述正确的是( )
A.实验室用分离液态空气制取氧气
B.氧气不易溶于水
C.空气中的氧气和水中溶解的氧气化学性质不同
D.低温下氧气可以变成无色液体
2、实验室里用双氧水溶液制取氧气,所选发生装置最合适的是( )
3、氧气可以用向上排空气法收集的原因( )
A.无色 B.无味
C.熔点低 D.密度比空气大
4、用氯酸钾制备氧气,需使用的仪器有( )
①大试管②烧杯③试管夹④酒精灯⑤单孔塞⑥石棉网⑦铁架台(带铁夹)
A.①④⑤⑦ B.②④⑥ C.①③④ D.②④⑥⑦
5、“证据推理”是化学学科核心素养的组成要素之一。如图,将带火星木条放到集气瓶口,木条复燃。由上述证据推理,不能得到的结论是( )
A.该气体是氧气 B.氧气密度大于空气
C.氧气不易溶于水 D.氧气收集满了
6、实验室制取氧气的装置中,有关几个“口”的位置错误的是( )
A.用排空气法收集氧气验满时,应用带火星的木条置于集气瓶口
B.装高锰酸钾的试管口应略向下倾斜
C.用排空气法收集氧气时,集气瓶瓶口应朝上
D.用排水法收集氧气时,导气管口应伸至集气瓶底
7、实验室用高锰酸钾加热制取氧气,有如下操作步骤:①加热;②检查装置的气密性;③装入高锰酸钾,并在试管口放一团棉花;④用排水法收集氧气;⑤从水槽中取出导管;⑥熄灭酒精灯;⑦拆洗仪器清理实验台。其操作顺序正确的是( )
A.②③①④⑤⑥⑦ B.①③②⑤④⑥⑦ C.⑤③②①④⑥⑦ D.③①②④⑥⑤⑦
8、催化剂在生产生活中应用广泛,下列关于催化剂的说法中正确的是( )
A.催化剂不能加快化学反应速率
B.实验室用过氧化氢溶液制取氧气时只能用二氧化锰做催化剂
C.催化剂在化学反应前后质量和性质都改变
D.二氧化锰能加快氯酸钾分解的反应速率,但不能增加生成氧气的质量
9、实验室若直接用30%的过氧化氢制取氧气,反应速率太快。为获得平稳的气流,下列装置能实现的是( )
10、下列能同时反映实验室制取氧气的三种方法中关系的图象是( )
11、某同学误将少量KMnO4当成MnO2加入KClO3中进行加热制取氧气,部分物质质量随时间变化如图所示。下列关于该过程的说法正确的是( )
A.t2时刻,装置开始产生氧气
B.曲线c代表氧气
C.与直接加热等质量氯酸钾相比,该操作导致反应速率加快,生成氧气的质量不变
D.t1时刻,高锰酸钾开始分解
12、如图是关于工业制取氧气和氧气化学性质的部分知识网络,关于该图说法正确的是( )
A.工业上用分离液态空气的方法制取氧气是利用了氧气的化学性质
B.①、②两类反应均体现了氧气的可燃性
C.①类反应吸收热量
D.铁在①类反应中的生成物为四氧化三铁
二、本大题包括5小题,共28分
13、如图是实验室用加热高锰酸钾的方法制取氧气的装置图,请回答下列问题。
(1)请指出图中的四处错误
① ;② ;
③ ;④ 。
(2)请写出反应的文字表达式 。
(3)收集氧气可以用 法,其原因是 ;还可以用 法,其原因是: 。
(4)请写出验满氧气的方法 。
14、根据如图实验装置,请回答:
(1)仪器a的名称是 。
(2)检查装置A气密性的方法是夹紧止水夹, ,则气密性良好。
(3)用氯酸钾制取氧气,选择的发生装置为 (填字母),反应的文字表达式为: 。
(4)用装置F和另一仪器(除导管外)收集并测量O2体积,另一仪器名称为 ,在F中气体应从导管 (填“b”或“c”)端通入。
15、工业制取氧气主要有下列步骤。将经过除尘、除二氧化碳、除水的空气进行下列操作:
(1)工业制氧气属于 (填“物理变化”或“化学变化”);
(2)从步骤②可以得出氮气的沸点比氧气的沸点 (填“高”或“低”);
(3)步骤②得到的剩余液体为 色;
(4)储存在蓝色钢瓶里的“工业液氧”是 (填“纯净物”或“混合物”);
(5)用 可以区分空气、“工业液氧”和二氧化碳。
16、小明知道二氧化锰能作过氧化氢分解的催化剂后,再想探究其他一些物质如氧化铝是否也可作过氧化氢分解的催化剂。请你一起参与他们的探究过程,并填写下列空白。(1)[问题]氧化铝能不能作过氧化氢分解的催化剂呢?
(2)【猜想】氧化铝能作过氧化氢分解的催化剂。他设计并完成了下表所示的探究实验:
实验操作 实验现象 实验结论或总结
结论 总结
实验一 取5ml5%的过氧化氢溶液于试管中,伸入带火星的木条 有气泡产生,木条不复燃 过氧化氢分解产生氧气,但是
① 氧化铝是过氧化氢分解的催化剂
实验二 在盛水的试管中加入氧化铝,伸入带火星的木条 没有明显现象 ②
实验三 ③ ④ 氧化铝能加快过氧化氢的分解
(1)请你帮助小明同学填写上表中未完的表格。
(2)在小明的探究实验中,实验一和实验二起的作用是 ;
(3)【讨论与反思】经过讨论,有的同学认为只有上述两个证据,不能证明氧化铝能作过氧化氢分解的催化剂,还要补充两个方面的探究实验,最终大家一起完成了对这个猜想的验证。第一方面的实验操作中包含了两次称量,其目的是 ,第二方面的实验是利用实验三反应后试管内的剩余物继续实验。接下来的实验操作是 现象和结论为 。
17、小亮同学阅读课外资料后得知:过氧化氢分解除了用二氧化锰还可用氧化铜(黑色粉末)等物质作催化剂。于是他对氧化铜产生了探究兴趣。
【提出问题】氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰的催化效果更好?
【设计实验】小亮同学以相同时间内生成氧气的体积为标准,设计了下列三组实验(其他可能影响实验的因素均忽略请帮助小亮同学完成以下问题:
实验序号 氯酸钾的质量 其他物质质量 相同时间内生成氧气的体积/mL
① g / 2
② 10g 氧化铜2g 5
③ 10g 二氧化锰2g x
(1)实验①中加入氯酸钾的质量为 g。
(2)将实验②充分反应后的固体加水溶解(氯化钾易溶于水,而氧化铜难溶于水)、过滤、洗涤、干燥。若称量得到2g黑色粉末,再将黑色粉末放入试管中和10g氯酸钾混合加热,与②相同的时间内生成5mL氧气,则说明黑色粉末的在反应前后保持不变。
【预期结论】 。
【评价设计】你认为小亮设计实验③和实验②对比的目的是 。
参考答案
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1 2 3 4 5 6 7 8 9 10
B B D A C D A D C C
11 12
D D
二、本大题包括5小题,共28分
13、(2)试管口未放一小团棉花;试管口未向下倾斜;导管不应伸入试管中太长;不应用向下排空气法收集气体;
(3)高锰酸钾锰酸钾+二氧化锰+氧气;
(4)向上排空气;氧气的密度大于空气;排水;氧气不易溶于水;
(5)将带火星的木条放在集气瓶口,如果木条复燃,说明已收集满。
14、(1)长颈漏斗;
(2)从长颈漏斗中倒入水至淹没下端管口,使长颈漏斗中形成一段水柱,过一会儿,水柱不下降;(合理即可)
(4)量筒;c。
15、(1)物理变化;(2)低;(3)淡蓝;(4)混合物;(5)燃着的木条。
16、(1)
实验操作 实验现象 实验结论或总结
结论 总结
实验一
①速度很慢
实验二 ②氧化铝不能分解生成氧气
实验三 ③向盛有5mL5%过氧化氢溶液的试管中加入氧化铝,伸入带火星的木条 ④有大量气泡产生,带火星的木条迅速复燃
(2)对比
(3)比较氧化铝在过氧化氢分解前后的质量;倾倒掉反应后的液体,向剩余的固体中重新加入过氧化氢溶液,伸入带火星的木条;有大量气泡产生,带火星的木条复燃,说明氧化铝然能加快过氧化氢的分解速率。
17、(1)10;
(2)氧化铜能作为氯酸钾分解的催化剂;
氧化铜和二氧化锰的催化效果哪个好。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
