2022-2023学年人教版九年级化学上册 5.3利用化学方程式进行的简单计算(34张PPT)
文档属性
| 名称 | 2022-2023学年人教版九年级化学上册 5.3利用化学方程式进行的简单计算(34张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-21 09:26:12 | ||
图片预览










文档简介
(共34张PPT)
第五单元 化学方程式 The chemical equation
5.3 如何正确书写化学方程式
学
习
目
标
Learning objectives
1.
知道化学方程式计算的依据
2.
掌握化学方程式计算的步骤
我爱神舟十号
1、从化学角度看,发射“神舟十号”需要什么?
燃料
2、为了合理利用资源和准确控制火箭,燃料和助燃剂能随意量填充吗?需要做什么?
计算
新课引入
3
如果火箭用氢气作燃料。而你是火箭发动机设计师,火箭助推上升时,燃烧需要氢气200Kg时,你会在火箭助燃剂仓中填充多少氧气使之完全燃烧?800Kg氧气行吗?为什么?
【设问】
该怎么计算呢?
4
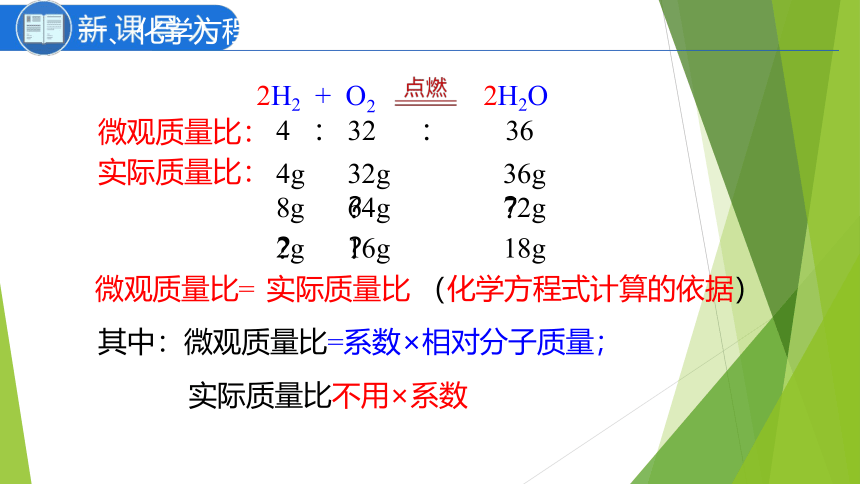
一、化学方程式计算的依据
?
微观质量比=
4 : 32 : 36
4g
32g
36g
72g
64g
8g
微观质量比:
实际质量比:
18g
16g
2g
实际质量比
其中:微观质量比=系数×相对分子质量;
实际质量比不用×系数
?
?
?
2H2 + O2 2H2O
(化学方程式计算的依据)
1. 该反应中碳与氧气的质量比________
2. 3g C与10g O2,反应得到CO2质量为_______
3:8
11g
【解析】化学计算必须符合质量比,不能任意进行。
C + O2 CO2
例1.加热分解6.3g高锰酸钾,可以得到多少克氧气?
(1)设未知量
(2)写方程式
(3)标质量比
(相关物质)
(4)列比例式
(5)求解
(6)答
解:设可以得到氧气的质量为x
2×158
32
答:分解6.3g高锰酸钾,可得0.6g氧气。
2KMnO4 K2MnO4 + O2↑+ MnO2
△
6.3g
x
1.已知反应物的质量,求生成物的质量
(微观质量比 = 实际质量比)
二、利用化学方程式的计算
根据化学方程式进行计算的步骤
[解](1)设未知量(不要带单位)
(2)正确写出化学方程式(注意配平)
(3)写出相关物质的相对分子质量和已知量、未知量(写在对应化学式的正下方,先写相对分子质量,一定要注意用相对分子质量乘以化学式前面的系数,再写质量;质量单位要写,且要统一。
(4)列出比例式,求解(计算结果按题中要求进行,若题中没有要求,除不尽,则保留小数点后一位)
(5)简明地写出答案
代入计算的物质必须是参加反应或生成的纯物质的质量。)
8
例2、
燃烧20克氢气,可以得到多少克水?
步骤:
1、设未知量
解:设可以得到水的质量为X。
2、写出完整的化学方程式。
3、写出相关物质的 质量比和 已知量、未知量
20克
4、列比例式、求解
x
X=180克
5、简明地写出答案
答:可以得到180克水。
2H2 + O2 ==== 2 H2O
点燃
4 36
4
20克
x
_____
=
36
_____
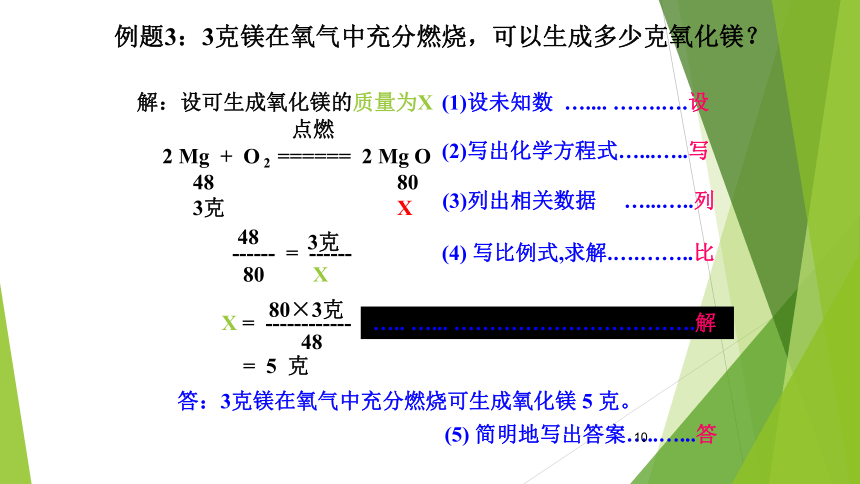
例题3:3克镁在氧气中充分燃烧,可以生成多少克氧化镁?
解:设可生成氧化镁的质量为X
(1)设未知数 ….... …….….设
2 Mg + O 2 ====== 2 Mg O
点燃
48 80
3克 X
(2)写出化学方程式…...…..写
48
------ = ------
80
3克
X
(4) 写比例式,求解.….……..比
X = ------------
80×3克
48
= 5 克
答:3克镁在氧气中充分燃烧可生成氧化镁 5 克。
….. …... …………………………….解
(5) 简明地写出答案…..…...答
(3)列出相关数据 …...…..列
10
现 在 你 会 做 吗 ?
假如你是长征系列火箭推进器的设计师,已知,火箭升空至少要携带100kg的液氢,充分燃烧才能获得足够的量。你会在火箭助燃仓中填充多少千克的液氧来满足这些液氢的完全燃烧?
解:设完全燃烧100Kg液氢所需氧气质量为X
2H2 +O2 点 燃 2H2O
4
32
100Kg
X
4
32
100kg
x
______
=
X=800Kg
答:-------。
______ ______
例4:足量的镁带在标准状况下与11.2升的氧气(密度为1.43g/L) 充分燃烧,可以生成多少克氧化镁?
解:设可生成氧化镁的质量为X
2 Mg + O 2 ====== 2 Mg O
点燃
32 80
16克 X
32
------ = ------
80
16克
X
X = ------------
80×16克
32
= 40 克
答:充分燃烧后可生成氧化镁 40 克。
依题意,可知:
100
56
答:需要碳酸钙的质量为10t。
解:设需要碳酸钙的质量为x
CaCO3 CaO +CO2↑
高温
2.已知生成物的质量求反应物的质量
x
5.6t
例2.工业上,高温煅烧石灰石CaCO3可制得生石灰CaO和二氧化碳。如果要制取5.6 t 氧化钙,需要碳酸钙多少吨?(CaCO3:100,CaO:56)
x=10t
二、利用化学方程式的计算
辨析改错
氢气在氯气中燃烧生成氯化氢(HCl)气体,燃烧100g氢气需要氯气(Cl2)多少克?生成氯化氢气体多少克?
课本:P103练一练
14
有同学这样计算:
15
解:设需要氯气为x,生成氯化氢为y .
H2 + 2Cl 2HCl
2 2×35.5 2×36.5
100 xg yg
“知错便改”
看谁改错多!
点燃
解:设需要氯气的质量为x .
H2 + Cl2 2HCl
2 71
100g x
另解:
16
点燃
简单多了!
根据质量守恒定律
氯化氢的质量为:100g+3550g=3650g
答:需要3550g氯气,生成3650g氯化氢。
解题注意:
17
化学方程要配平,
需将纯量代方程;
关系式对关系量,
计算单位不能忘;
关系量间成比例,
解设比答要牢记。
记住哦!
------- = ---------
练习:15.5克红磷在氧气中充分燃烧,可 生成五氧化二磷多少克
(找出下列所解答案中的错误)
解:设可生成X克五氧化二磷
点燃
P + O 2 ====== P 2 O 5
31 142
15.5 X
31 15.5
142 X
X = --------------
142×15.5
31
= 71
答:可生成五氧化二磷71克.
×
×
×
×
③相对分子(或原子)
质量之和计算错误
⑤计算结果错误且无单位
×
④未注明单位,
未带单位计算
②未配平
×
①设未知数不正确
18
例题:将氯酸钾和二氧化锰的混合物6g放在试管中,加热不再产生气体为止,剩余固体的质量为4.08g问:
(1)反应中制得了多少克氧气?
(2)原混合物中有多少克氯酸钾?
(3)剩余固体中含有哪些物质?各是多少克?
分析:本题中代入计算的物质是什么,它的质量是多少。这是解题的关键。
3.质量差法的计算
二、利用化学方程式的计算
二、利用化学方程式的计算
(2)设原混合物中氯酸钾的质量为x。
245
96
X= 4.9g
X
1.92g
解:
(1)根据质量守恒定律,O2的质量为
KClO3 KCl + O2↑
△
MnO2
2
3
2
245
——
96
=
X
——
1.92g
6g - 4.08g = 1.92g
(3) KClO3 和MnO2
KCl 和MnO2
6克
4.08克
6g - 4.9g = 1.1g
4.08g - 1.1g = 2.98g
20
答:..............................
课堂练习:1、在实验室里加热30g氯酸钾KClO3和二氧化锰的混合物制取氧气,完全反应后剩余固体质量为20.4g.请计算:
(1)则生成氧气的质量为______g。
(2)求原混合物中氯酸钾的质量。
9.6
解:设原混合物中氯酸钾的质量为x
2KClO3 2KCl + 3O2↑
245 96
x 9.6g
答:原混合物中氯酸钾的质量为24.5g
245
x
96
9.6g
=
x=24.5g
二、利用化学方程式的计算
2KClO3 ==== 2KCl + 3O2↑
MnO2
△
2、 将含3克氯酸钾和1克二氧化锰的混合物加热片刻,冷却,称得残余固体的质量为3.04克,根据质量守恒定律可知,生成氧气的质量为多少克?固体残余物中含有什么物质?质量各为多少?
思路:反应中固体物质质量减轻了,原来3克+1克=4克,加热片刻后剩余固体3.04克,固体质量为什么会减轻?减轻了多少?此减轻的是什么物质的质量?
解:
根据题意,加热片刻生成氧气4克-3.04克=0.96克
0.96克
245
96
149
设参加反应的KClO3的质量为X,反应生成KCl的质量为Y
X
Y
245
96
=
0.96克
X
149
96
Y
0.96克
=
X=2.45克
Y=1.49克
∴反应后固体残余物中
剩余KClO3
3克-2.45克=0.55克
生成KCl 1.49克
有MnO2 1克
答:
22
4.字母方程式的计算
【依据】微观质量比=实际质量比
【2017.天津】已知A+3B=2C+3D中,2.3gA跟4.8gB恰好完全反应生成4.4gC,又知D的相对分子质量为18,则A的相对分子质量为( )
A.23 B.46 C.92 D.96
B
【易错】微观质量比=系数×相对分子质量
实际质量(g)不乘系数
二、利用化学方程式的计算
5.反应微观示意图
【2014.北京】甲和乙在一定条件下反应生成丙和丁。结合微观示意图分析,下列结论正确的是( )
A.丙的相对分子质量为24
B.生成的丙和丁的分子个数比为2︰1
C.反应前后分子个数不变
D.发生反应的甲和乙的质量比为22︰3
【解析】将微观示意图转化为化学方程式并配平。
D
氢原子
氧原子
碳原子
二、利用化学方程式的计算
【2014.河南】在点燃条件下,2.6gC2H2与7.2gO2恰好完全反应,生成6.6gCO2、1.8gH2O和xgCO。则x=_____;化学方程式为:________________________________。
6.根据质量比求系数
1.4
4C2H2+9O2 6CO2+4H2O+2CO
解析:质量比=系数×相对分子质量
推导:系数比=
相对分子质量
质量
二、利用化学方程式的计算
CO2
C
×
100%
1、把23克乙醇(俗称酒精)在空气中充分燃烧后,只生成27克水和44克二氧化碳,由此推断乙醇由几种元素组成?
课堂训练
思路:
乙醇中肯定有什么元素?
为什么有?
乙醇中的C元素、H元素的质量是多少?
怎么求?
C:
=
44克×
44
12
12克
=
H:
27克×
=
27克×
18
2
=3克
因为乙醇23克>12克+3克,所以乙醇中还有氧元素
氧元素质量为:
23克 -(12克+3克)
=8克
2H
H2O
100%
×
44克×
26
2.R在O2中完全燃烧消耗9.6gO2 ,生成8.8gCO2和5.4g H2O。
(1)R的质量=________g
(2)R由____________元素组成
(3)CO2和H2O的分子个数比__________
(4)R中C、H原子的个数比___________
(5)R中C、H元素的质量比___________
(6)R的化学式__________
(7)该反应的化学方程式____________________________
C2H5OH+3O2 点燃 3H2O+2CO2
2 : 3
4.6
C、H、O
1 : 3
4 : 1
C2H5OH
3.若2X + 3O2 = 2CO2 + 4H2O,试推断X的化学式 。
2X + 3O2 = 2CO2 + 4H2O
反应后
C:
H:
O:
2个
8个
8个
反应前
O:
6个
2X中:
C:
H:
O:
2个
8个
2个
∴X的化学式为CH4O(或CH3OH)
28
4、在2X + Y2 === 2Z的反应中,X的相对原子质量为24,Y2的相对分子质量为32,Z的相对分子质量是 ( )
A.64 B.56 C.40 D.32
思路:
2X + Y2 === 2Z
2×24
32
?
反应前后有三种物质,已知其中二种物质的质量(或相对质量),求第三种物质的质量(或相对质量)。
用质量守恒定律解题
解:设Z的相对分子质量为X
2×24 + 32 = 2×X
X = 40
C
2X + Y2 === 2Z
2×24
32
2×X
29
1.利用化学方程式计算的依据:
微观质量比=
实际质量比
(1)微观质量比=
(2)实际质量比不用乘系数
2.利用化学方程式计算的步骤:
(1)设、(2)写、 (3)标、(4)列、(5)解、(6)答
系数×相对分子质量;
1.湿法炼铜为我国首创。早在西汉时期,就有从胆矾水溶液中置换出铜的记载,其反应的化学方程式为:Fe+CuSO4=Cu+FeSO4。若采用此法炼制128t铜,需要消耗铁的质量是多少?
答:需要消耗铁的质量为112t
解:设需要消耗铁的质量为x
Fe + CuSO4 = Cu + FeSO4
56 64
x 128t
56
64
=
x
128t
x=112t
2.实验室用氯酸钾和二氧化锰的固体混合物粉末共33.2g加热制取氧气,记录产生氧气的质量与加热时间的关系如图所示请回答下列问题:
(1)t0→t1时段氧气质量为0,其原因是 ;t3→t4时段内剩余国体物质的质量为 g。
(2)请根据图中数据计算原混合物中氯酸钾的质量。
反应吸热需要时间,未达到分解温度
23.6
解:设原混合物中氯酸钾的质量为x
2KClO3 2KCl + 3O2↑
245 96
x 9.6g
答:原混合物中氯酸钾的质量为24.5g
245
x
96
9.6g
=
x=24.5g
第五单元 化学方程式 The chemical equation
5.3 如何正确书写化学方程式
学
习
目
标
Learning objectives
1.
知道化学方程式计算的依据
2.
掌握化学方程式计算的步骤
我爱神舟十号
1、从化学角度看,发射“神舟十号”需要什么?
燃料
2、为了合理利用资源和准确控制火箭,燃料和助燃剂能随意量填充吗?需要做什么?
计算
新课引入
3
如果火箭用氢气作燃料。而你是火箭发动机设计师,火箭助推上升时,燃烧需要氢气200Kg时,你会在火箭助燃剂仓中填充多少氧气使之完全燃烧?800Kg氧气行吗?为什么?
【设问】
该怎么计算呢?
4
一、化学方程式计算的依据
?
微观质量比=
4 : 32 : 36
4g
32g
36g
72g
64g
8g
微观质量比:
实际质量比:
18g
16g
2g
实际质量比
其中:微观质量比=系数×相对分子质量;
实际质量比不用×系数
?
?
?
2H2 + O2 2H2O
(化学方程式计算的依据)
1. 该反应中碳与氧气的质量比________
2. 3g C与10g O2,反应得到CO2质量为_______
3:8
11g
【解析】化学计算必须符合质量比,不能任意进行。
C + O2 CO2
例1.加热分解6.3g高锰酸钾,可以得到多少克氧气?
(1)设未知量
(2)写方程式
(3)标质量比
(相关物质)
(4)列比例式
(5)求解
(6)答
解:设可以得到氧气的质量为x
2×158
32
答:分解6.3g高锰酸钾,可得0.6g氧气。
2KMnO4 K2MnO4 + O2↑+ MnO2
△
6.3g
x
1.已知反应物的质量,求生成物的质量
(微观质量比 = 实际质量比)
二、利用化学方程式的计算
根据化学方程式进行计算的步骤
[解](1)设未知量(不要带单位)
(2)正确写出化学方程式(注意配平)
(3)写出相关物质的相对分子质量和已知量、未知量(写在对应化学式的正下方,先写相对分子质量,一定要注意用相对分子质量乘以化学式前面的系数,再写质量;质量单位要写,且要统一。
(4)列出比例式,求解(计算结果按题中要求进行,若题中没有要求,除不尽,则保留小数点后一位)
(5)简明地写出答案
代入计算的物质必须是参加反应或生成的纯物质的质量。)
8
例2、
燃烧20克氢气,可以得到多少克水?
步骤:
1、设未知量
解:设可以得到水的质量为X。
2、写出完整的化学方程式。
3、写出相关物质的 质量比和 已知量、未知量
20克
4、列比例式、求解
x
X=180克
5、简明地写出答案
答:可以得到180克水。
2H2 + O2 ==== 2 H2O
点燃
4 36
4
20克
x
_____
=
36
_____
例题3:3克镁在氧气中充分燃烧,可以生成多少克氧化镁?
解:设可生成氧化镁的质量为X
(1)设未知数 ….... …….….设
2 Mg + O 2 ====== 2 Mg O
点燃
48 80
3克 X
(2)写出化学方程式…...…..写
48
------ = ------
80
3克
X
(4) 写比例式,求解.….……..比
X = ------------
80×3克
48
= 5 克
答:3克镁在氧气中充分燃烧可生成氧化镁 5 克。
….. …... …………………………….解
(5) 简明地写出答案…..…...答
(3)列出相关数据 …...…..列
10
现 在 你 会 做 吗 ?
假如你是长征系列火箭推进器的设计师,已知,火箭升空至少要携带100kg的液氢,充分燃烧才能获得足够的量。你会在火箭助燃仓中填充多少千克的液氧来满足这些液氢的完全燃烧?
解:设完全燃烧100Kg液氢所需氧气质量为X
2H2 +O2 点 燃 2H2O
4
32
100Kg
X
4
32
100kg
x
______
=
X=800Kg
答:-------。
______ ______
例4:足量的镁带在标准状况下与11.2升的氧气(密度为1.43g/L) 充分燃烧,可以生成多少克氧化镁?
解:设可生成氧化镁的质量为X
2 Mg + O 2 ====== 2 Mg O
点燃
32 80
16克 X
32
------ = ------
80
16克
X
X = ------------
80×16克
32
= 40 克
答:充分燃烧后可生成氧化镁 40 克。
依题意,可知:
100
56
答:需要碳酸钙的质量为10t。
解:设需要碳酸钙的质量为x
CaCO3 CaO +CO2↑
高温
2.已知生成物的质量求反应物的质量
x
5.6t
例2.工业上,高温煅烧石灰石CaCO3可制得生石灰CaO和二氧化碳。如果要制取5.6 t 氧化钙,需要碳酸钙多少吨?(CaCO3:100,CaO:56)
x=10t
二、利用化学方程式的计算
辨析改错
氢气在氯气中燃烧生成氯化氢(HCl)气体,燃烧100g氢气需要氯气(Cl2)多少克?生成氯化氢气体多少克?
课本:P103练一练
14
有同学这样计算:
15
解:设需要氯气为x,生成氯化氢为y .
H2 + 2Cl 2HCl
2 2×35.5 2×36.5
100 xg yg
“知错便改”
看谁改错多!
点燃
解:设需要氯气的质量为x .
H2 + Cl2 2HCl
2 71
100g x
另解:
16
点燃
简单多了!
根据质量守恒定律
氯化氢的质量为:100g+3550g=3650g
答:需要3550g氯气,生成3650g氯化氢。
解题注意:
17
化学方程要配平,
需将纯量代方程;
关系式对关系量,
计算单位不能忘;
关系量间成比例,
解设比答要牢记。
记住哦!
------- = ---------
练习:15.5克红磷在氧气中充分燃烧,可 生成五氧化二磷多少克
(找出下列所解答案中的错误)
解:设可生成X克五氧化二磷
点燃
P + O 2 ====== P 2 O 5
31 142
15.5 X
31 15.5
142 X
X = --------------
142×15.5
31
= 71
答:可生成五氧化二磷71克.
×
×
×
×
③相对分子(或原子)
质量之和计算错误
⑤计算结果错误且无单位
×
④未注明单位,
未带单位计算
②未配平
×
①设未知数不正确
18
例题:将氯酸钾和二氧化锰的混合物6g放在试管中,加热不再产生气体为止,剩余固体的质量为4.08g问:
(1)反应中制得了多少克氧气?
(2)原混合物中有多少克氯酸钾?
(3)剩余固体中含有哪些物质?各是多少克?
分析:本题中代入计算的物质是什么,它的质量是多少。这是解题的关键。
3.质量差法的计算
二、利用化学方程式的计算
二、利用化学方程式的计算
(2)设原混合物中氯酸钾的质量为x。
245
96
X= 4.9g
X
1.92g
解:
(1)根据质量守恒定律,O2的质量为
KClO3 KCl + O2↑
△
MnO2
2
3
2
245
——
96
=
X
——
1.92g
6g - 4.08g = 1.92g
(3) KClO3 和MnO2
KCl 和MnO2
6克
4.08克
6g - 4.9g = 1.1g
4.08g - 1.1g = 2.98g
20
答:..............................
课堂练习:1、在实验室里加热30g氯酸钾KClO3和二氧化锰的混合物制取氧气,完全反应后剩余固体质量为20.4g.请计算:
(1)则生成氧气的质量为______g。
(2)求原混合物中氯酸钾的质量。
9.6
解:设原混合物中氯酸钾的质量为x
2KClO3 2KCl + 3O2↑
245 96
x 9.6g
答:原混合物中氯酸钾的质量为24.5g
245
x
96
9.6g
=
x=24.5g
二、利用化学方程式的计算
2KClO3 ==== 2KCl + 3O2↑
MnO2
△
2、 将含3克氯酸钾和1克二氧化锰的混合物加热片刻,冷却,称得残余固体的质量为3.04克,根据质量守恒定律可知,生成氧气的质量为多少克?固体残余物中含有什么物质?质量各为多少?
思路:反应中固体物质质量减轻了,原来3克+1克=4克,加热片刻后剩余固体3.04克,固体质量为什么会减轻?减轻了多少?此减轻的是什么物质的质量?
解:
根据题意,加热片刻生成氧气4克-3.04克=0.96克
0.96克
245
96
149
设参加反应的KClO3的质量为X,反应生成KCl的质量为Y
X
Y
245
96
=
0.96克
X
149
96
Y
0.96克
=
X=2.45克
Y=1.49克
∴反应后固体残余物中
剩余KClO3
3克-2.45克=0.55克
生成KCl 1.49克
有MnO2 1克
答:
22
4.字母方程式的计算
【依据】微观质量比=实际质量比
【2017.天津】已知A+3B=2C+3D中,2.3gA跟4.8gB恰好完全反应生成4.4gC,又知D的相对分子质量为18,则A的相对分子质量为( )
A.23 B.46 C.92 D.96
B
【易错】微观质量比=系数×相对分子质量
实际质量(g)不乘系数
二、利用化学方程式的计算
5.反应微观示意图
【2014.北京】甲和乙在一定条件下反应生成丙和丁。结合微观示意图分析,下列结论正确的是( )
A.丙的相对分子质量为24
B.生成的丙和丁的分子个数比为2︰1
C.反应前后分子个数不变
D.发生反应的甲和乙的质量比为22︰3
【解析】将微观示意图转化为化学方程式并配平。
D
氢原子
氧原子
碳原子
二、利用化学方程式的计算
【2014.河南】在点燃条件下,2.6gC2H2与7.2gO2恰好完全反应,生成6.6gCO2、1.8gH2O和xgCO。则x=_____;化学方程式为:________________________________。
6.根据质量比求系数
1.4
4C2H2+9O2 6CO2+4H2O+2CO
解析:质量比=系数×相对分子质量
推导:系数比=
相对分子质量
质量
二、利用化学方程式的计算
CO2
C
×
100%
1、把23克乙醇(俗称酒精)在空气中充分燃烧后,只生成27克水和44克二氧化碳,由此推断乙醇由几种元素组成?
课堂训练
思路:
乙醇中肯定有什么元素?
为什么有?
乙醇中的C元素、H元素的质量是多少?
怎么求?
C:
=
44克×
44
12
12克
=
H:
27克×
=
27克×
18
2
=3克
因为乙醇23克>12克+3克,所以乙醇中还有氧元素
氧元素质量为:
23克 -(12克+3克)
=8克
2H
H2O
100%
×
44克×
26
2.R在O2中完全燃烧消耗9.6gO2 ,生成8.8gCO2和5.4g H2O。
(1)R的质量=________g
(2)R由____________元素组成
(3)CO2和H2O的分子个数比__________
(4)R中C、H原子的个数比___________
(5)R中C、H元素的质量比___________
(6)R的化学式__________
(7)该反应的化学方程式____________________________
C2H5OH+3O2 点燃 3H2O+2CO2
2 : 3
4.6
C、H、O
1 : 3
4 : 1
C2H5OH
3.若2X + 3O2 = 2CO2 + 4H2O,试推断X的化学式 。
2X + 3O2 = 2CO2 + 4H2O
反应后
C:
H:
O:
2个
8个
8个
反应前
O:
6个
2X中:
C:
H:
O:
2个
8个
2个
∴X的化学式为CH4O(或CH3OH)
28
4、在2X + Y2 === 2Z的反应中,X的相对原子质量为24,Y2的相对分子质量为32,Z的相对分子质量是 ( )
A.64 B.56 C.40 D.32
思路:
2X + Y2 === 2Z
2×24
32
?
反应前后有三种物质,已知其中二种物质的质量(或相对质量),求第三种物质的质量(或相对质量)。
用质量守恒定律解题
解:设Z的相对分子质量为X
2×24 + 32 = 2×X
X = 40
C
2X + Y2 === 2Z
2×24
32
2×X
29
1.利用化学方程式计算的依据:
微观质量比=
实际质量比
(1)微观质量比=
(2)实际质量比不用乘系数
2.利用化学方程式计算的步骤:
(1)设、(2)写、 (3)标、(4)列、(5)解、(6)答
系数×相对分子质量;
1.湿法炼铜为我国首创。早在西汉时期,就有从胆矾水溶液中置换出铜的记载,其反应的化学方程式为:Fe+CuSO4=Cu+FeSO4。若采用此法炼制128t铜,需要消耗铁的质量是多少?
答:需要消耗铁的质量为112t
解:设需要消耗铁的质量为x
Fe + CuSO4 = Cu + FeSO4
56 64
x 128t
56
64
=
x
128t
x=112t
2.实验室用氯酸钾和二氧化锰的固体混合物粉末共33.2g加热制取氧气,记录产生氧气的质量与加热时间的关系如图所示请回答下列问题:
(1)t0→t1时段氧气质量为0,其原因是 ;t3→t4时段内剩余国体物质的质量为 g。
(2)请根据图中数据计算原混合物中氯酸钾的质量。
反应吸热需要时间,未达到分解温度
23.6
解:设原混合物中氯酸钾的质量为x
2KClO3 2KCl + 3O2↑
245 96
x 9.6g
答:原混合物中氯酸钾的质量为24.5g
245
x
96
9.6g
=
x=24.5g
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
