第三单元课题2原子的结构(2课时)课件-2022-2023学年九年级化学人教版上册(共32张PPT)
文档属性
| 名称 | 第三单元课题2原子的结构(2课时)课件-2022-2023学年九年级化学人教版上册(共32张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-21 09:52:07 | ||
图片预览








文档简介
(共32张PPT)
课前抢读
1.反应类型:分解反应
化合反应
氧化反应
2.变化类型:物理变化
化学变化
3.从微观角度解释化学反应实质:
化学变化中,分子分裂成原子,原子重新组合成分子。
4.分子和原子的本质区别:
化学变化中,分子可再分,原子不可再分
5.注意:分子原子性质只能解释微观(肉眼看不到的)
课前抢读
2.(1)a、c---烧杯内的水倒流进左瓶中;红磷消耗氧气生成固体,装置中压强减小。
(2)b、c---没有明显变化;木炭消耗氧气生成二氧化碳,装置中压强不变。
(3)a、b,c---烧杯内的水倒流进两瓶中;总体消耗氧气,装置中压强减小。
实验中水的作用:
(1)测定空气中氧气含量:
集气瓶中:降温;吸收五氧化二磷
烧杯中:通过观察水的体积变化得知氧气的体积
(4)排水法收集气体
①水先将集气瓶内的空气排净,②便于观察气体何时收集满
高锰酸钾当催化剂放进氯酸钾内,其结果与只放氯酸钾相比---反应速率加快,产生的氧气增多
课前抢读
1,氧气和液氧都是由氧分子构成的。
氧气可压缩为液氧,说明氧分之间有间隔
空气中氧气无处不在,是氧分子运动的结果。
2,氧化汞受热分解时,氧化汞分子会分解成汞原子和氧原子,每两个氧原子结合成一个氧分子,许多汞原子聚集成金属汞。
3,氨气 + 氯化氢 氯化铵
课题2 原子的结构(1)
导:
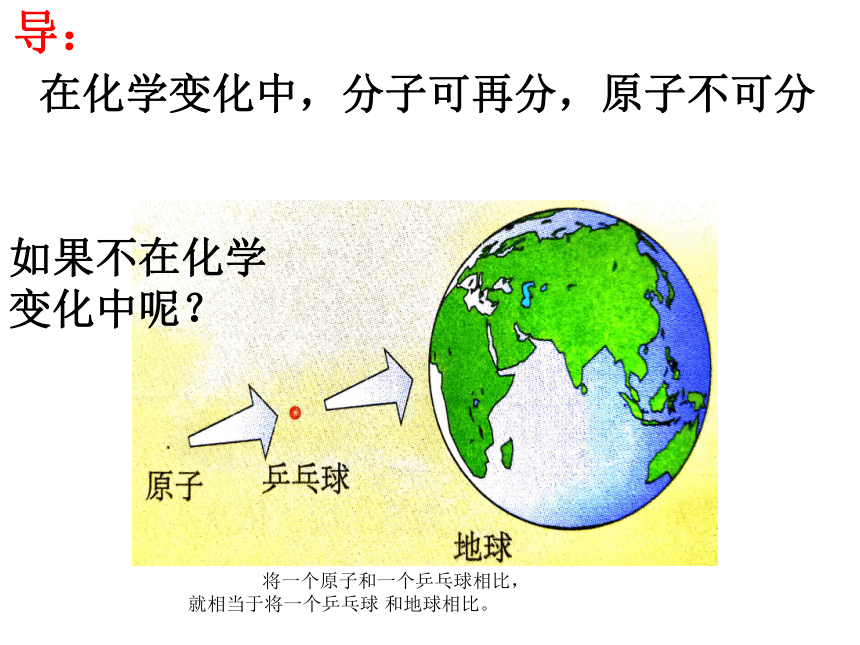
在化学变化中,分子可再分,原子不可分
如果不在化学变化中呢?
将一个原子和一个乒乓球相比,
就相当于将一个乒乓球 和地球相比。
议:
对议:(互相检查背诵)(1.5分钟)
原子的构成及构成微粒的电性和数量关系
组议:(5.5分钟)
1.课本58页2(1)(2)
2.课本58页3
3.19、20号原子的原子结构示意图
4.组议探究未知中的个人疑惑。
组长把控时间并做好记录
展:
大胆展示 我最棒
要求:声音洪亮,表达清晰,面向大多数同学
我提问
我回答
我表述
我质疑
我补充
展:
要求:声音洪亮,表达清晰
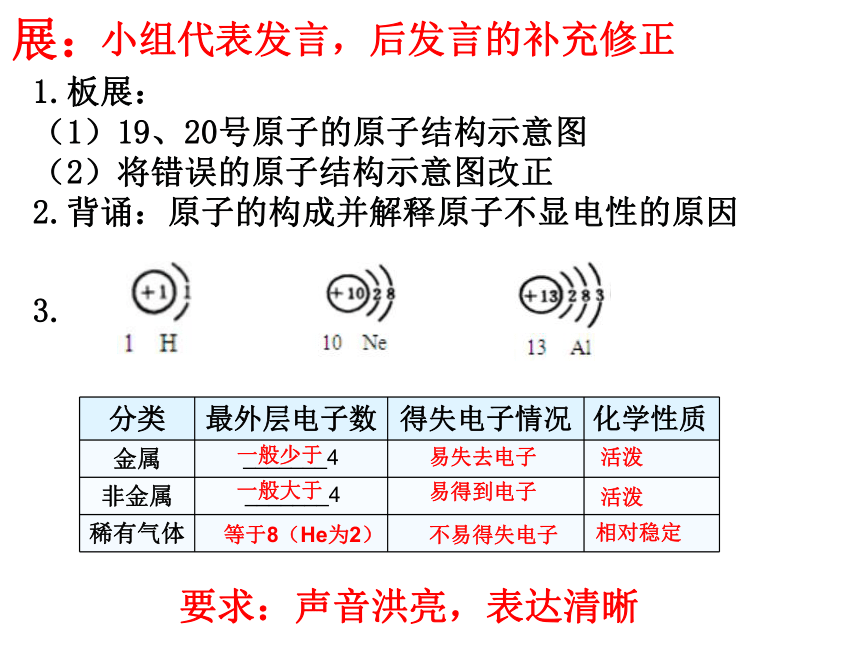
1.板展:
(1)19、20号原子的原子结构示意图
(2)将错误的原子结构示意图改正
2.背诵:原子的构成并解释原子不显电性的原因
小组代表发言,后发言的补充修正
分类 最外层电子数 得失电子情况 化学性质
金属 _______4
非金属 _______4
稀有气体
一般少于
一般大于
等于8(He为2)
易失去电子
不易得失电子
易得到电子
活泼
活泼
相对稳定
3.
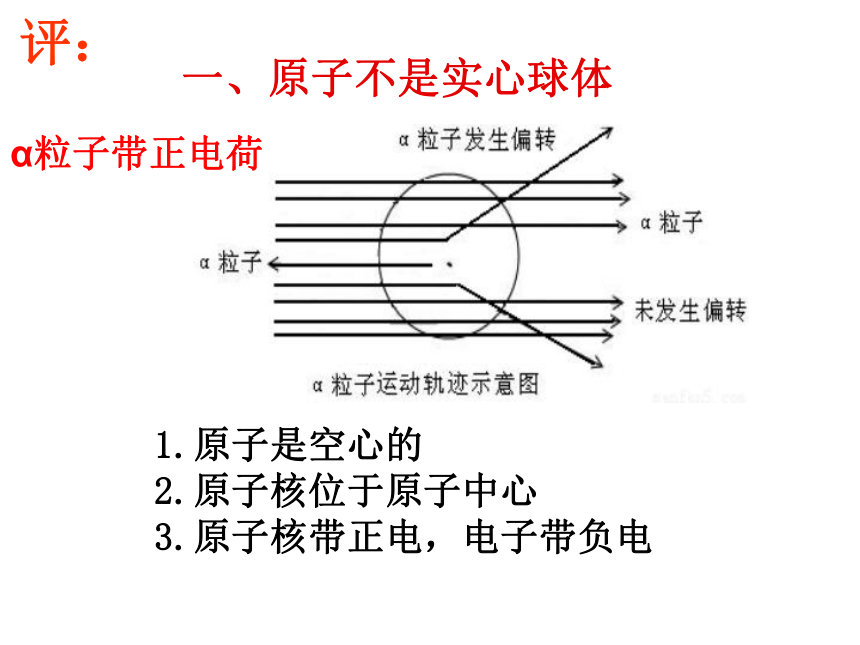
一、原子不是实心球体
评:
1.原子是空心的
2.原子核位于原子中心
3.原子核带正电,电子带负电
α粒子带正电荷
二、原子的构成
评:
核电荷数=质子数=核外电子数
核电荷数
不是所有原子中都存在中子,但一定存在质子和核外电子
氢
原子核所带的正电荷数
评:
三、原子核外电子排布
1.排布特点:
(1)分层排布
(2)先里后外(第一层2个,第二层不超过8个,最外层不超过8个)
(3)电子层:1 2 3 4 5 6 7
离核:近 远
能量:低 高
(4)电子的运动特点:高速运动,分层运动
原子结构示意图各部分含义?
三、原子核外电子排布
评:
2.最外层电子数与化学性质的关系
(1)达到相对稳定结构的原子最外层电子数不一定是8。
(2)最外层电子数小于4的原子不一定是金属原子。
(3)最外层电子数相同的原子,化学性质不一定相似。
(4)最外层电子数不同的原子,化学性质可能相似。
分类 最外层电子数 得失电子情况 化学性质
金属 _______4
非金属 _______4
稀有气体
一般少于
一般大于
等于8(He为2)
易失去电子
不易得失电子
易得到电子
不稳定
不稳定
相对稳定
评:
评小结:
1、原子的构成
2、核外电子的排布及原子各部分的含义
检:
(1)原子类别?
(2)最外层电子数?
(3)得失电子情况?
(4)化学性质?
金属原子
小于4
不稳定
易失去电子
1.物质的变化和性质
2.蜡烛及其燃烧的探究,对吸入空气和呼出气体的探究
3.仪器名称,用途及注意事项。
4.固体、液体药品的取用方法,量筒、天平的误差分析
5.给物质加热,仪器装置的连接,检查装置气密性(注射器)
6.玻璃仪器的洗涤。
课前抢读
1,氧气和液氧都是由氧分子构成的。
氧气可压缩为液氧,说明氧分之间有间隔
空气中氧气无处不在,是氧分子运动的结果。
2,氧化汞受热分解时,氧化汞分子会分解成汞原子和氧原子,每两个氧原子结合成一个氧分子,许多汞原子聚集成金属汞。
3,氨气 + 氯化氢 氯化铵
+11 2 8 1
钠Na
+12 2 8 2
镁Mg
+17 2 8 7
氯Cl
+8 2 6
氧O
+10 2 8
氖Ne
+1 1
氢H
+3 2 1
锂Li
+4 2 2
铍Be
+5 2 3
硼B
+6 2 4
碳C
+7 2 5
氮N
+9 2 7
氟F
+13 2 8 3
铝Al
+14 2 8 4
硅Si
+15 2 8 5
磷P
+16 2 8 6
硫S
+18 2 8 8
氩Ar
上面的元素中,哪些是稀有气体元素?
哪些是金属元素?哪些是非金属元素?
其最外层电子数有何特点?
+2 2
氦 He
课前抢读
+19 2 8 8 1
钾K
+20 2 8 8 2
钙Ca
课前抢读
1,原子不显电性的原因:
原子核内质子所带电荷与核外电子的电荷数量相等,电性相反。
2,所有的溶液都是混合物。
3,一个氧原子是由2个氧原子构成的,则氧原子内含有的质子数是16.
4,氧原子核内的8是核电荷数。
5,干冰升华-----粒子总是在不断的运动,粒子间存在间隔。
多功能集气瓶:
将带火星的小木条放在B处,若复燃,则已满
课题2 原子的结构(2)
2
1
8
+11
失去1个电子
+11
2
8
钠原子(Na)
?
2
7
8
+17
得到1个电子
2
8
8
+17
氯原子(Cl )
带正电
带负电
导:
+11 2 8 1
+17 2 8 7
钠原子Na
氯原子Cl
+11 2 8
+17 2 8 8
钠离子Na+
氯离子Cl-
?
导:
议:
组议:(7分钟)
1.总结原子、阴离子、阳离子的关系。(1.5分钟)
2.假设某原子实际质量为m,碳原子实际质量为n,则该原子的相对原子质量为?(1.5分钟)
3.课本58页第5题。(2分钟)
4.组议探究未知中的个人疑惑。(2分钟)
组长把控时间并做好记录
展:
大胆展示 我最棒
要求:声音洪亮,表达清晰,面向大多数同学
我提问
我回答
我表述
我质疑
我补充
展:
要求:声音洪亮,表达清晰
1.口述:Na+、Cl-的含义。
Mg2+、S2-的含义。
2.板展:假设某原子实际质量为m,碳原子实际质量为n,则该原子的相对原子质量为?
3.口述:相对原子质量的近似计算。
4.判断并解释:依据对相对原子质量的理解,判断下列说法:
(1)相对原子质量就是原子的实际质量
(2)相对原子质量是原子质量与碳12原子质量的比值
(3)原子的实际质量越大,相对原子质量就越大
(4)相对原子质量是一个比值,单位为“g”
小组代表发言,后发言的补充修正
一、离子的形成
评:
1.定义:
2.形成过程:H、Al、F
3.分类
4.含义
5.与原子的区别与联系(得失电子、所带电性、电子层数、稳定性、结构等方面)
二、离子与原子的区别与联系
评:
粒子 原子 阳离子 阴离子
区别 电子层数 比原子少一层 相同
结构特点 质子数=核外电子数 质子数>核外电子数 质子数<核外电子数
带电情况 不带电 带正电 带负电
稳定性 较活泼 相对稳定 相对稳定
质量 几乎相等(电子质量很小)
表示方法 Na、Cl Na+、Mg2+ Cl-、S2-
联系
少
评:
三、阴离子、阳离子、原子
+10 2 8
+8 2 8
+12 2 8
+9 2 7
(1)属于原子的是?阳离子是?阴离子是?
(2)化学性质相对稳定的是?
(3)容易得电子的是?
(4)属于金属原子的是?
A B C D
评:
1.定义: 2.单位:1 3.是一个比值
4.计算公式:
某原子的相对原子质量=
5.近似值:
相对原子质量≈质子数+中子数
6.应用已知用于核电工业的一种铀原子中含有92个电子和143个中子。有关该原子的说法正确的是( D )
A.质子数为143 B.质子数为51
C.核电荷数为235 D.相对原子质量为235
三、相对原子质量
实际质量
评:
四、
1.A原子的核电荷数为8,A2-核外电子数为
10
2.B3+与A2-的核外电子排布相同,则B3+的核电荷数为?
13
3.若B的相对原子质量为27,则B3+的中子数为?
14
评小结:
1、离子符号、书写及含义
2、相对原子质量
检:
叙述Na+、Ca2+的含义。
Na+:
表示1个钠离子带1个单位正电荷
Ca2+:
表示1个钙离子带2个单位正电荷
H+ He
Li+ Be2+ N3- O2- F- Ne
Na+ Mg2+ Al3+ P3- S2- Cl- Ar
课前抢读
1.反应类型:分解反应
化合反应
氧化反应
2.变化类型:物理变化
化学变化
3.从微观角度解释化学反应实质:
化学变化中,分子分裂成原子,原子重新组合成分子。
4.分子和原子的本质区别:
化学变化中,分子可再分,原子不可再分
5.注意:分子原子性质只能解释微观(肉眼看不到的)
课前抢读
2.(1)a、c---烧杯内的水倒流进左瓶中;红磷消耗氧气生成固体,装置中压强减小。
(2)b、c---没有明显变化;木炭消耗氧气生成二氧化碳,装置中压强不变。
(3)a、b,c---烧杯内的水倒流进两瓶中;总体消耗氧气,装置中压强减小。
实验中水的作用:
(1)测定空气中氧气含量:
集气瓶中:降温;吸收五氧化二磷
烧杯中:通过观察水的体积变化得知氧气的体积
(4)排水法收集气体
①水先将集气瓶内的空气排净,②便于观察气体何时收集满
高锰酸钾当催化剂放进氯酸钾内,其结果与只放氯酸钾相比---反应速率加快,产生的氧气增多
课前抢读
1,氧气和液氧都是由氧分子构成的。
氧气可压缩为液氧,说明氧分之间有间隔
空气中氧气无处不在,是氧分子运动的结果。
2,氧化汞受热分解时,氧化汞分子会分解成汞原子和氧原子,每两个氧原子结合成一个氧分子,许多汞原子聚集成金属汞。
3,氨气 + 氯化氢 氯化铵
课题2 原子的结构(1)
导:
在化学变化中,分子可再分,原子不可分
如果不在化学变化中呢?
将一个原子和一个乒乓球相比,
就相当于将一个乒乓球 和地球相比。
议:
对议:(互相检查背诵)(1.5分钟)
原子的构成及构成微粒的电性和数量关系
组议:(5.5分钟)
1.课本58页2(1)(2)
2.课本58页3
3.19、20号原子的原子结构示意图
4.组议探究未知中的个人疑惑。
组长把控时间并做好记录
展:
大胆展示 我最棒
要求:声音洪亮,表达清晰,面向大多数同学
我提问
我回答
我表述
我质疑
我补充
展:
要求:声音洪亮,表达清晰
1.板展:
(1)19、20号原子的原子结构示意图
(2)将错误的原子结构示意图改正
2.背诵:原子的构成并解释原子不显电性的原因
小组代表发言,后发言的补充修正
分类 最外层电子数 得失电子情况 化学性质
金属 _______4
非金属 _______4
稀有气体
一般少于
一般大于
等于8(He为2)
易失去电子
不易得失电子
易得到电子
活泼
活泼
相对稳定
3.
一、原子不是实心球体
评:
1.原子是空心的
2.原子核位于原子中心
3.原子核带正电,电子带负电
α粒子带正电荷
二、原子的构成
评:
核电荷数=质子数=核外电子数
核电荷数
不是所有原子中都存在中子,但一定存在质子和核外电子
氢
原子核所带的正电荷数
评:
三、原子核外电子排布
1.排布特点:
(1)分层排布
(2)先里后外(第一层2个,第二层不超过8个,最外层不超过8个)
(3)电子层:1 2 3 4 5 6 7
离核:近 远
能量:低 高
(4)电子的运动特点:高速运动,分层运动
原子结构示意图各部分含义?
三、原子核外电子排布
评:
2.最外层电子数与化学性质的关系
(1)达到相对稳定结构的原子最外层电子数不一定是8。
(2)最外层电子数小于4的原子不一定是金属原子。
(3)最外层电子数相同的原子,化学性质不一定相似。
(4)最外层电子数不同的原子,化学性质可能相似。
分类 最外层电子数 得失电子情况 化学性质
金属 _______4
非金属 _______4
稀有气体
一般少于
一般大于
等于8(He为2)
易失去电子
不易得失电子
易得到电子
不稳定
不稳定
相对稳定
评:
评小结:
1、原子的构成
2、核外电子的排布及原子各部分的含义
检:
(1)原子类别?
(2)最外层电子数?
(3)得失电子情况?
(4)化学性质?
金属原子
小于4
不稳定
易失去电子
1.物质的变化和性质
2.蜡烛及其燃烧的探究,对吸入空气和呼出气体的探究
3.仪器名称,用途及注意事项。
4.固体、液体药品的取用方法,量筒、天平的误差分析
5.给物质加热,仪器装置的连接,检查装置气密性(注射器)
6.玻璃仪器的洗涤。
课前抢读
1,氧气和液氧都是由氧分子构成的。
氧气可压缩为液氧,说明氧分之间有间隔
空气中氧气无处不在,是氧分子运动的结果。
2,氧化汞受热分解时,氧化汞分子会分解成汞原子和氧原子,每两个氧原子结合成一个氧分子,许多汞原子聚集成金属汞。
3,氨气 + 氯化氢 氯化铵
+11 2 8 1
钠Na
+12 2 8 2
镁Mg
+17 2 8 7
氯Cl
+8 2 6
氧O
+10 2 8
氖Ne
+1 1
氢H
+3 2 1
锂Li
+4 2 2
铍Be
+5 2 3
硼B
+6 2 4
碳C
+7 2 5
氮N
+9 2 7
氟F
+13 2 8 3
铝Al
+14 2 8 4
硅Si
+15 2 8 5
磷P
+16 2 8 6
硫S
+18 2 8 8
氩Ar
上面的元素中,哪些是稀有气体元素?
哪些是金属元素?哪些是非金属元素?
其最外层电子数有何特点?
+2 2
氦 He
课前抢读
+19 2 8 8 1
钾K
+20 2 8 8 2
钙Ca
课前抢读
1,原子不显电性的原因:
原子核内质子所带电荷与核外电子的电荷数量相等,电性相反。
2,所有的溶液都是混合物。
3,一个氧原子是由2个氧原子构成的,则氧原子内含有的质子数是16.
4,氧原子核内的8是核电荷数。
5,干冰升华-----粒子总是在不断的运动,粒子间存在间隔。
多功能集气瓶:
将带火星的小木条放在B处,若复燃,则已满
课题2 原子的结构(2)
2
1
8
+11
失去1个电子
+11
2
8
钠原子(Na)
?
2
7
8
+17
得到1个电子
2
8
8
+17
氯原子(Cl )
带正电
带负电
导:
+11 2 8 1
+17 2 8 7
钠原子Na
氯原子Cl
+11 2 8
+17 2 8 8
钠离子Na+
氯离子Cl-
?
导:
议:
组议:(7分钟)
1.总结原子、阴离子、阳离子的关系。(1.5分钟)
2.假设某原子实际质量为m,碳原子实际质量为n,则该原子的相对原子质量为?(1.5分钟)
3.课本58页第5题。(2分钟)
4.组议探究未知中的个人疑惑。(2分钟)
组长把控时间并做好记录
展:
大胆展示 我最棒
要求:声音洪亮,表达清晰,面向大多数同学
我提问
我回答
我表述
我质疑
我补充
展:
要求:声音洪亮,表达清晰
1.口述:Na+、Cl-的含义。
Mg2+、S2-的含义。
2.板展:假设某原子实际质量为m,碳原子实际质量为n,则该原子的相对原子质量为?
3.口述:相对原子质量的近似计算。
4.判断并解释:依据对相对原子质量的理解,判断下列说法:
(1)相对原子质量就是原子的实际质量
(2)相对原子质量是原子质量与碳12原子质量的比值
(3)原子的实际质量越大,相对原子质量就越大
(4)相对原子质量是一个比值,单位为“g”
小组代表发言,后发言的补充修正
一、离子的形成
评:
1.定义:
2.形成过程:H、Al、F
3.分类
4.含义
5.与原子的区别与联系(得失电子、所带电性、电子层数、稳定性、结构等方面)
二、离子与原子的区别与联系
评:
粒子 原子 阳离子 阴离子
区别 电子层数 比原子少一层 相同
结构特点 质子数=核外电子数 质子数>核外电子数 质子数<核外电子数
带电情况 不带电 带正电 带负电
稳定性 较活泼 相对稳定 相对稳定
质量 几乎相等(电子质量很小)
表示方法 Na、Cl Na+、Mg2+ Cl-、S2-
联系
少
评:
三、阴离子、阳离子、原子
+10 2 8
+8 2 8
+12 2 8
+9 2 7
(1)属于原子的是?阳离子是?阴离子是?
(2)化学性质相对稳定的是?
(3)容易得电子的是?
(4)属于金属原子的是?
A B C D
评:
1.定义: 2.单位:1 3.是一个比值
4.计算公式:
某原子的相对原子质量=
5.近似值:
相对原子质量≈质子数+中子数
6.应用已知用于核电工业的一种铀原子中含有92个电子和143个中子。有关该原子的说法正确的是( D )
A.质子数为143 B.质子数为51
C.核电荷数为235 D.相对原子质量为235
三、相对原子质量
实际质量
评:
四、
1.A原子的核电荷数为8,A2-核外电子数为
10
2.B3+与A2-的核外电子排布相同,则B3+的核电荷数为?
13
3.若B的相对原子质量为27,则B3+的中子数为?
14
评小结:
1、离子符号、书写及含义
2、相对原子质量
检:
叙述Na+、Ca2+的含义。
Na+:
表示1个钠离子带1个单位正电荷
Ca2+:
表示1个钙离子带2个单位正电荷
H+ He
Li+ Be2+ N3- O2- F- Ne
Na+ Mg2+ Al3+ P3- S2- Cl- Ar
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
