化学人教版(2019)必修第一册1.2.2 离子反应及其表示法(共19张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.2.2 离子反应及其表示法(共19张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 860.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-21 15:41:14 | ||
图片预览





文档简介
(共18张PPT)
必修第一册
第一章 物质及其变化
第二节 离子反应
第2课时 离子反应及其表示法
PART
01
PART
02
PART
03
通过实验事实认识离子反应
核心素养发展目标
掌握离子方程式的书写方法及正误判断
掌握离子反应发生的条件
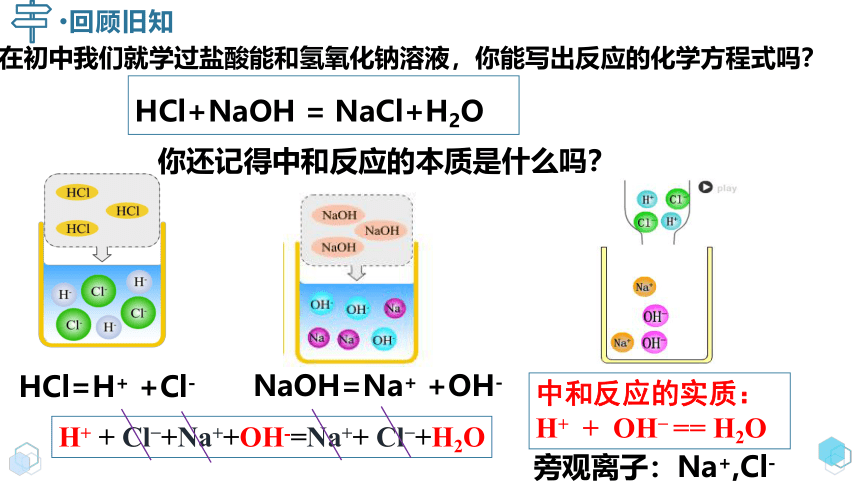
在初中我们就学过盐酸能和氢氧化钠溶液,你能写出反应的化学方程式吗?
回顾旧知
HCl+NaOH = NaCl+H2O
你还记得中和反应的本质是什么吗?
HCl=H+ +Cl-
NaOH=Na+ +OH-
H+ + Cl +Na++OH-=Na++ Cl +H2O
中和反应的实质:
H+ + OH == H2O
旁观离子:Na+,Cl-
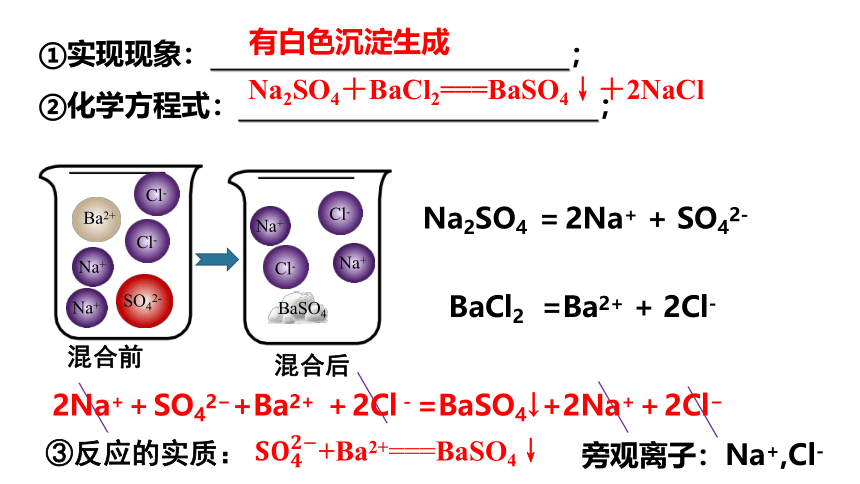
【探究活动1】探究离子反应的实
【实验1-3】
向盛有2 mL的Na2SO4溶液的试管中加入2 mL的BaCl2溶液
新课讲授
混合后
混合前
①实现现象: ;
②化学方程式: ;
有白色沉淀生成
Na2SO4+BaCl2===BaSO4↓+2NaCl
SO42-
Na+
Na+
Cl-
Ba2+
Cl-
Na+
Na+
Cl-
Cl-
BaSO4
③反应的实质:
旁观离子:Na+,Cl-
+Ba2+BaSO4↓
Na2SO4 = 2Na+ + SO42-
BaCl2 =Ba2+ + 2Cl-
2Na++SO42 +Ba2+ +2Cl-=BaSO4↓+2Na++2Cl
2、离子方程式:
用实际参加反应的 来表示反应的式子。
1、离子反应:
电解质在溶液中的反应实质上是 之间的反应,
离子符号
离子
(在溶液中,有离子参加或生成的反应)
3、离子反应 发生的条件: 。
弱电解质、气体、沉淀
一、 离子方程式的书写步骤
写
拆
CaCO3 + 2HCl =CaCl2 + CO2↑ + H2O
根据客观事实写出反应的化学方程式
(以碳酸钙和盐酸的反应为例)
怎样拆?
可拆成离子形式的物质
(1)强酸:HCl、HNO3、H2SO4
(2)强碱:NaOH、KOH、Ba(OH)2
(3)可溶性盐:钾盐、钠盐、铵盐、硝酸盐等
(1)难溶物
(2)弱电解质
(5)氧化物
(4)单质
(3)气体
CaCO3、BaSO4、Cu(OH)2等
弱酸、弱碱、水等
CO2、H2、SO2等
H2、Na等
Na2O、Fe2O3等
不可拆成离子形式的物质
删
查
CaCO3 + 2H+ + 2Cl- = Ca2+ + 2Cl- + CO2 ↑ + H2O
CaCO3 + 2H+ = Ca2++CO2 ↑ + H2O
检查方程式两边各元素的原子个数和电荷总数是否相等
小结写拆删查
1、多元弱酸的酸式盐的酸根离子在离子方程式中不能拆开写,如NaHCO3溶液中,不能拆成H+ 和 。
2、对微溶物,如Ca(OH)2,如果是反应物且为澄清石灰水,应拆成Ca2+和OH-的形式,如果是生成物或是石灰乳等,则保留化学式Ca(OH)2。
易错提醒
1.书写下列反应的离子方程式
(1)氧化镁溶于稀盐酸。
(2)用碳酸钙与稀盐酸反应制备二氧化碳。
(3)铁与稀硫酸反应生成氢气。
(4)二氧化碳与澄清石灰水反应生成沉淀。
(5)氢氧化铜溶于稀硫酸。
MgO+2H+ = Mg2++H2O
CaCO3+2H+ = Ca2++CO2↑+H2O
Fe+2H+ = Fe2++H2↑
Ca2++2OH-+CO2 = CaCO3↓+H2O
Cu(OH)2+2H+ = Cu2++2H2O
1.看离子方程式是否符合客观事实。
例如:(1)离子方程式:Cu+2H+=Cu2++H2↑
(2)离子方程式:2Fe+6H+=2Fe3++3H2↑
不存在
错误
二、判断离子方程式是否正确(6看)
2.看离子方程式是否遵循两个守恒定律(质量守恒和电荷守恒)。
例如:(1)离子方程式:Al+3H+=Al3++H2↑
错误
Fe+2H+=Fe2++H2↑
2Al+6H+=2Al3++3H2↑
(2)离子方程式:Al+Cu2+= Al3++Cu
错误
2Al+3Cu2+=2Al3++3Cu
3.看是否符合拆写原则
例如:化学反应:2HCl+BaCO3=BaCl2+H2O+CO2↑
离子方程式: 2H++CO32-=H2O+CO2↑
错误
把强酸、强碱、可溶性盐拆成离子形式,
弱酸、弱碱、水、难溶的物质、气体、单质、氧化物均写化学式。
2H++BaCO3=Ba2++H2O+CO2↑
4.看化学计量数是否是最简。
例如:硫酸溶液和氢氧化钠溶液反应。
离子方程式:2H++2OH-=2H2O
错误
H++OH-=H2O
例如:Na2CO3+2HCl=2NaCl+H2O+CO2↑
离子方程式:CO32-+2H+=H2O+CO2
错误
5.看是否漏写某些符号
CO32-+2H+=H2O+CO2↑
“↑”“↓”“=”等符号是否使用得当
6.看是否漏掉离子反应
例如:CuSO4与Ba(OH)2溶液反应:
离子方程式:Ba2++SO42- = BaSO4↓
错误
Ba2++SO42-+Cu2++2OH-=BaSO4↓+Cu(OH)2↓
(1)看物质间反应是否符合反应的客观事实;
(2)看物质拆写是否正确;
(3)看是否符合原子守恒和电荷守恒;
(4)看化学计量数是否是最简;
(5)看是否漏写某些符号
(6)看是否漏掉离子反应
一、 离子方程式的书写步骤
二、离子方程式的正误判断
写、拆、删、查
【课堂小结】
1、将下面的化学方程式改为离子方程式:
(1)SO2 + Cl2 + 2H2O = H2SO4 + 2HCl
(2)3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
SO2 + Cl2 + 2H2O = 2H+ + SO42- + 2Cl- + 2H+
3Cu + 8H+ + 8NO3- = 3Cu2+ + 6NO3- + 2NO↑ + 4H2O
SO2 + Cl2 + 2H2O = 4H+ + SO42- + 2Cl-
3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑ + 4H2O
同步练习
2、下列离子方程式,书写正确的是( )
A、盐酸与碳酸钡反应: CO32-+2H+=CO2↑+H2O
B、硫酸铜溶液与氢氧化钡溶液:
Ba2++2OH-+Cu2++SO42-=BaSO4↓+Cu(OH)2↓
C、硝酸银溶液中加入铜粉: Ag++Cu=Cu2++Ag
D、铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B
3、下列离子方程式正确的是( )
A.Na2CO3和醋酸反应:2H+ +CO32-=H2O+CO2↑
B.Ba(OH)2和CuSO4溶液反应:Ba2++ SO42-= BaSO4↓
C、稀HCl和NH3·H2O反应:H++OH-= H2O
D、CaCO3和HCl 溶液反应:
CaCO3 + 2H+ = H2O + CO2↑ + Ca2+
D
谢谢观看
必修第一册
第一章 物质及其变化
第二节 离子反应
第2课时 离子反应及其表示法
PART
01
PART
02
PART
03
通过实验事实认识离子反应
核心素养发展目标
掌握离子方程式的书写方法及正误判断
掌握离子反应发生的条件
在初中我们就学过盐酸能和氢氧化钠溶液,你能写出反应的化学方程式吗?
回顾旧知
HCl+NaOH = NaCl+H2O
你还记得中和反应的本质是什么吗?
HCl=H+ +Cl-
NaOH=Na+ +OH-
H+ + Cl +Na++OH-=Na++ Cl +H2O
中和反应的实质:
H+ + OH == H2O
旁观离子:Na+,Cl-
【探究活动1】探究离子反应的实
【实验1-3】
向盛有2 mL的Na2SO4溶液的试管中加入2 mL的BaCl2溶液
新课讲授
混合后
混合前
①实现现象: ;
②化学方程式: ;
有白色沉淀生成
Na2SO4+BaCl2===BaSO4↓+2NaCl
SO42-
Na+
Na+
Cl-
Ba2+
Cl-
Na+
Na+
Cl-
Cl-
BaSO4
③反应的实质:
旁观离子:Na+,Cl-
+Ba2+BaSO4↓
Na2SO4 = 2Na+ + SO42-
BaCl2 =Ba2+ + 2Cl-
2Na++SO42 +Ba2+ +2Cl-=BaSO4↓+2Na++2Cl
2、离子方程式:
用实际参加反应的 来表示反应的式子。
1、离子反应:
电解质在溶液中的反应实质上是 之间的反应,
离子符号
离子
(在溶液中,有离子参加或生成的反应)
3、离子反应 发生的条件: 。
弱电解质、气体、沉淀
一、 离子方程式的书写步骤
写
拆
CaCO3 + 2HCl =CaCl2 + CO2↑ + H2O
根据客观事实写出反应的化学方程式
(以碳酸钙和盐酸的反应为例)
怎样拆?
可拆成离子形式的物质
(1)强酸:HCl、HNO3、H2SO4
(2)强碱:NaOH、KOH、Ba(OH)2
(3)可溶性盐:钾盐、钠盐、铵盐、硝酸盐等
(1)难溶物
(2)弱电解质
(5)氧化物
(4)单质
(3)气体
CaCO3、BaSO4、Cu(OH)2等
弱酸、弱碱、水等
CO2、H2、SO2等
H2、Na等
Na2O、Fe2O3等
不可拆成离子形式的物质
删
查
CaCO3 + 2H+ + 2Cl- = Ca2+ + 2Cl- + CO2 ↑ + H2O
CaCO3 + 2H+ = Ca2++CO2 ↑ + H2O
检查方程式两边各元素的原子个数和电荷总数是否相等
小结写拆删查
1、多元弱酸的酸式盐的酸根离子在离子方程式中不能拆开写,如NaHCO3溶液中,不能拆成H+ 和 。
2、对微溶物,如Ca(OH)2,如果是反应物且为澄清石灰水,应拆成Ca2+和OH-的形式,如果是生成物或是石灰乳等,则保留化学式Ca(OH)2。
易错提醒
1.书写下列反应的离子方程式
(1)氧化镁溶于稀盐酸。
(2)用碳酸钙与稀盐酸反应制备二氧化碳。
(3)铁与稀硫酸反应生成氢气。
(4)二氧化碳与澄清石灰水反应生成沉淀。
(5)氢氧化铜溶于稀硫酸。
MgO+2H+ = Mg2++H2O
CaCO3+2H+ = Ca2++CO2↑+H2O
Fe+2H+ = Fe2++H2↑
Ca2++2OH-+CO2 = CaCO3↓+H2O
Cu(OH)2+2H+ = Cu2++2H2O
1.看离子方程式是否符合客观事实。
例如:(1)离子方程式:Cu+2H+=Cu2++H2↑
(2)离子方程式:2Fe+6H+=2Fe3++3H2↑
不存在
错误
二、判断离子方程式是否正确(6看)
2.看离子方程式是否遵循两个守恒定律(质量守恒和电荷守恒)。
例如:(1)离子方程式:Al+3H+=Al3++H2↑
错误
Fe+2H+=Fe2++H2↑
2Al+6H+=2Al3++3H2↑
(2)离子方程式:Al+Cu2+= Al3++Cu
错误
2Al+3Cu2+=2Al3++3Cu
3.看是否符合拆写原则
例如:化学反应:2HCl+BaCO3=BaCl2+H2O+CO2↑
离子方程式: 2H++CO32-=H2O+CO2↑
错误
把强酸、强碱、可溶性盐拆成离子形式,
弱酸、弱碱、水、难溶的物质、气体、单质、氧化物均写化学式。
2H++BaCO3=Ba2++H2O+CO2↑
4.看化学计量数是否是最简。
例如:硫酸溶液和氢氧化钠溶液反应。
离子方程式:2H++2OH-=2H2O
错误
H++OH-=H2O
例如:Na2CO3+2HCl=2NaCl+H2O+CO2↑
离子方程式:CO32-+2H+=H2O+CO2
错误
5.看是否漏写某些符号
CO32-+2H+=H2O+CO2↑
“↑”“↓”“=”等符号是否使用得当
6.看是否漏掉离子反应
例如:CuSO4与Ba(OH)2溶液反应:
离子方程式:Ba2++SO42- = BaSO4↓
错误
Ba2++SO42-+Cu2++2OH-=BaSO4↓+Cu(OH)2↓
(1)看物质间反应是否符合反应的客观事实;
(2)看物质拆写是否正确;
(3)看是否符合原子守恒和电荷守恒;
(4)看化学计量数是否是最简;
(5)看是否漏写某些符号
(6)看是否漏掉离子反应
一、 离子方程式的书写步骤
二、离子方程式的正误判断
写、拆、删、查
【课堂小结】
1、将下面的化学方程式改为离子方程式:
(1)SO2 + Cl2 + 2H2O = H2SO4 + 2HCl
(2)3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
SO2 + Cl2 + 2H2O = 2H+ + SO42- + 2Cl- + 2H+
3Cu + 8H+ + 8NO3- = 3Cu2+ + 6NO3- + 2NO↑ + 4H2O
SO2 + Cl2 + 2H2O = 4H+ + SO42- + 2Cl-
3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑ + 4H2O
同步练习
2、下列离子方程式,书写正确的是( )
A、盐酸与碳酸钡反应: CO32-+2H+=CO2↑+H2O
B、硫酸铜溶液与氢氧化钡溶液:
Ba2++2OH-+Cu2++SO42-=BaSO4↓+Cu(OH)2↓
C、硝酸银溶液中加入铜粉: Ag++Cu=Cu2++Ag
D、铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B
3、下列离子方程式正确的是( )
A.Na2CO3和醋酸反应:2H+ +CO32-=H2O+CO2↑
B.Ba(OH)2和CuSO4溶液反应:Ba2++ SO42-= BaSO4↓
C、稀HCl和NH3·H2O反应:H++OH-= H2O
D、CaCO3和HCl 溶液反应:
CaCO3 + 2H+ = H2O + CO2↑ + Ca2+
D
谢谢观看
