化学人教(2019)必修第一册2.3.2. 物质的量浓度(共18张ppt)
文档属性
| 名称 | 化学人教(2019)必修第一册2.3.2. 物质的量浓度(共18张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 11.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-21 15:42:03 | ||
图片预览






文档简介
(共18张PPT)
物质的量浓度
第3节 物质的量
复习巩固
质量分数或质量百分数:
物质的量浓度?
物质的量浓度 amount-of-substance concentration
定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。
符号: c(B) 单位: mol/L 或 mol/m3
数学表达式:
注意事项:
1.要用溶液的体积(单位是L),而不是溶剂的体积。
2.溶质可用质量、体积或粒子数换算成物质的量。
3.能发生反应的物质,溶液溶质为反应后的化合物。
4.同一溶液,无论取出多大体积,其各种浓度均不变。
物质的量浓度的应用
例1.关于0.1 mol·L-1 KNO3溶液的叙述正确的是( )
A. 1 L该溶液中含KNO3 101 g
B. 100 mL该溶液中含KNO3 0.01 mol
C. 从1 L该溶液中取出500 mL后,剩余溶液的浓
度为0.05 mol·L-1
D. 1 L水中溶解0.1 mol KNO3,即可配得0.1
mol·L-1KNO3溶液
B
例2.下列溶液中的c(Cl-)与50 mL 1 mol·L-1的AlCl3溶液中c(Cl-)相等的是( )
A. 150 mL 1 mol·L-1 NaCl溶液
B. 75 mL 2 mol·L-1 CaCl2溶液
C. 100 mL 1 mol·L-1 KCl溶液
D. 75 mL 1 mol·L-1 FeCl3溶液
D
两种浓度的关系
已知某种溶液的质量分数为ω,溶质的摩尔质量为M g/mol,溶液的密度为ρ g/mL,求该溶液的物质的量浓度?
物质的量浓度与质量分数的关系:
解:设该溶液体积为1L,则
例3.某浓硝酸中溶质的质量分数为94%,密度为1.5g/cm3。计算该浓硝酸中HNO3的物质的量浓度。
该硝酸中HNO3的物质的量浓度为22.4mol/L。
浓溶液的稀释计算
浓溶液加水稀释为稀溶液,其溶质的物质的量不变。
稀释公式
例4. 用18mol/L的浓硫酸配制100mL1.0mol/L的硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平 C.玻璃棒
D.50mL容量瓶 E.10mL量筒 F.胶头滴管
G.50mL烧杯 H.100mL容量瓶
需要浓硫酸的体积为 mL;
5.6
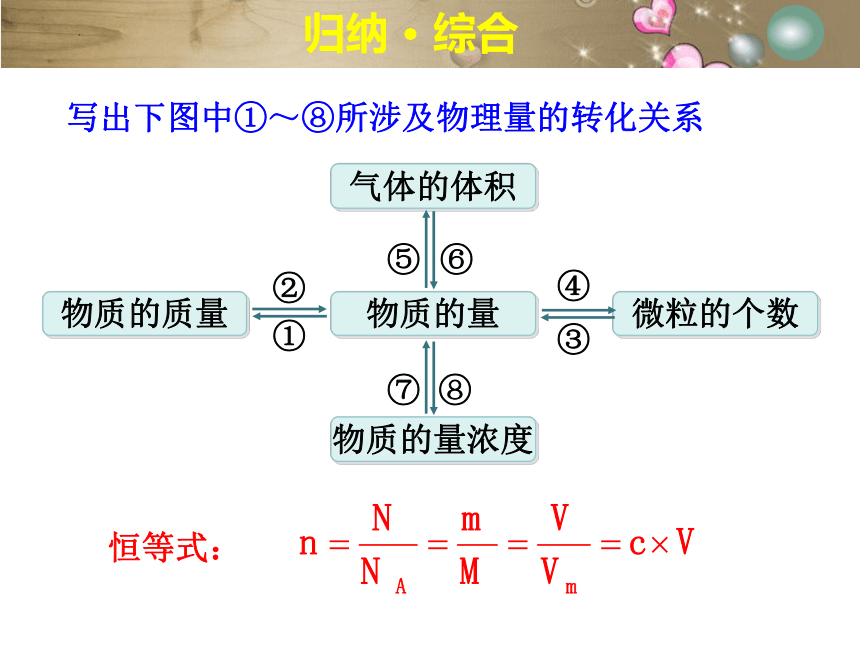
归纳 · 综合
物质的量
物质的质量
微粒的个数
物质的量浓度
气体的体积
①
②
③
④
⑤
⑥
⑦
⑧
写出下图中①~⑧所涉及物理量的转化关系
恒等式:
任务:现欲配制100mLNaCl溶液,其中溶质的物质的量为0.1mol。请你用实验室中的固体NaCl试剂,完成配制任务。
问题:许多化学反应都发生在溶液中。如果我们能建立溶液体积与溶质的物质的量的直接关系,会给生产和科学研究带来很多方便。那么,我们怎样建立这种关系呢?
活动 · 探究
除了溶液的质量分数、体积分数,标记溶液定量组成的方式还有哪些?
某矿泉水标签
某酒标签
某人的体检报告
如何保证溶液的体积恰好为100mL?
如何获得0.1mol的
氯化钠固体?
需要解决
的问题
配制100mL溶质物质的量为0.1mol的NaCl溶液?
用托盘天平或电子天平称取5.9g氯化钠固体?
?
活动 · 探究
细颈、梨形的平底玻璃瓶,瓶口配有磨口玻璃塞或塑料塞。
容量瓶(volumetric flask)
①容量瓶上标有温度和容积
②容量瓶上有刻线而无刻度
1.构造:
2. 特点:
3. 使用范围:
用于配制一定体积的、浓度准确的溶液 (容量瓶是量器不是容器)
4. 规格:
100mL
250mL
500mL
1000mL
在指定温度下(一般为20℃),瓶内液体的凹液面与容量瓶颈部的刻度线相切时,溶液体积恰好与瓶上标注的体积相等。
(1)使用前要检查是否漏水
(2)①不能溶解固体或稀释溶液
②不能长期存放溶液或进行化学反应
容量瓶使用时的注意事项
检验方法: 往瓶内加入一定量水,塞好瓶塞。用食指摁住瓶塞,另一只手托住瓶底,把瓶倒立过来,观察瓶塞周围是否有水漏出。如果不漏水,将瓶正立并将瓶塞旋转180°后塞紧,仍把瓶倒立过来,再检查是否漏水。经检查不漏水的容量瓶才能使用。
为了避免溶质在溶解或稀释时因吸热、放热而影响容量瓶的容积,溶质应该首先在烧杯中溶解或稀释并待溶液温度恢复到室温后,再将其转移到容量瓶中。
③只能配制容量瓶中规定容积的溶液
正确读刻度的方法:平视
错误读法:仰视体积偏大,浓度偏低,
俯视体积偏小,浓度偏高
容量瓶读刻度的注意事项
俯视
仰视
平视
配制步骤
计算
m(NaCl)=0.1mol×58.5g/mol ≈ 5.9g
对固体用天平称质量 (对液体用量筒量取体积)
称量
1
2
配制100mL溶质物质的量为0.04mol的NaCl溶液?
电子天平
托盘天平
配制一定浓度的溶液所需溶质的质量或体积。
(固体算质量,液体算体积)
配制步骤
溶解(或稀释)
在小烧杯中溶解NaCl固体,并用玻璃棒搅拌加速溶解。
3
在烧杯中溶解或稀释溶质
4
静置冷却
溶液静置至室温,防止出现误差。
转移
溶液冷却后,用玻璃棒小心引流到一定体积的容量瓶
5
本次配制选用100mL容量瓶
配制步骤
洗涤
用少量蒸馏水洗涤烧杯及玻璃棒2-3次,洗涤液全部转移到容量瓶。
6
定容
缓缓将蒸馏水注入到容量瓶中至接近刻度线1-2cm处,改用胶头滴管加蒸馏水至溶液的凹液面正好与刻度线相切。
7
配制步骤
摇匀
将容量瓶瓶塞盖好,反复上下颠倒,摇匀。
8
装瓶贴标签
9
将配好的溶液转移到试剂瓶中保存。在试剂瓶上贴上标签,注明试剂名称、浓度、配制日期等。
0.4mol/L
小结配制步骤和所需仪器
计
量
溶
转
洗
定
摇
装
冷
配制一定物质的量浓度的溶液
容量瓶
小烧杯
玻璃棒
胶头滴管
天平
误差分析
判断:以下操作会使配制的溶液产生什么误差?
①未用蒸馏水洗涤烧杯内壁。( )
②容量瓶洗涤后内壁附有水珠。( )
③浓硫酸稀释后,没有恢复至室温即转移。( )
④定容时俯视读数。( )
⑤定容后发现液面低于刻度线,再用胶头滴管加水至刻度线。( )
原则:
1﹑分析误差时,要根据c=n/v, 围绕操作行为对n与V的影响来分析。
2﹑由于操作不慎造成不可挽回的误差,溶液重新配制。
偏小
不影响
偏大
偏大
偏小
物质的量浓度
第3节 物质的量
复习巩固
质量分数或质量百分数:
物质的量浓度?
物质的量浓度 amount-of-substance concentration
定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。
符号: c(B) 单位: mol/L 或 mol/m3
数学表达式:
注意事项:
1.要用溶液的体积(单位是L),而不是溶剂的体积。
2.溶质可用质量、体积或粒子数换算成物质的量。
3.能发生反应的物质,溶液溶质为反应后的化合物。
4.同一溶液,无论取出多大体积,其各种浓度均不变。
物质的量浓度的应用
例1.关于0.1 mol·L-1 KNO3溶液的叙述正确的是( )
A. 1 L该溶液中含KNO3 101 g
B. 100 mL该溶液中含KNO3 0.01 mol
C. 从1 L该溶液中取出500 mL后,剩余溶液的浓
度为0.05 mol·L-1
D. 1 L水中溶解0.1 mol KNO3,即可配得0.1
mol·L-1KNO3溶液
B
例2.下列溶液中的c(Cl-)与50 mL 1 mol·L-1的AlCl3溶液中c(Cl-)相等的是( )
A. 150 mL 1 mol·L-1 NaCl溶液
B. 75 mL 2 mol·L-1 CaCl2溶液
C. 100 mL 1 mol·L-1 KCl溶液
D. 75 mL 1 mol·L-1 FeCl3溶液
D
两种浓度的关系
已知某种溶液的质量分数为ω,溶质的摩尔质量为M g/mol,溶液的密度为ρ g/mL,求该溶液的物质的量浓度?
物质的量浓度与质量分数的关系:
解:设该溶液体积为1L,则
例3.某浓硝酸中溶质的质量分数为94%,密度为1.5g/cm3。计算该浓硝酸中HNO3的物质的量浓度。
该硝酸中HNO3的物质的量浓度为22.4mol/L。
浓溶液的稀释计算
浓溶液加水稀释为稀溶液,其溶质的物质的量不变。
稀释公式
例4. 用18mol/L的浓硫酸配制100mL1.0mol/L的硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平 C.玻璃棒
D.50mL容量瓶 E.10mL量筒 F.胶头滴管
G.50mL烧杯 H.100mL容量瓶
需要浓硫酸的体积为 mL;
5.6
归纳 · 综合
物质的量
物质的质量
微粒的个数
物质的量浓度
气体的体积
①
②
③
④
⑤
⑥
⑦
⑧
写出下图中①~⑧所涉及物理量的转化关系
恒等式:
任务:现欲配制100mLNaCl溶液,其中溶质的物质的量为0.1mol。请你用实验室中的固体NaCl试剂,完成配制任务。
问题:许多化学反应都发生在溶液中。如果我们能建立溶液体积与溶质的物质的量的直接关系,会给生产和科学研究带来很多方便。那么,我们怎样建立这种关系呢?
活动 · 探究
除了溶液的质量分数、体积分数,标记溶液定量组成的方式还有哪些?
某矿泉水标签
某酒标签
某人的体检报告
如何保证溶液的体积恰好为100mL?
如何获得0.1mol的
氯化钠固体?
需要解决
的问题
配制100mL溶质物质的量为0.1mol的NaCl溶液?
用托盘天平或电子天平称取5.9g氯化钠固体?
?
活动 · 探究
细颈、梨形的平底玻璃瓶,瓶口配有磨口玻璃塞或塑料塞。
容量瓶(volumetric flask)
①容量瓶上标有温度和容积
②容量瓶上有刻线而无刻度
1.构造:
2. 特点:
3. 使用范围:
用于配制一定体积的、浓度准确的溶液 (容量瓶是量器不是容器)
4. 规格:
100mL
250mL
500mL
1000mL
在指定温度下(一般为20℃),瓶内液体的凹液面与容量瓶颈部的刻度线相切时,溶液体积恰好与瓶上标注的体积相等。
(1)使用前要检查是否漏水
(2)①不能溶解固体或稀释溶液
②不能长期存放溶液或进行化学反应
容量瓶使用时的注意事项
检验方法: 往瓶内加入一定量水,塞好瓶塞。用食指摁住瓶塞,另一只手托住瓶底,把瓶倒立过来,观察瓶塞周围是否有水漏出。如果不漏水,将瓶正立并将瓶塞旋转180°后塞紧,仍把瓶倒立过来,再检查是否漏水。经检查不漏水的容量瓶才能使用。
为了避免溶质在溶解或稀释时因吸热、放热而影响容量瓶的容积,溶质应该首先在烧杯中溶解或稀释并待溶液温度恢复到室温后,再将其转移到容量瓶中。
③只能配制容量瓶中规定容积的溶液
正确读刻度的方法:平视
错误读法:仰视体积偏大,浓度偏低,
俯视体积偏小,浓度偏高
容量瓶读刻度的注意事项
俯视
仰视
平视
配制步骤
计算
m(NaCl)=0.1mol×58.5g/mol ≈ 5.9g
对固体用天平称质量 (对液体用量筒量取体积)
称量
1
2
配制100mL溶质物质的量为0.04mol的NaCl溶液?
电子天平
托盘天平
配制一定浓度的溶液所需溶质的质量或体积。
(固体算质量,液体算体积)
配制步骤
溶解(或稀释)
在小烧杯中溶解NaCl固体,并用玻璃棒搅拌加速溶解。
3
在烧杯中溶解或稀释溶质
4
静置冷却
溶液静置至室温,防止出现误差。
转移
溶液冷却后,用玻璃棒小心引流到一定体积的容量瓶
5
本次配制选用100mL容量瓶
配制步骤
洗涤
用少量蒸馏水洗涤烧杯及玻璃棒2-3次,洗涤液全部转移到容量瓶。
6
定容
缓缓将蒸馏水注入到容量瓶中至接近刻度线1-2cm处,改用胶头滴管加蒸馏水至溶液的凹液面正好与刻度线相切。
7
配制步骤
摇匀
将容量瓶瓶塞盖好,反复上下颠倒,摇匀。
8
装瓶贴标签
9
将配好的溶液转移到试剂瓶中保存。在试剂瓶上贴上标签,注明试剂名称、浓度、配制日期等。
0.4mol/L
小结配制步骤和所需仪器
计
量
溶
转
洗
定
摇
装
冷
配制一定物质的量浓度的溶液
容量瓶
小烧杯
玻璃棒
胶头滴管
天平
误差分析
判断:以下操作会使配制的溶液产生什么误差?
①未用蒸馏水洗涤烧杯内壁。( )
②容量瓶洗涤后内壁附有水珠。( )
③浓硫酸稀释后,没有恢复至室温即转移。( )
④定容时俯视读数。( )
⑤定容后发现液面低于刻度线,再用胶头滴管加水至刻度线。( )
原则:
1﹑分析误差时,要根据c=n/v, 围绕操作行为对n与V的影响来分析。
2﹑由于操作不慎造成不可挽回的误差,溶液重新配制。
偏小
不影响
偏大
偏大
偏小
