课题1《分子和原子》
图片预览






文档简介
课件26张PPT。第三单元物质构成的奥秘 课题1 原子的构成1.认识物质的微粒性,知道分子、原子等都是构成物质的微粒。
2.能用微观粒子的观点解释某些常见的现象。 “墙角数枝梅,凌寒独自开。遥知不是雪,为有暗香来。”诗人在远处就能闻到淡淡的梅花香味,你知道这其中蕴含的化学知识吗? (1)物质是由哪些微粒直接构成的? (2)原子和分子的根本区别:
在化学反应中,分子 而原子 。可分不可分回忆分子、原子、离子(3)原子的定义原子是化学变化中的最小的粒子(4)化学反应的实质:
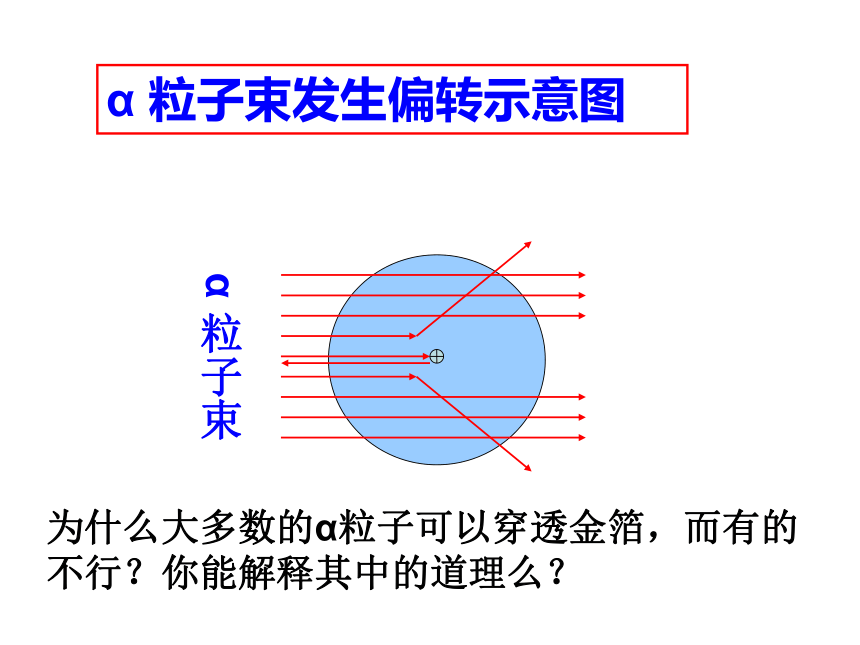
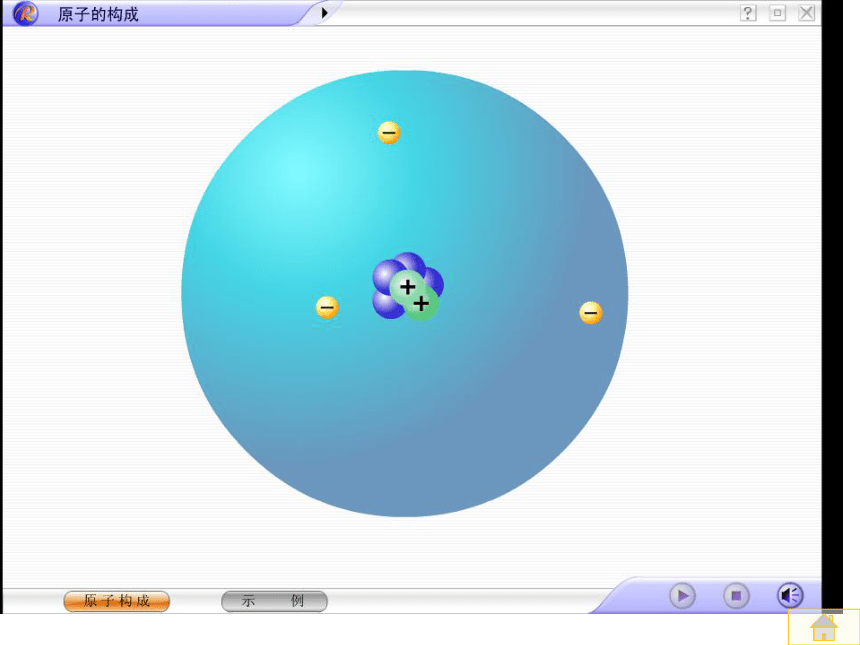
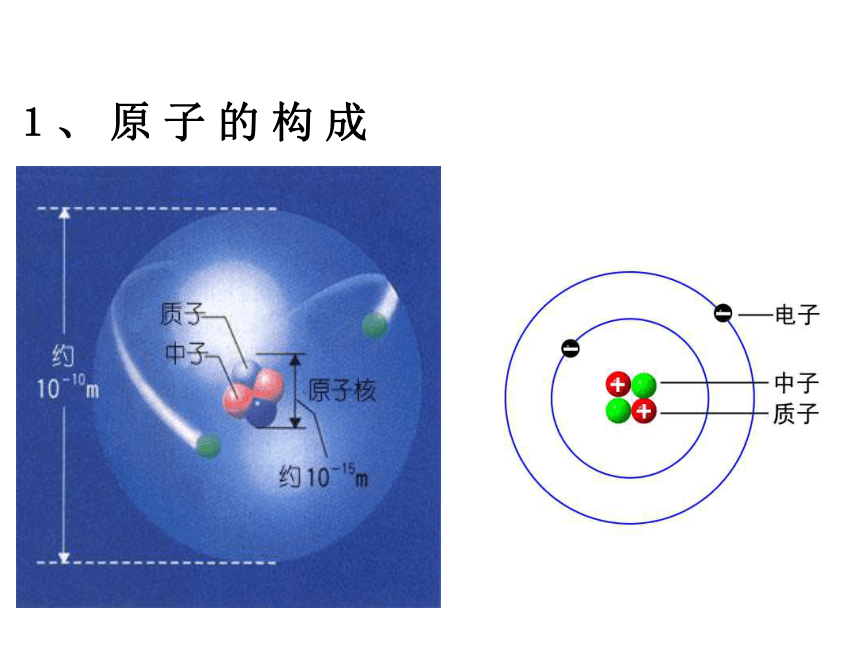
分子分裂成原子,原子重新组合成新的分子。著名的 粒子散射实验1909~1911年,英国物理学家卢瑟福和他的助手们进行了α粒子散射实验α 粒子束发生偏转示意图α 粒子束为什么大多数的α粒子可以穿透金箔,而有的不行?你能解释其中的道理么?交流共享1、原子核很小,原子内的空隙很大;2、α 粒子能穿透时受到原子核的排斥;3、原子核的质量很大;讨论、原子是不是一个不可割的实心球体呢?它的结构?1、 原 子 的 构 成阅读下表(表4-1 ),你能得出什么结论呢? 1、质子带正电,中子不带电,电子带负电。
2、质子和中子的质量很小,但比电子大很多。
3、中子不带电,所以原子核的电性由质子决定, 因此原子核带正电,数目跟质子相等。一、原子的构成原 子(带正电)(不显电性) (带负电) (带正电)(不带电) 核电荷数=质子数表4-1表4-2=核外电子数1.原子的构成原 子(带正电)(带负电) (带正电)(不带电) 核电荷数:是原子核所带的正电荷数。观察表格(表4-2 )2、所有原子都是由质子、中子、电子构成的吗?3、质子、中子、电子在数量上有什么关系?1、不同种原子之间有哪些区别?4、原子本身带电吗?为什么?2、原子组成中的规律:(1) 核电荷数 = 质子数 = 核外电子数(2) 原子种类不同,质子数不同,即原子的种类由 决定。质子数(5) 原子的质量主要集中在 上。原子核(3) 原子中,质子数不一定等于中子数。(4)不是所有原子都具有中子。 有一种元素的核电荷数为49,中子数为66,则
这种元素的质子数和核外电子数分别为( )
A 49 66 B 66 49
C 66 66 D 49 49核电荷数=质子数=核外电子数课堂练习下列叙述正确的是( )
A 原子核都由质子和中子构成
B 在原子中,核内的质子数与核外的电子数不一定相等
C 原子里有相对很大的空间,电子在这个空间里作高速运动
D 不同种类的原子,核内的质子数不同,核外电子数不同C、D 2.原子(普通氢除外)的原子核是( )
(A)由电子和质子构成 B 由质子和中子构成
(C)由电子和中子构成 (D)不能再分
3.已知原子核电荷数,可以确定它的( )
A、质子数 B、电子数 C、中子数和电子数之和 D、原子量
4.化学变化中的最小微粒是( ),在化学变化中可 分的微粒是 ( )
A、原子 B、分子 C、电子 D、原子核BABA B一个氧原子的质量是: 0.00000000000000000000000002657千克 即2.657×10-26千克 一个铁原子的质量是: 0.00000000000000000000000009288千克 即9.288×10-26千克 【相对原子质量】以一种碳原子质量的1/12为标准,其他原子的质量跟它相比较所得的比,作为这种原子的相对原子质量。(符号为Ar)氢的相对原子质量==1氢原子质量标准已知:氢原子的质量=1.67×10-27Kg≈ 1.66×10-27Kg氧的相对原子质量==16氧原子质量标准已知:氧原子的质量=2.657×10-26Kg≈ 1.66×10-27Kg注意:
1、相对原子质量不是原子的实际质量,是一个比值。
2、单位:为1(一般不写)查阅表4-3:查出氢、碳、氢、钠、氯相对原子质量111216236811176812180++≈≈+++≈≈写在表4~2的空白处:35.5≈练 一 练 1、填表:C1 0 12 26 30 1 1 12 12 26 2 某原子的质子数为26,中子数比质子数多4,则该原子中所含微粒总数为( )
A 26 B 56
C 82 D 863. 铁原子的相对原子质量是( )
A 、56克 B 、56
C 、9.288*10-26 Kg D、 1/56BB4、氧原子的相对原子质量为( )
A、16g B、16 C、2.657×10-26kg D、16kg
5、最近,俄罗斯科学家宣布他们通过核反应合成了核电荷数为114、相对原子质量为289的超重元素原子,该原子内质子数为 ,中子数为 ,核外电子数为 。 114175114 6 . 铝原子的相对原子质量为27,核电荷数为13,则铝原子由( )个质子和( )个中子构成一个原子核,核外有( )个电子作高速运动而构成.整个原子不显电性的原因是:131413质子和电子所带电量相等,电性相反
2.能用微观粒子的观点解释某些常见的现象。 “墙角数枝梅,凌寒独自开。遥知不是雪,为有暗香来。”诗人在远处就能闻到淡淡的梅花香味,你知道这其中蕴含的化学知识吗? (1)物质是由哪些微粒直接构成的? (2)原子和分子的根本区别:
在化学反应中,分子 而原子 。可分不可分回忆分子、原子、离子(3)原子的定义原子是化学变化中的最小的粒子(4)化学反应的实质:
分子分裂成原子,原子重新组合成新的分子。著名的 粒子散射实验1909~1911年,英国物理学家卢瑟福和他的助手们进行了α粒子散射实验α 粒子束发生偏转示意图α 粒子束为什么大多数的α粒子可以穿透金箔,而有的不行?你能解释其中的道理么?交流共享1、原子核很小,原子内的空隙很大;2、α 粒子能穿透时受到原子核的排斥;3、原子核的质量很大;讨论、原子是不是一个不可割的实心球体呢?它的结构?1、 原 子 的 构 成阅读下表(表4-1 ),你能得出什么结论呢? 1、质子带正电,中子不带电,电子带负电。
2、质子和中子的质量很小,但比电子大很多。
3、中子不带电,所以原子核的电性由质子决定, 因此原子核带正电,数目跟质子相等。一、原子的构成原 子(带正电)(不显电性) (带负电) (带正电)(不带电) 核电荷数=质子数表4-1表4-2=核外电子数1.原子的构成原 子(带正电)(带负电) (带正电)(不带电) 核电荷数:是原子核所带的正电荷数。观察表格(表4-2 )2、所有原子都是由质子、中子、电子构成的吗?3、质子、中子、电子在数量上有什么关系?1、不同种原子之间有哪些区别?4、原子本身带电吗?为什么?2、原子组成中的规律:(1) 核电荷数 = 质子数 = 核外电子数(2) 原子种类不同,质子数不同,即原子的种类由 决定。质子数(5) 原子的质量主要集中在 上。原子核(3) 原子中,质子数不一定等于中子数。(4)不是所有原子都具有中子。 有一种元素的核电荷数为49,中子数为66,则
这种元素的质子数和核外电子数分别为( )
A 49 66 B 66 49
C 66 66 D 49 49核电荷数=质子数=核外电子数课堂练习下列叙述正确的是( )
A 原子核都由质子和中子构成
B 在原子中,核内的质子数与核外的电子数不一定相等
C 原子里有相对很大的空间,电子在这个空间里作高速运动
D 不同种类的原子,核内的质子数不同,核外电子数不同C、D 2.原子(普通氢除外)的原子核是( )
(A)由电子和质子构成 B 由质子和中子构成
(C)由电子和中子构成 (D)不能再分
3.已知原子核电荷数,可以确定它的( )
A、质子数 B、电子数 C、中子数和电子数之和 D、原子量
4.化学变化中的最小微粒是( ),在化学变化中可 分的微粒是 ( )
A、原子 B、分子 C、电子 D、原子核BABA B一个氧原子的质量是: 0.00000000000000000000000002657千克 即2.657×10-26千克 一个铁原子的质量是: 0.00000000000000000000000009288千克 即9.288×10-26千克 【相对原子质量】以一种碳原子质量的1/12为标准,其他原子的质量跟它相比较所得的比,作为这种原子的相对原子质量。(符号为Ar)氢的相对原子质量==1氢原子质量标准已知:氢原子的质量=1.67×10-27Kg≈ 1.66×10-27Kg氧的相对原子质量==16氧原子质量标准已知:氧原子的质量=2.657×10-26Kg≈ 1.66×10-27Kg注意:
1、相对原子质量不是原子的实际质量,是一个比值。
2、单位:为1(一般不写)查阅表4-3:查出氢、碳、氢、钠、氯相对原子质量111216236811176812180++≈≈+++≈≈写在表4~2的空白处:35.5≈练 一 练 1、填表:C1 0 12 26 30 1 1 12 12 26 2 某原子的质子数为26,中子数比质子数多4,则该原子中所含微粒总数为( )
A 26 B 56
C 82 D 863. 铁原子的相对原子质量是( )
A 、56克 B 、56
C 、9.288*10-26 Kg D、 1/56BB4、氧原子的相对原子质量为( )
A、16g B、16 C、2.657×10-26kg D、16kg
5、最近,俄罗斯科学家宣布他们通过核反应合成了核电荷数为114、相对原子质量为289的超重元素原子,该原子内质子数为 ,中子数为 ,核外电子数为 。 114175114 6 . 铝原子的相对原子质量为27,核电荷数为13,则铝原子由( )个质子和( )个中子构成一个原子核,核外有( )个电子作高速运动而构成.整个原子不显电性的原因是:131413质子和电子所带电量相等,电性相反
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
