人教版化学九年级上册课件 第五单元课题2《如何正确书写化学方程式》 (共26张PPT)
文档属性
| 名称 | 人教版化学九年级上册课件 第五单元课题2《如何正确书写化学方程式》 (共26张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 299.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-19 15:31:15 | ||
图片预览







文档简介
(共26张PPT)
化学方程式能给我们提供哪些信息?
1、反应物、生成物和反应条件;
2、参加反应的各粒子的个数比;
3、各反应物和生成物之间的质量比。
化学方程式的读法:
(以 4P + 5O2 2P2O5 为例)
点燃
4×31
5×32
2×142
Fe + O2 Fe3O4
点燃
是正确的化学方程式吗?
否!
课 题 2
如何正确书写化学方程式
2H2 + O2 2H2O
点燃
1.化学方程式的书写原则
(1)以客观事实为基础,
不能臆造事实上不存在的物质和化学反应.
(2)遵守质量守恒定律,
遵守质量守恒定律,就是等号两边各种原子的数目必须相等。对于书写化学方程式就是配平,但不能改变 物质的化学式。
二、如何正确书写化学方程式
某学生写出了磷在氧气中燃烧的化学方程式,请分析是否正确,并说出理由。
练习
(1)P + O2 PO2
(2)P2 + O5 P2O5
(3)P + O2 P2O5
凭空臆造成生成物PO2 ,与事实不符
任意改动氧气化学式,臆造了反应物的化学式,与事实不符,
反应前后各原子个数不相等,违背了质量守恒定律
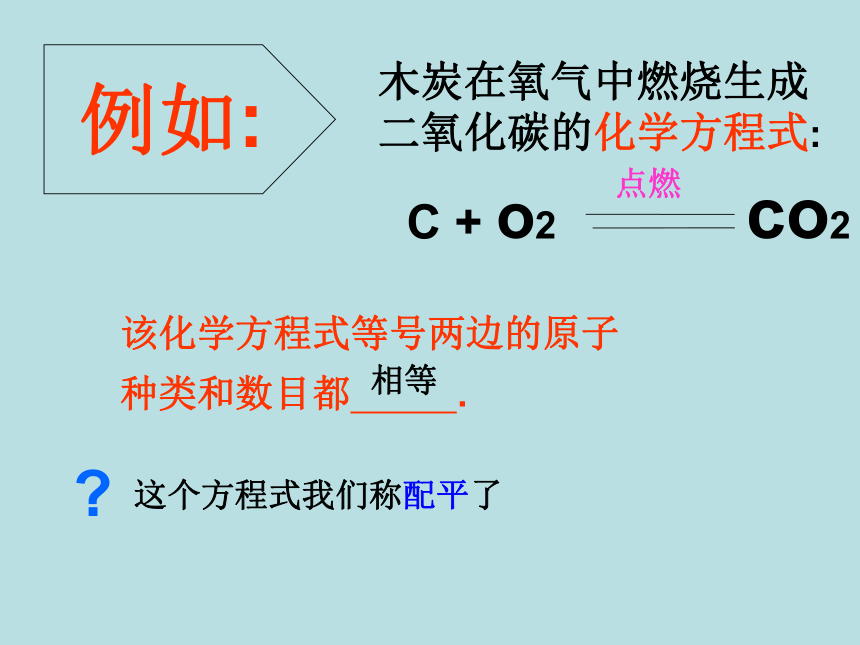
木炭在氧气中燃烧生成
二氧化碳的化学方程式:
例如:
C + o2 co2
点燃
该化学方程式等号两边的原子种类和数目都 .
这个方程式我们称配平了
相等
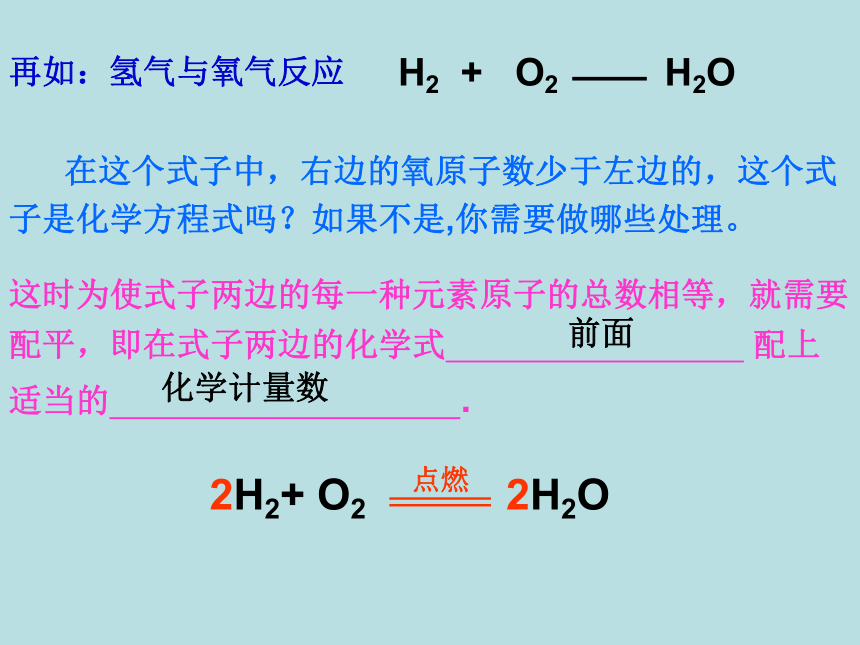
H2 + O2 H2O
再如:氢气与氧气反应
在这个式子中,右边的氧原子数少于左边的,这个式子是化学方程式吗?如果不是,你需要做哪些处理。
这时为使式子两边的每一种元素原子的总数相等,就需要配平,即在式子两边的化学式 配上适当的 .
前面
化学计量数
2H2+ O2 2H2O
点燃
二、化学方程式的书写步骤
以磷在空气中燃烧生成五氧化二磷的反应为例:
左反应物化学式(短线连接)右生成物化学式
P
+
O2
P2O5
写
配
P
P2O5
+
O2
5
?
配平化学方程式,并检查。
?
2
?
4
标
标明化学反应的条件,生成物的状态。
+
P
P2O5
O2
点 燃
4 5 2
等
短线变等号
4P
2P2O5
+
5O2
注意:
1.点燃≠加热≠高温
2.化学式前的化学计量数是最简整数比
2KMnO4 K2MnO4 + MnO2 + O2
△
2H2O 2H2 + O2
通电
Fe + CuSO4 = Cu + FeSO4
S + O2 SO2
点燃
如生成物中有气体,而反应物中没有气体,则在气体生成 物的化学式右边要注“↑”号
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2
在溶液中反应如果生成物中有固体,而反应物中没有固体则在固体生成物的化学式右边要注“↓”号
Ca(OH)2 +CO2 = CaCO3↓+H2O
配平化学方程式的方法
①观察法
S + O2 SO2
点燃
C + O2 CO2
点燃
C + O2 CO
点燃
2
2
H2O H2 ↑ + O2 ↑
通电
2
2
这种方法对一些简单的方程式很有效,凑数进行配平。
②最小公倍数法
P + O2 P2O5
找出关键元素(是O)。反应前、后该(氧)原子个数的最小公倍数是10
P + O2 P2O5
最小公倍数除以化学式中该原子的个数,把得到的数字写到化学式前面。
P + 5O2 2P2O5
再配平其他原子。
P + O2 P2O5
反应前后原子数最多的原子
O2
O5
5
2
4
点燃
配平练习:
Mg + O2
MgO
2
2
点燃
Al + O2
Al2O3
2
3
4
点燃
CO + O2 CO2
③奇数配偶法
找出关键元素(是O):反应前、后某元素出现次数最多,并且短线两边该原子总数为一边奇数、一边偶数。
把奇数配成偶数。
(优先考虑×2)
再配平其它原子和氧原子,短线变等号。
CO + O2 CO2
2
CO + O2 CO2
2
2
点燃
C2H2 + O2 CO2 + H2O
练习:
2
2
4
5
①配H2O前化学计量数2
②配C2H2前化学计量数2
③配CO2前计量数4
④配O2前化学计量数5
点燃
配平练习:
FeS2 + O2
Fe2O3 + SO2
高温
2
4
11
8
Fe2O3 + SO2
Na2CO3+ HCl NaCl+ H2O+ CO2↑
④待定系数法
找出含原子数最多的化学式,假设其化学计量数为1
Na2CO3
2
1
1
1
2
NaOH + CuSO4 Cu(OH)2↓ + Na2SO4
Na2SO4
1
2
1
1
CO2 + Ca(OH)2 Ca CO3↓ + H2O
H2 + Fe2O3 Fe+ H2O
高温
2
3
3
CO+ Fe2O3 Fe+ CO2
高温
3
3
2
配平练习:
配平练习:
C2H2 + O2 CO2 + H2O
1
2
2
5
2
5
4
1
2
点燃
学完本课题你应该知道
1、书写化学方程式要遵守两个原则:一是必须以客观事实为基础,不能凭空臆造事实上不存在的物质和化学反应;二是要遵守质量守恒定律。
2、书写化学方程式时,在式子左、右两边的化学式前面要配上适当的化学计量数,使得每一种元素的原子总数相等,这个过程就是化学方程式的配平。
(1)碳在氧气中燃烧:
(2)硫在空气中燃烧:
(3)铁丝在氧气中燃烧:
(4)磷在空气中燃烧:
(5)氢气在空气中燃烧:
C + O2 CO2
点燃
S + O2 SO2
点燃
3Fe + 2O2 Fe3O4
点燃
2H2+ O2 2H2O
点燃
4P + 5O2 2P2O5
点燃
(6)电解水:
(7)实验室用氯酸钾制取氧气:
(8)实验室用高锰酸钾制取氧气:
(9)实验室用过氧化氢制取氧气:
2KMnO4 K2MnO4 + MnO2 +O2
2KClO3 2 KCl+ 3 O2
MnO2
△
2H2O + O2
MnO2
2H2O2
2H2O 2H2 + O2
通电
10、铁和稀硫酸(H2SO4)反应得到氢气和硫酸亚铁
Fe+H2SO4 = H2 ↑+FeSO4
11、木炭和氧化铜在高温的条件下反应生成铜和二氧化碳:
C + 2 CuO 2 Cu + CO2↑
高温
12、氨气(NH3)与氧化铜在加热的条件下反应生成铜、水和一种气体单质:
2NH3+ 3CuO 3H2O + 3 Cu + N2
元素化合价口诀
Cl H K Na Ag
-1 +1 +1 +1 +1
O Ca Ba Mg Zn
-2 +2 +2 +2 +2
Al Si P
+3 +4 +5
Fe Fe C C
+2 +3 +2 +4
S S S
-2 +4 +6
Cu Hg
+2 +2
-1 -1
OH- NO3-
SO42- CO32-
PO43-
NH4+
-2 -2
-3
+1
氢离子 H+ 钾离子 K+ 钠离子 Na+
银离子 Ag+ 镁离子 Mg2+ 钙离子 Ca2+
锌离子 Zn2+ 铜离子 Cu2+ 铁离子 Fe3+
亚铁离子 Fe2+ 钡离子 Ba2+ 铝离子 Al3+
氯离子Cl- 铵根离子 NH4+
氢氧根离子 OH- 硝酸根离子 NO3-
硫酸根离子 SO42- 碳酸根离子 CO32-
化学方程式能给我们提供哪些信息?
1、反应物、生成物和反应条件;
2、参加反应的各粒子的个数比;
3、各反应物和生成物之间的质量比。
化学方程式的读法:
(以 4P + 5O2 2P2O5 为例)
点燃
4×31
5×32
2×142
Fe + O2 Fe3O4
点燃
是正确的化学方程式吗?
否!
课 题 2
如何正确书写化学方程式
2H2 + O2 2H2O
点燃
1.化学方程式的书写原则
(1)以客观事实为基础,
不能臆造事实上不存在的物质和化学反应.
(2)遵守质量守恒定律,
遵守质量守恒定律,就是等号两边各种原子的数目必须相等。对于书写化学方程式就是配平,但不能改变 物质的化学式。
二、如何正确书写化学方程式
某学生写出了磷在氧气中燃烧的化学方程式,请分析是否正确,并说出理由。
练习
(1)P + O2 PO2
(2)P2 + O5 P2O5
(3)P + O2 P2O5
凭空臆造成生成物PO2 ,与事实不符
任意改动氧气化学式,臆造了反应物的化学式,与事实不符,
反应前后各原子个数不相等,违背了质量守恒定律
木炭在氧气中燃烧生成
二氧化碳的化学方程式:
例如:
C + o2 co2
点燃
该化学方程式等号两边的原子种类和数目都 .
这个方程式我们称配平了
相等
H2 + O2 H2O
再如:氢气与氧气反应
在这个式子中,右边的氧原子数少于左边的,这个式子是化学方程式吗?如果不是,你需要做哪些处理。
这时为使式子两边的每一种元素原子的总数相等,就需要配平,即在式子两边的化学式 配上适当的 .
前面
化学计量数
2H2+ O2 2H2O
点燃
二、化学方程式的书写步骤
以磷在空气中燃烧生成五氧化二磷的反应为例:
左反应物化学式(短线连接)右生成物化学式
P
+
O2
P2O5
写
配
P
P2O5
+
O2
5
?
配平化学方程式,并检查。
?
2
?
4
标
标明化学反应的条件,生成物的状态。
+
P
P2O5
O2
点 燃
4 5 2
等
短线变等号
4P
2P2O5
+
5O2
注意:
1.点燃≠加热≠高温
2.化学式前的化学计量数是最简整数比
2KMnO4 K2MnO4 + MnO2 + O2
△
2H2O 2H2 + O2
通电
Fe + CuSO4 = Cu + FeSO4
S + O2 SO2
点燃
如生成物中有气体,而反应物中没有气体,则在气体生成 物的化学式右边要注“↑”号
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2
在溶液中反应如果生成物中有固体,而反应物中没有固体则在固体生成物的化学式右边要注“↓”号
Ca(OH)2 +CO2 = CaCO3↓+H2O
配平化学方程式的方法
①观察法
S + O2 SO2
点燃
C + O2 CO2
点燃
C + O2 CO
点燃
2
2
H2O H2 ↑ + O2 ↑
通电
2
2
这种方法对一些简单的方程式很有效,凑数进行配平。
②最小公倍数法
P + O2 P2O5
找出关键元素(是O)。反应前、后该(氧)原子个数的最小公倍数是10
P + O2 P2O5
最小公倍数除以化学式中该原子的个数,把得到的数字写到化学式前面。
P + 5O2 2P2O5
再配平其他原子。
P + O2 P2O5
反应前后原子数最多的原子
O2
O5
5
2
4
点燃
配平练习:
Mg + O2
MgO
2
2
点燃
Al + O2
Al2O3
2
3
4
点燃
CO + O2 CO2
③奇数配偶法
找出关键元素(是O):反应前、后某元素出现次数最多,并且短线两边该原子总数为一边奇数、一边偶数。
把奇数配成偶数。
(优先考虑×2)
再配平其它原子和氧原子,短线变等号。
CO + O2 CO2
2
CO + O2 CO2
2
2
点燃
C2H2 + O2 CO2 + H2O
练习:
2
2
4
5
①配H2O前化学计量数2
②配C2H2前化学计量数2
③配CO2前计量数4
④配O2前化学计量数5
点燃
配平练习:
FeS2 + O2
Fe2O3 + SO2
高温
2
4
11
8
Fe2O3 + SO2
Na2CO3+ HCl NaCl+ H2O+ CO2↑
④待定系数法
找出含原子数最多的化学式,假设其化学计量数为1
Na2CO3
2
1
1
1
2
NaOH + CuSO4 Cu(OH)2↓ + Na2SO4
Na2SO4
1
2
1
1
CO2 + Ca(OH)2 Ca CO3↓ + H2O
H2 + Fe2O3 Fe+ H2O
高温
2
3
3
CO+ Fe2O3 Fe+ CO2
高温
3
3
2
配平练习:
配平练习:
C2H2 + O2 CO2 + H2O
1
2
2
5
2
5
4
1
2
点燃
学完本课题你应该知道
1、书写化学方程式要遵守两个原则:一是必须以客观事实为基础,不能凭空臆造事实上不存在的物质和化学反应;二是要遵守质量守恒定律。
2、书写化学方程式时,在式子左、右两边的化学式前面要配上适当的化学计量数,使得每一种元素的原子总数相等,这个过程就是化学方程式的配平。
(1)碳在氧气中燃烧:
(2)硫在空气中燃烧:
(3)铁丝在氧气中燃烧:
(4)磷在空气中燃烧:
(5)氢气在空气中燃烧:
C + O2 CO2
点燃
S + O2 SO2
点燃
3Fe + 2O2 Fe3O4
点燃
2H2+ O2 2H2O
点燃
4P + 5O2 2P2O5
点燃
(6)电解水:
(7)实验室用氯酸钾制取氧气:
(8)实验室用高锰酸钾制取氧气:
(9)实验室用过氧化氢制取氧气:
2KMnO4 K2MnO4 + MnO2 +O2
2KClO3 2 KCl+ 3 O2
MnO2
△
2H2O + O2
MnO2
2H2O2
2H2O 2H2 + O2
通电
10、铁和稀硫酸(H2SO4)反应得到氢气和硫酸亚铁
Fe+H2SO4 = H2 ↑+FeSO4
11、木炭和氧化铜在高温的条件下反应生成铜和二氧化碳:
C + 2 CuO 2 Cu + CO2↑
高温
12、氨气(NH3)与氧化铜在加热的条件下反应生成铜、水和一种气体单质:
2NH3+ 3CuO 3H2O + 3 Cu + N2
元素化合价口诀
Cl H K Na Ag
-1 +1 +1 +1 +1
O Ca Ba Mg Zn
-2 +2 +2 +2 +2
Al Si P
+3 +4 +5
Fe Fe C C
+2 +3 +2 +4
S S S
-2 +4 +6
Cu Hg
+2 +2
-1 -1
OH- NO3-
SO42- CO32-
PO43-
NH4+
-2 -2
-3
+1
氢离子 H+ 钾离子 K+ 钠离子 Na+
银离子 Ag+ 镁离子 Mg2+ 钙离子 Ca2+
锌离子 Zn2+ 铜离子 Cu2+ 铁离子 Fe3+
亚铁离子 Fe2+ 钡离子 Ba2+ 铝离子 Al3+
氯离子Cl- 铵根离子 NH4+
氢氧根离子 OH- 硝酸根离子 NO3-
硫酸根离子 SO42- 碳酸根离子 CO32-
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
