高中化学人教版(2019)必修第二册5.1.2硫酸、硫酸根离子的检验(共18张ppt)
文档属性
| 名称 | 高中化学人教版(2019)必修第二册5.1.2硫酸、硫酸根离子的检验(共18张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 18.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-24 20:06:56 | ||
图片预览




文档简介
(共19张PPT)
化学
第五章 化工生产中的重要非金属元素
第一节 硫及其化合物
第2课时 硫酸 硫酸根离子的检验
知识点一 硫酸
1.硫酸的用途与工业制备
(1)用途
①重要的化工原料,可用于生产化肥、农药、炸药、染料和盐类等。
②用于精炼石油、金属加工前的酸洗、制取各种挥发性酸及用作干燥剂等。
硫酸
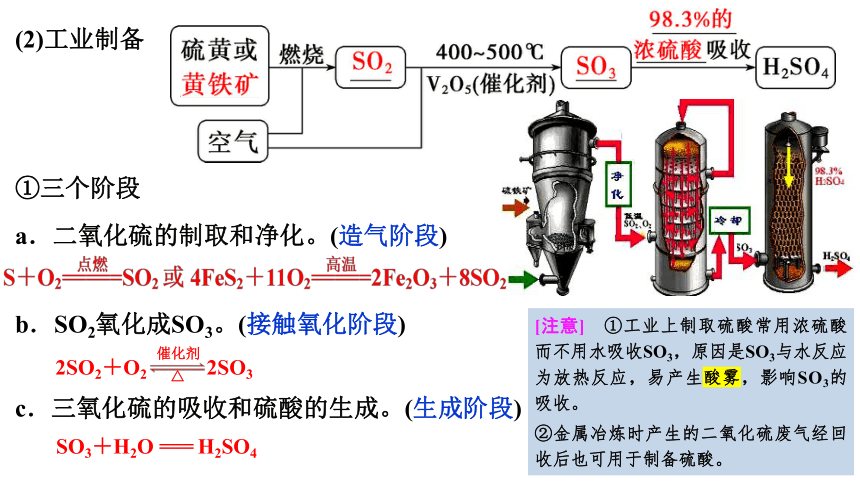
(2)工业制备
①三个阶段
a.二氧化硫的制取和净化。(造气阶段)
b.SO2氧化成SO3。(接触氧化阶段)
c.三氧化硫的吸收和硫酸的生成。(生成阶段)
2SO2+O2 2SO3
△
催化剂
SO3+H2O === H2SO4
[注意] ①工业上制取硫酸常用浓硫酸而不用水吸收SO3,原因是SO3与水反应为放热反应,易产生酸雾,影响SO3的吸收。
②金属冶炼时产生的二氧化硫废气经回收后也可用于制备硫酸。
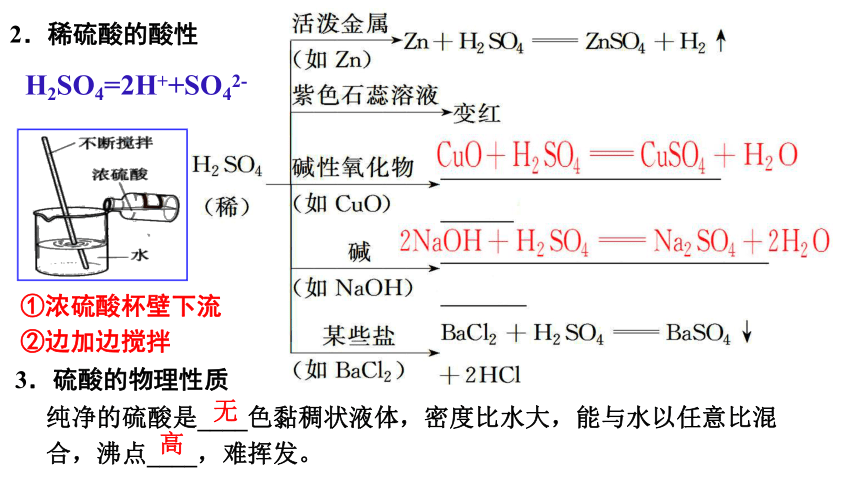
2.稀硫酸的酸性
3.硫酸的物理性质
纯净的硫酸是____色黏稠状液体,密度比水大,能与水以任意比混
合,沸点____,难挥发。
无
高
H2SO4=2H++SO42-
①浓硫酸杯壁下流
②边加边搅拌
4.浓硫酸的特性
实例 浓H2SO4吸收水蒸气? 胆矾中滴加浓H2SO4
现象
原理
结论
应用
浓H2SO4腐蚀布、木、纸
蔗糖中滴加浓H2SO4
蔗糖中滴加浓H2SO4……
吸收结晶水(蓝→白)
CuSO4·5H2O = CuSO4+5H2O
浓H2SO4
①吸水性
干燥剂 (除NH3、 H2S、HBr、HI外)
碳化变黑
C12H22O11 12C + 11H2O
浓H2SO4
②脱水性
H、O按2:1脱去
吸收水蒸气
(物理变化)
(化学变化)
(化学变化)
体积膨胀,产生刺激性气味气体,放出大量的热
③强氧化性
常温下使Fe、Al等金属钝化
除Au、Pt以外的绝大多数金属都能与浓硫酸作用
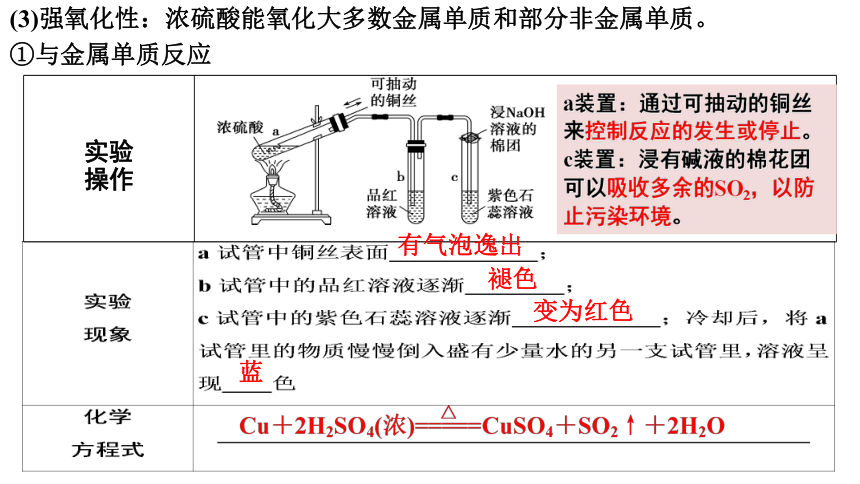
(3)强氧化性:浓硫酸能氧化大多数金属单质和部分非金属单质。
①与金属单质反应
实验 操作
有气泡逸出
褪色
变为红色
蓝
a装置:通过可抽动的铜丝来控制反应的发生或停止。
c装置:浸有碱液的棉花团可以吸收多余的SO2,以防止污染环境。
浓硫酸的氧化规律
(1)常温下与某些活泼金属单质(如Zn)反应,浓硫酸表现强氧化性和酸
性,生成硫酸盐和SO2,浓硫酸变成稀硫酸后,继续反应生成的气体为H2。
(2)与不活泼金属单质(如铜)和非金属单质(如木炭)反应
①反应需要加热,还原产物一般是SO2,一般金属单质被氧化为高价态的硫酸盐,非金属单质被氧化为高价态氧化物或含氧酸;
②浓硫酸与金属单质反应时,既表现酸性又表现强氧化性,而与非金属单质反应时,只表现强氧化性;
③随着反应的进行,浓硫酸浓度变小,一旦变为稀硫酸,反应即停止。
(3)与某些还原性化合物反应,如与H2S、HI、HBr、FeCl2等物质反应。
Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O
Zn+H2SO4=ZnSO4++H2↑
(强氧化性+酸性)
(强氧化性)
1-9、11、12、14、15
11.考核木炭与浓硫酸产物的检验
C + 2H2SO4(浓)==CO2 ↑+ 2SO2 ↑+ 2H2O
△
通过水溶液会带出水蒸气,所以必须在①③前
验证产物中有SO2
吸收SO2
确认SO2吸收完全
验证产物中有CO2
检验SO2 除去SO2 确认无SO2 检验CO2
检验水蒸气
2SO2+O2+2H2O=2H2SO4
H2SO4+BaCl2=BaSO4↓+2HCl
还原性
SO2 + Na2CO3 = Na2SO3 +CO2
SO2遇品红生成不稳定无色物质,受热释放SO2,溶液恢复红色,温度降低,SO2在品红溶液中溶解度增大,溶液颜色变浅
A
(钝化)
(难挥发)
→加热
10
无现象
知识点二 硫酸盐 硫酸根离子的检验
1.常见硫酸盐
名称 重要性质 主要用途
硫酸钙 制作各种模型和医疗绷带;调节水泥的硬化速率
名称 重要性质 主要用途
硫酸钡 重晶石(BaSO4)不溶于水和酸,且不容易被X射线透过 生产其他钡盐的原料;用作“钡餐”
硫酸铜 硫酸铜可以用来检验水的存在;胆矾可以和石灰乳混合制成波尔多液
(2)除去粗盐中可溶性杂质的原理
Na2CO3必须在BaCl2之后加入,以除去过量的Ba2+
先Ba后Na,碱随意,一并过滤,再加酸
2FeO+4H2SO4(浓)=Fe2(SO4)3+SO2↑+4H2O
SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
SO2 + l2 + 2H2O = H2SO4 + 2Hl
Cu + 2H2SO4(浓)==CuSO4+ SO2 ↑+ 2H2O
△
2Cu+O2=2CuO
2CuO+2H2SO4=2CuSO4+ 2H2O
2Cu+O2+2H2SO4=2CuSO4+ 2H2O
①制备等质量CuSO4,消耗H2SO4少
②不产生污染性气体SO2
5SO2+2Na2S+2H2O=3S↓+4NaHSO3
III
SO2 + Cl2 + 2H2O = H2SO4 + 2HCl
①不同意 装置A中生成的Cl2中混有HCl,干扰氯离子的检验
②不同意 当Cl2过量时,Cl2与水反应生成HCl,干扰氯离子的检验
BaCl2溶液
SO2 + Cl2 + 2H2O = H2SO4 + 2HCl
化学
第五章 化工生产中的重要非金属元素
第一节 硫及其化合物
第2课时 硫酸 硫酸根离子的检验
知识点一 硫酸
1.硫酸的用途与工业制备
(1)用途
①重要的化工原料,可用于生产化肥、农药、炸药、染料和盐类等。
②用于精炼石油、金属加工前的酸洗、制取各种挥发性酸及用作干燥剂等。
硫酸
(2)工业制备
①三个阶段
a.二氧化硫的制取和净化。(造气阶段)
b.SO2氧化成SO3。(接触氧化阶段)
c.三氧化硫的吸收和硫酸的生成。(生成阶段)
2SO2+O2 2SO3
△
催化剂
SO3+H2O === H2SO4
[注意] ①工业上制取硫酸常用浓硫酸而不用水吸收SO3,原因是SO3与水反应为放热反应,易产生酸雾,影响SO3的吸收。
②金属冶炼时产生的二氧化硫废气经回收后也可用于制备硫酸。
2.稀硫酸的酸性
3.硫酸的物理性质
纯净的硫酸是____色黏稠状液体,密度比水大,能与水以任意比混
合,沸点____,难挥发。
无
高
H2SO4=2H++SO42-
①浓硫酸杯壁下流
②边加边搅拌
4.浓硫酸的特性
实例 浓H2SO4吸收水蒸气? 胆矾中滴加浓H2SO4
现象
原理
结论
应用
浓H2SO4腐蚀布、木、纸
蔗糖中滴加浓H2SO4
蔗糖中滴加浓H2SO4……
吸收结晶水(蓝→白)
CuSO4·5H2O = CuSO4+5H2O
浓H2SO4
①吸水性
干燥剂 (除NH3、 H2S、HBr、HI外)
碳化变黑
C12H22O11 12C + 11H2O
浓H2SO4
②脱水性
H、O按2:1脱去
吸收水蒸气
(物理变化)
(化学变化)
(化学变化)
体积膨胀,产生刺激性气味气体,放出大量的热
③强氧化性
常温下使Fe、Al等金属钝化
除Au、Pt以外的绝大多数金属都能与浓硫酸作用
(3)强氧化性:浓硫酸能氧化大多数金属单质和部分非金属单质。
①与金属单质反应
实验 操作
有气泡逸出
褪色
变为红色
蓝
a装置:通过可抽动的铜丝来控制反应的发生或停止。
c装置:浸有碱液的棉花团可以吸收多余的SO2,以防止污染环境。
浓硫酸的氧化规律
(1)常温下与某些活泼金属单质(如Zn)反应,浓硫酸表现强氧化性和酸
性,生成硫酸盐和SO2,浓硫酸变成稀硫酸后,继续反应生成的气体为H2。
(2)与不活泼金属单质(如铜)和非金属单质(如木炭)反应
①反应需要加热,还原产物一般是SO2,一般金属单质被氧化为高价态的硫酸盐,非金属单质被氧化为高价态氧化物或含氧酸;
②浓硫酸与金属单质反应时,既表现酸性又表现强氧化性,而与非金属单质反应时,只表现强氧化性;
③随着反应的进行,浓硫酸浓度变小,一旦变为稀硫酸,反应即停止。
(3)与某些还原性化合物反应,如与H2S、HI、HBr、FeCl2等物质反应。
Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O
Zn+H2SO4=ZnSO4++H2↑
(强氧化性+酸性)
(强氧化性)
1-9、11、12、14、15
11.考核木炭与浓硫酸产物的检验
C + 2H2SO4(浓)==CO2 ↑+ 2SO2 ↑+ 2H2O
△
通过水溶液会带出水蒸气,所以必须在①③前
验证产物中有SO2
吸收SO2
确认SO2吸收完全
验证产物中有CO2
检验SO2 除去SO2 确认无SO2 检验CO2
检验水蒸气
2SO2+O2+2H2O=2H2SO4
H2SO4+BaCl2=BaSO4↓+2HCl
还原性
SO2 + Na2CO3 = Na2SO3 +CO2
SO2遇品红生成不稳定无色物质,受热释放SO2,溶液恢复红色,温度降低,SO2在品红溶液中溶解度增大,溶液颜色变浅
A
(钝化)
(难挥发)
→加热
10
无现象
知识点二 硫酸盐 硫酸根离子的检验
1.常见硫酸盐
名称 重要性质 主要用途
硫酸钙 制作各种模型和医疗绷带;调节水泥的硬化速率
名称 重要性质 主要用途
硫酸钡 重晶石(BaSO4)不溶于水和酸,且不容易被X射线透过 生产其他钡盐的原料;用作“钡餐”
硫酸铜 硫酸铜可以用来检验水的存在;胆矾可以和石灰乳混合制成波尔多液
(2)除去粗盐中可溶性杂质的原理
Na2CO3必须在BaCl2之后加入,以除去过量的Ba2+
先Ba后Na,碱随意,一并过滤,再加酸
2FeO+4H2SO4(浓)=Fe2(SO4)3+SO2↑+4H2O
SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
SO2 + l2 + 2H2O = H2SO4 + 2Hl
Cu + 2H2SO4(浓)==CuSO4+ SO2 ↑+ 2H2O
△
2Cu+O2=2CuO
2CuO+2H2SO4=2CuSO4+ 2H2O
2Cu+O2+2H2SO4=2CuSO4+ 2H2O
①制备等质量CuSO4,消耗H2SO4少
②不产生污染性气体SO2
5SO2+2Na2S+2H2O=3S↓+4NaHSO3
III
SO2 + Cl2 + 2H2O = H2SO4 + 2HCl
①不同意 装置A中生成的Cl2中混有HCl,干扰氯离子的检验
②不同意 当Cl2过量时,Cl2与水反应生成HCl,干扰氯离子的检验
BaCl2溶液
SO2 + Cl2 + 2H2O = H2SO4 + 2HCl
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
