4.4化学式与化合价(第3课时)课件--2022-2023学年九年级化学人教版上册(共24张PPT)
文档属性
| 名称 | 4.4化学式与化合价(第3课时)课件--2022-2023学年九年级化学人教版上册(共24张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-23 22:46:02 | ||
图片预览







文档简介
(共24张PPT)
课题4 化学式与化合价
第四单元
自然界的水
第3课时
1.了解相对分子质量的含义,并能利用相对原子质量和相对分子质量进行物质组成的计算。
新课讲解
拓展延伸
随堂练习
课堂小结
新课导入
布置作业
本节重点
2.能看懂某些商品标签或说明书上标识的物质成分和含量。
新课讲解
拓展延伸
随堂练习
课堂小结
布置作业
新课导入
农业人员在研究氮肥的肥效时首先必须知道所施氮肥的含氮量;化工生产中某些产品质量的分析,也要设法测出其中某种元素的含量。在这些实践活动中,人们常常根据物质化学式来确定组成物质元素之间的质量关系。
新课讲解
拓展延伸
随堂练习
课堂小结
布置作业
新课导入
化学式能告诉我们这些信息吗?
含氮量
元素的含量
质量关系
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
新课导入
化学式的计算
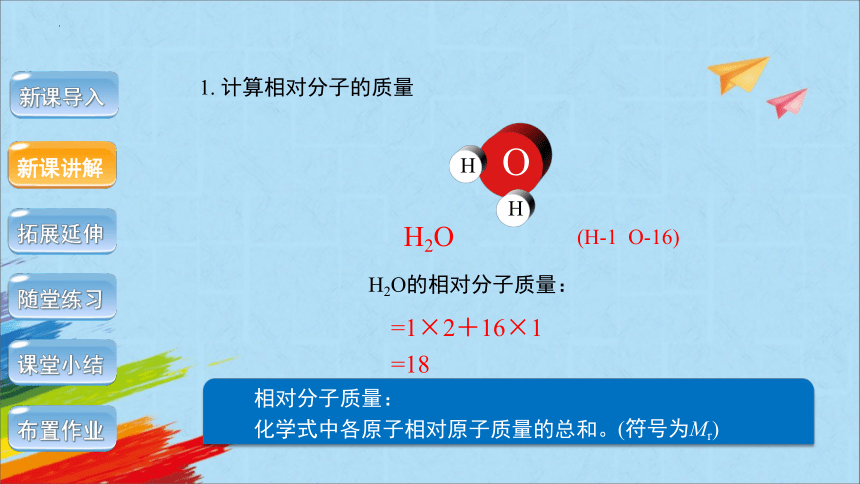
1. 计算相对分子的质量
H2O的构成:
真实质量:
1个水分子是由2个氢原子和1个氧原子构成的。
1个水分子的质量=2个氢原子的质量+1个氧原子的质量。
H2O
H
O
H
相对分子质量:
1个水分子的相对分子质量=2个氢原子的相对原子质量+1个氧原子的相对原子质量。
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
新课导入
1. 计算相对分子的质量
H2O的相对分子质量:
=1×2+16×1
=18
H2O
H
O
H
(H-1 O-16)
相对分子质量:
化学式中各原子相对原子质量的总和。
(符号为Mr)
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
新课导入
(1) O2的相对分子质量
=16×2
=32
(2) CO2的相对分子质量
=1×12
=44
+16×2
(3) CuSO4·5H2O的相对分子质量
=64+ 32+ 16×4
=250
+5 × (1×2+16)
计算:O2、CO2、 CuSO4·5H2O的相对分子质量。
(H-1 C-12 O-16 Cu-63.5 S-32)
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
新课导入
化学式要正确;
化学式中的原子团作为一个整体,若含多个同种原子团时,则把(原子团的相对原子质量总和)×原子团个数。
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
新课导入
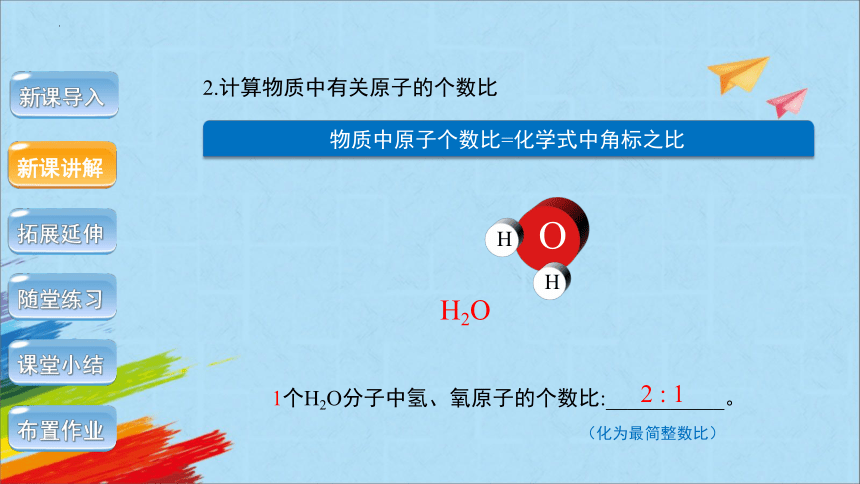
1个H2O分子中氢、氧原子的个数比:___________。
2 : 1
2.计算物质中有关原子的个数比
物质中原子个数比=化学式中角标之比
H2O
H
O
H
(化为最简整数比)
C6H12O6中碳、氢、氧原子的个数比为 :_________________。
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
新课导入
分别计算:
二氧化碳(CO2)、过氧化氢(H2O2)、葡萄糖(C6H12O6)的各原子个数之比。
CO2中碳原子和氧原子的个数比为:__________。
H2O2中氢原子和氧原子的个数比为:__________。
1 : 2
1 : 1
6 : 12 : 6
=1 : 2 : 1
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
新课导入
在化合物中,各元素质量之比就是各元素的原子个数与它的相对原子质量乘积之间的比值。
3.计算物质组成元素的质量比
(化为最简整数比)
计算:二氧化碳(CO2)中碳元素(C)和氧元素(O)的质量比。
m(C) : m(C) =
(16×2)
12 :
= 3 : 8
= 12 : 32
(C-12 O-16)
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
新课导入
01
看清各元素质量比的顺序;
02
结果约简成最简整数比;
03
区分元素质量比与原子个数比;
04
某些化学式中,同种元素并不写在一起的,这时要注意原子个数。
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
新课导入
计算:Ca(OH)2、H2O2 、NH4NO3 中各元素的质量比。
(H-1 C-12 N-14 O-16)
Ca(OH)2中钙、氧、氢元素的质量比
H2O2中氢、氧元素的质量比
NH4NO3中氮、氢、氧元素的质量比
=40 : (16×2) : (1×2)
=20 : 16 : 1
=1×2 : 16×2
=1 : 16
=(14×2) : (1×4) : (16×3)
=7 : 1 : 12
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
新课导入
4.计算物质中某元素的质量分数
某元素的质量分数,就是该元素的质量与组成物质的元素总质量之比,可根据化学式计算。
某元素的质量分数
×100%
=
该元素的相对原子质量×原子个数
该化合物的相对分子质量
计算:NH4NO3中氮元素的质量分数。
NH4NO3的相对分子质量
步骤1:
14×2+1×4+16×3
80
NH4NO3中氮元素的质量分数
14×2
80
×100%
35%
N元素的相对原子质量×N原子个数
NH4NO3的相对分子质量
×100%
=
步骤2:
=
=
=
=
(H-1 N-14 O-16)
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
新课导入
计算:CaCO3中碳元素的质量分数。
解:设该物质的相对分子质量为x。
答:该胃药的相对分子质量为200。
计算:某新型胃药的一个分子中含有5个氮原子,其中氮原子的质量分数约为35%,则其相对分子质量为多少?
CaCO3中碳元素的质量分数=
12
40+12+16 ×3
×100%
≈12%
(Ca-40 C-12 N-14 O-16)
145
x
×100%=35%
x=200
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
新课导入
5.计算一定质量的物质中某元素的质量
一定量某物质中某元素的质量=物质质量×该元素的质量分数
计算:已知氮元素的质量分数为35%,60 gNH4NO3中含有的氮的质量。
氮元素的质量= NH4NO3的质量×氮元素的质量分数
= 60 g×35%
= 21 g
答:60 gNH4NO3中含有的氮的质量为21 g。
(H-1 N-14 O-16)
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
新课导入
44
32
×100%=8 g
11 g ×
18
16
×100%=8 g
x g ×
x=9 g
设x克水中含有8 g氧元素,
计算:多少克水中含有的氧元素与11克二氧化碳中所含的氧元素质量相等?
(H-1 C-12 O-16)
答:9克水中含有的氧元素与11克二氧化碳中所含的氧元素质量相等。
解:
新课讲解
随堂练习
课堂小结
新课导入
布置作业
拓展延伸
真正的纯牛奶
配料:生牛乳
钙含量:在购买时,一般应选高于3.0克的纯牛奶,当然越高越好。
新课讲解
随堂练习
课堂小结
新课导入
布置作业
拓展延伸
1.食醋是厨房中常用的调味品,它的主要成分是乙酸,乙酸分子的模型如图所示,其中 代表一个碳原子, 代表一个氢原子, 代表一个氧原子。下列说法不正确的是( )
A.乙酸是一种化合物
B.乙酸的相对分子质量为60
C.乙酸中碳元素的质量分数为60%
D.乙酸分子中的碳原子、氢原子、氧原子的个数比为1∶2∶1
C
新课讲解
随堂练习
课堂小结
新课导入
布置作业
拓展延伸
3.水杨酸甲酯(化学式C8H8O3)常用作牙膏、化妆品的香料,也用于制止痛药。
请计算:
(1)水杨酸甲酯中碳、氧原子个数比 。
(2)水杨酸甲酯的相对分子质量为 。
8﹕3
152
2.下列计算或结果正确的是( )
A.Ca(OH)2的相对分子质量=40+16+1×2=58
B.SO2中硫元素与氧元素的质量比是2︰1
C.CO2中氧元素的质量分数 ×100%
D.54 g水中含有氢元素6 g
D
新课讲解
随堂练习
课堂小结
新课导入
布置作业
拓展延伸
(1)该分子的化学式为________,其相对分子质量为______。
(2)该物质中碳、氢元素的质量比为_________。
(3)该物质中碳元素的质量分数为___________(结果精确到0.1%)。
C6H6
78
12:1
92.3%
4. 如图为某分子的结构模型,请回答下列问题:
(C-12 O-16)
新课讲解
拓展延伸
随堂练习
新课导入
布置作业
课堂小结
计算相对分子质量
计算物质组成元素的质量比
计算物质中某元素的质量分数
计算一定质量的物质中某元素的质量
计算物质中有关原子个数的计算
课题4 化学式与化合价
第
3
课
时
01
02
相对分子质量的定义
有关相对分子质量的计算
通过本节课的学习,我们知道了:
布置作业
新课讲解
拓展延伸
随堂练习
课堂小结
新课导入
再见
课题4 化学式与化合价
第四单元
自然界的水
第3课时
1.了解相对分子质量的含义,并能利用相对原子质量和相对分子质量进行物质组成的计算。
新课讲解
拓展延伸
随堂练习
课堂小结
新课导入
布置作业
本节重点
2.能看懂某些商品标签或说明书上标识的物质成分和含量。
新课讲解
拓展延伸
随堂练习
课堂小结
布置作业
新课导入
农业人员在研究氮肥的肥效时首先必须知道所施氮肥的含氮量;化工生产中某些产品质量的分析,也要设法测出其中某种元素的含量。在这些实践活动中,人们常常根据物质化学式来确定组成物质元素之间的质量关系。
新课讲解
拓展延伸
随堂练习
课堂小结
布置作业
新课导入
化学式能告诉我们这些信息吗?
含氮量
元素的含量
质量关系
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
新课导入
化学式的计算
1. 计算相对分子的质量
H2O的构成:
真实质量:
1个水分子是由2个氢原子和1个氧原子构成的。
1个水分子的质量=2个氢原子的质量+1个氧原子的质量。
H2O
H
O
H
相对分子质量:
1个水分子的相对分子质量=2个氢原子的相对原子质量+1个氧原子的相对原子质量。
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
新课导入
1. 计算相对分子的质量
H2O的相对分子质量:
=1×2+16×1
=18
H2O
H
O
H
(H-1 O-16)
相对分子质量:
化学式中各原子相对原子质量的总和。
(符号为Mr)
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
新课导入
(1) O2的相对分子质量
=16×2
=32
(2) CO2的相对分子质量
=1×12
=44
+16×2
(3) CuSO4·5H2O的相对分子质量
=64+ 32+ 16×4
=250
+5 × (1×2+16)
计算:O2、CO2、 CuSO4·5H2O的相对分子质量。
(H-1 C-12 O-16 Cu-63.5 S-32)
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
新课导入
化学式要正确;
化学式中的原子团作为一个整体,若含多个同种原子团时,则把(原子团的相对原子质量总和)×原子团个数。
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
新课导入
1个H2O分子中氢、氧原子的个数比:___________。
2 : 1
2.计算物质中有关原子的个数比
物质中原子个数比=化学式中角标之比
H2O
H
O
H
(化为最简整数比)
C6H12O6中碳、氢、氧原子的个数比为 :_________________。
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
新课导入
分别计算:
二氧化碳(CO2)、过氧化氢(H2O2)、葡萄糖(C6H12O6)的各原子个数之比。
CO2中碳原子和氧原子的个数比为:__________。
H2O2中氢原子和氧原子的个数比为:__________。
1 : 2
1 : 1
6 : 12 : 6
=1 : 2 : 1
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
新课导入
在化合物中,各元素质量之比就是各元素的原子个数与它的相对原子质量乘积之间的比值。
3.计算物质组成元素的质量比
(化为最简整数比)
计算:二氧化碳(CO2)中碳元素(C)和氧元素(O)的质量比。
m(C) : m(C) =
(16×2)
12 :
= 3 : 8
= 12 : 32
(C-12 O-16)
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
新课导入
01
看清各元素质量比的顺序;
02
结果约简成最简整数比;
03
区分元素质量比与原子个数比;
04
某些化学式中,同种元素并不写在一起的,这时要注意原子个数。
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
新课导入
计算:Ca(OH)2、H2O2 、NH4NO3 中各元素的质量比。
(H-1 C-12 N-14 O-16)
Ca(OH)2中钙、氧、氢元素的质量比
H2O2中氢、氧元素的质量比
NH4NO3中氮、氢、氧元素的质量比
=40 : (16×2) : (1×2)
=20 : 16 : 1
=1×2 : 16×2
=1 : 16
=(14×2) : (1×4) : (16×3)
=7 : 1 : 12
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
新课导入
4.计算物质中某元素的质量分数
某元素的质量分数,就是该元素的质量与组成物质的元素总质量之比,可根据化学式计算。
某元素的质量分数
×100%
=
该元素的相对原子质量×原子个数
该化合物的相对分子质量
计算:NH4NO3中氮元素的质量分数。
NH4NO3的相对分子质量
步骤1:
14×2+1×4+16×3
80
NH4NO3中氮元素的质量分数
14×2
80
×100%
35%
N元素的相对原子质量×N原子个数
NH4NO3的相对分子质量
×100%
=
步骤2:
=
=
=
=
(H-1 N-14 O-16)
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
新课导入
计算:CaCO3中碳元素的质量分数。
解:设该物质的相对分子质量为x。
答:该胃药的相对分子质量为200。
计算:某新型胃药的一个分子中含有5个氮原子,其中氮原子的质量分数约为35%,则其相对分子质量为多少?
CaCO3中碳元素的质量分数=
12
40+12+16 ×3
×100%
≈12%
(Ca-40 C-12 N-14 O-16)
145
x
×100%=35%
x=200
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
新课导入
5.计算一定质量的物质中某元素的质量
一定量某物质中某元素的质量=物质质量×该元素的质量分数
计算:已知氮元素的质量分数为35%,60 gNH4NO3中含有的氮的质量。
氮元素的质量= NH4NO3的质量×氮元素的质量分数
= 60 g×35%
= 21 g
答:60 gNH4NO3中含有的氮的质量为21 g。
(H-1 N-14 O-16)
拓展延伸
随堂练习
课堂小结
布置作业
新课讲解
新课导入
44
32
×100%=8 g
11 g ×
18
16
×100%=8 g
x g ×
x=9 g
设x克水中含有8 g氧元素,
计算:多少克水中含有的氧元素与11克二氧化碳中所含的氧元素质量相等?
(H-1 C-12 O-16)
答:9克水中含有的氧元素与11克二氧化碳中所含的氧元素质量相等。
解:
新课讲解
随堂练习
课堂小结
新课导入
布置作业
拓展延伸
真正的纯牛奶
配料:生牛乳
钙含量:在购买时,一般应选高于3.0克的纯牛奶,当然越高越好。
新课讲解
随堂练习
课堂小结
新课导入
布置作业
拓展延伸
1.食醋是厨房中常用的调味品,它的主要成分是乙酸,乙酸分子的模型如图所示,其中 代表一个碳原子, 代表一个氢原子, 代表一个氧原子。下列说法不正确的是( )
A.乙酸是一种化合物
B.乙酸的相对分子质量为60
C.乙酸中碳元素的质量分数为60%
D.乙酸分子中的碳原子、氢原子、氧原子的个数比为1∶2∶1
C
新课讲解
随堂练习
课堂小结
新课导入
布置作业
拓展延伸
3.水杨酸甲酯(化学式C8H8O3)常用作牙膏、化妆品的香料,也用于制止痛药。
请计算:
(1)水杨酸甲酯中碳、氧原子个数比 。
(2)水杨酸甲酯的相对分子质量为 。
8﹕3
152
2.下列计算或结果正确的是( )
A.Ca(OH)2的相对分子质量=40+16+1×2=58
B.SO2中硫元素与氧元素的质量比是2︰1
C.CO2中氧元素的质量分数 ×100%
D.54 g水中含有氢元素6 g
D
新课讲解
随堂练习
课堂小结
新课导入
布置作业
拓展延伸
(1)该分子的化学式为________,其相对分子质量为______。
(2)该物质中碳、氢元素的质量比为_________。
(3)该物质中碳元素的质量分数为___________(结果精确到0.1%)。
C6H6
78
12:1
92.3%
4. 如图为某分子的结构模型,请回答下列问题:
(C-12 O-16)
新课讲解
拓展延伸
随堂练习
新课导入
布置作业
课堂小结
计算相对分子质量
计算物质组成元素的质量比
计算物质中某元素的质量分数
计算一定质量的物质中某元素的质量
计算物质中有关原子个数的计算
课题4 化学式与化合价
第
3
课
时
01
02
相对分子质量的定义
有关相对分子质量的计算
通过本节课的学习,我们知道了:
布置作业
新课讲解
拓展延伸
随堂练习
课堂小结
新课导入
再见
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
